对饮用水中疑似铜绿假单胞菌的复核鉴定论文
2024-04-28 10:09:21 来源: 作者:liyuan
摘要:铜绿假单胞菌是一种不允许在饮用水中检出的条件致病菌,本文对 10 株分离自饮用水样 品的菌株进行了菌落形态观察及生化反应确证,并使用 HK-MID 细菌鉴定系统、VITEK 2 全自动 微生物鉴定系统和 16S rRNA 基因测序等多种手段进行进一步鉴定。鉴定结果表明,部分菌株并非 铜绿假单胞菌,但均为条件致病菌,从食品安全的角度考虑,不应出现在饮用水、矿泉水中。本文除 了探讨以往的研究普遍关注的检验方法的准确性与时效性,还对这些菌株进行了分析,为相关管理 部门进行质量监督、制定标准提供了研究依据和借鉴。
摘 要:铜绿假单胞菌是一种不允许在饮用水中检出的条件致病菌,本文对 10 株分离自饮用水样 品的菌株进行了菌落形态观察及生化反应确证,并使用 HK-MID 细菌鉴定系统、VITEK 2 全自动 微生物鉴定系统和 16S rRNA 基因测序等多种手段进行进一步鉴定。鉴定结果表明,部分菌株并非 铜绿假单胞菌,但均为条件致病菌,从食品安全的角度考虑,不应出现在饮用水、矿泉水中。本文除 了探讨以往的研究普遍关注的检验方法的准确性与时效性,还对这些菌株进行了分析,为相关管理 部门进行质量监督、制定标准提供了研究依据和借鉴。
关键词:铜绿假单胞菌;HK-MID 细菌生化鉴定系统;VITEK 2 全自动微生物鉴定系统;16S rRNA 基因测序
铜绿假单胞菌(Pseudomonas aeruginosa)又称绿 脓杆菌,为革兰氏阴性杆菌,属于专性需氧非发酵菌 类假单胞菌属,广泛分布于自然界的水、土壤、空气 中,存在于人和动物的皮肤、肌体、呼吸道和消化道 中。当该菌在特定条件下的数量超过人体正常的稳 态调节范围时,会引起急性肠道炎、脑膜炎、败血症 和皮肤炎症等疾病,是一种常见的条件致病菌。鉴 于铜绿假单胞菌的致病性 ,我国饮用水标准 GB 19298-2014《食品安全国家标准 包装饮用水》和饮 用矿泉水标准 GB 8537-2018《食品安全国家标准 饮用天然矿泉水》对铜绿假单胞菌的限量为每 250 mL 水样中铜绿假单胞菌不得检出。
目前对饮用水中铜绿假单胞菌的检测,主要使 用 GB 8538-2022《食品安全国家标准 饮用天然矿 泉水检验方法》[1] 中的滤膜法(以下简称 GB 8538- 2022 法),即观察 CN 琼脂平板上生长的可疑菌落 的形态并对其进行生化反应确证,确认该平板上是 否存在铜绿假单胞菌阳性菌株。除此之外,一些行 业检测标准及研究中还兼用其他检验方法[2-4]来确 认菌株是否为铜绿假单胞菌。其中,细菌生化鉴定系统是常见的菌株鉴定手段,其中常用的鉴定系统 包括 HK -MID 细 菌 生化 鉴 定 系 统 和 VITEK 2 Compact 全自动微生物鉴定系统[5]。与按细菌生化反 应来鉴定其种属的检验方法相比,基因测序更为准 确[6]。而在以基因测序的方法鉴定铜绿假单胞菌的 研究中,除了选择某段特定基因序列设计的引物进 行特异性扩增后再测序外[7],16S rRNA 基因测序也 被广泛运用[8-9]。在以往应用细菌生化鉴定系统和基 因测序等众多手段检测铜绿假单胞菌的研究中,大 多数研究的重点在于检验方法的准确性与时效性, 便于选择更准确、高效的方法来鉴别目标菌株,但对 GB 8538-2022 方法在 CN 琼脂平板上分离出的非 铜绿假单胞菌的细菌没有过多深入研究。本研究对 采用 GB 8538-2022 法在 CN 琼脂平板上生长的 10 株可疑菌落的菌株进行了检测,同时采用 HK-MID 细菌生化鉴定系统、VITEK 2 Compact 全自动微生 物鉴定系统和 16S rRNA 基因测序进行了进一步的 鉴定研究,最终以 16S rRNA 基因测序的结果作为 判定依据,来确认菌株的种属。
1 材料与方法
1.1材料
1.1.1试验用菌株
标准菌株:铜绿假单胞菌ATCC27853、铜绿假单胞菌CICC21630,均购自中国工业微生物菌种保藏中心;样品菌株1、2、3、4、5、6、7、8、9、10均来自饮用水样品,用GB8538-2022法将其从CN琼脂平板上分离,目前保藏于国家食品监督检验中心微生物实验室。
1.1.2培养基及试剂
CN琼脂假单胞菌琼脂基础培养基、绿脓菌素测定用培养基、营养琼脂、乙酰胺肉汤、钠氏试剂、氧化酶试剂,均购自北京陆桥技术股份有限公司;十六烷三甲基溴化铵琼脂、乙酰胺琼脂、SCDLP液体培养基,均购自青岛海博生物技术有限公司;细菌基因组DNA提取试剂盒,购自天根生化科技(北京)有限公司;16SrRNA基因通用引I物27F(5”-A-GAGTTTGATCCTGGCTCAG-3’)和1492R(5”TACGGTTACCTTGTTACGACTT-3’由华大基因合成;PCR扩增及凝胶电泳所用试剂,均购自北京全式金生物技术有限公司。
1.1.3仪器及耗材
WFH-203B三用紫外分析仪产自上海驰唐电子有限公司;HK-MID细菌生化鉴定系统:配GNA+B革兰氏阴性杆菌鉴定条产自广东环凯生物科技有限公司;VITEK2Compact全自动微生物鉴定系统:配套革兰氏阴性细菌鉴定卡(VITEK2GN卡)以及生理盐水和一次性透明塑料试管均产自法国梅里埃公司;DensiCHEKplus比浊仪产自法国梅里埃公司;BioDropuLite超微量核酸蛋白测定仪产自英国柏点公司;TProfessionalTrioPCR仪产自德国耶章分析仪器股份公司;JY300C电泳仪及电泳槽产自北京君意东方电泳设备有限公司;QUANTUM-ST5全自动凝胶成像系统产自北京五洲东方科技发展有限公司。
1.2方法
1.2.1菌株的活化
将实验室保藏的标准菌株及样品菌株,分别划线接种于假单胞菌琼脂基础培养基/CN琼脂、十六烷三甲基溴化铵琼脂和乙酰胺琼脂三种不同的培养基平板上,36°℃培养48h。
1.2.2菌落形态观察
观察三种培养基上的菌落形态,必要时将其置于紫外线下观察,判断菌落是否存在荧光。对于三种培养基上生长的疑似菌落,按照GB8538-2022法进行生化反应确证试验。
1.2.3生化反应确证试验
产氨试验:将CN琼脂上发荧光、非蓝色且非绿色的菌落,或不发荧光、红褐色菌落纯培养物接种到乙酰胺液体培养基中,接种乙酰胺肉汤,36°℃培养24h后滴加1~2滴钠氏试剂,10s内检查试管的颜色变化,若表现出从黄色到转红色的颜色变化,则结果为阳性,否则为阴性。42°℃生长试验:将CN琼脂上发荧光、非蓝色且非绿色菌落的纯培养物接种到营养琼脂平板上,42°C培养48h,能生长的为阳性结果,否则为阴性。
1.2.4HK-MID细菌生化鉴定系统
氧化酶试验:取2^3滴氧化酶试剂于无菌平血为的洁净滤纸上,用一次性塑料接菌环挑取培养物涂抹在滤纸上,10s内显示为深蓝紫色的为阳性反应。GNA+B革兰氏阴性杆菌鉴定试剂条进行鉴定:挑取单菌落至营养琼脂平板上,划线分离,36°℃培养24h后,自营养琼脂平板上挑取1个新鲜菌落至5mL无菌0.85%的氯化钠溶液中,混合均匀。将制得的菌悬液滴加至GNA+B的鉴定试剂条上,36C培养48h后观察并记录相关反应,在MicrogenID软件上读取鉴定结果。
1.2.5VITEK2Compact全自动微生物鉴定系统
将菌液滴加至 HK-MID 细菌生化鉴定系统的同时,再从36°℃培养24h的营养琼脂平板上挑取单菌落,放入含有3mL0.9%氯化钠溶液的一次性透明塑料试管中,制成浊度为0.48~0.61的均匀菌悬液。将试管放置在VITEK2Compact全自动微生物鉴定系统的载卡架上,将VITEK2GN卡导管插入菌悬液中。按VITEK2Compact全自动微生物鉴定系统的操作说明书,对测菌悬液进行充填、装载,并在VITEK2Systems软件中进行设定,次日观察鉴定结果。
1.2.616SrRNA基因测序
自营养琼脂平板上挑取1个新鲜菌落至SCDLP 液体培养基中,36 ℃培养至培养基浑浊。按 照细菌基因组 DNA 提取试剂盒说明书上的操作步 骤,提取标准菌株和样品菌株的 DNA。在确认 DNA 纯度和浓度均符合 PCR 扩增要求后 ,使用 16S rRNA 基因通用引物 27F 和 1492R 对菌株的 DNA 进行 PCR 扩增。PCR 反应体系为: 引物 27F 和 1492R 各 1 μL,10×Easy Taq Buffer(Mg2+Plus)2.5 μL,High Pure dNTP (2.5mM)2 μL,Bovine Serum Albumin 0.3 μL,Easy Taq DNA Polymerase 0.2 μL, DNA 模板 2 μL,DNase/RNase-free Deionized water 16 μL,合计总体积 25 μL。PCR 反应条件为:95 ℃ 预变性 5 min;94 ℃变性 1 min,55 ℃退火 1 min,72 ℃延伸 1.5 min,该流程共循环 30 次;最后 72 ℃延 伸 10 min。扩增完成后,用凝胶电泳检测扩增产物, 并将具有 16S rRNA 基因片段的目的条带送至华大 基因进行基因测序。
2 结果与分析
2.1 标准菌株及样品菌株的菌落形态及初 步生化反应确证试验结果
目前标准方法中铜绿假单胞菌的选择性培养基 主要为 CN 琼脂[1,10]、十六烷三甲基溴化铵琼脂[11-12]和 乙酰胺琼脂[11],如果样品菌株仅能在 CN 琼脂上生 长,而不能在十六烷三甲基溴化铵琼脂、乙酰胺琼脂培养基上生长,则表明 CN 琼脂的选择性较差。对 10 个样品菌株及作为阳性对照的 2 个铜绿假单胞 菌标准菌株的菌落形态进行观察及初步生化确证试 验的结果见表 1。
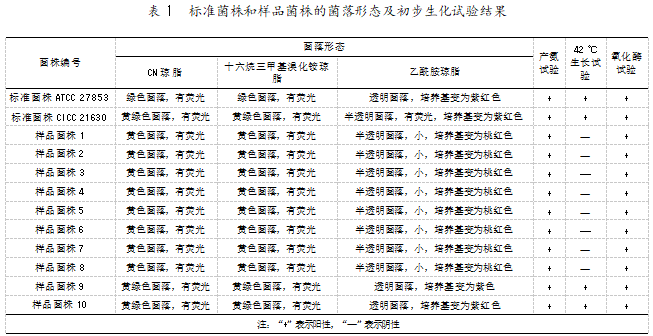
由表 1 可知,2 个标准菌株和 10 个样品菌株均 能在三种培养基上生长,说明本试验中 CN 琼脂培 养基的选择性较好。其中只有 2 个标准菌株和样品 菌株 9、10 的菌落形态符合 GB 8538-2022 法中铜 绿假单胞菌的特征形态,结合产氨试验和 42 ℃生长 试验结果,可判定样品菌株 9、10 为铜绿假单胞菌, 样品菌株 1~8 中的疑似菌落为非铜绿假单胞菌。
2.2 标准菌株及样品菌株氧化酶试验结果
按 HK-MID 细菌生化鉴定系统说明书的要求, 首先对待测菌株进行氧化酶试验以确定使用鉴定试 剂条的种类。10 个样品菌株及 2 个标准菌株的氧化 酶试验结果见表 1。由表 1 可知,10 个样品菌株及 2 个标准菌株的氧化酶试验结果均为阳性,因此选择 GN A+B 革兰氏阴性杆菌鉴定试剂条进行后续鉴 定。
2.3 标准菌株及样品菌株的PCR 产物凝胶电泳结果
为了知晓 PCR 产物是否含有目的基因片段,需 要先对其进行凝胶电泳测定,10 个样品菌株及 2 个 标准菌株的 PCR 产物凝胶电泳结果见图 1。
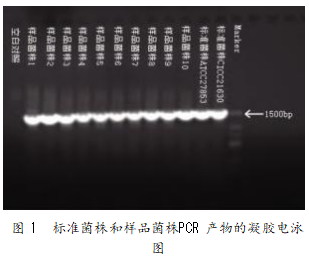
由图 1 可知,样品菌株 1~10 及 2 个标准菌株 的 PCR 产物在 1 500 bp 处均有清晰明亮的条带,证 明已成功扩增出了可用于测序的 16S rRNA 基因片 段,可进行下一步的基因测序。
2.4 标准菌株及样品菌株的HK-MID 细菌生化鉴定系统、VITEK 2 Compact 全自动微生物鉴定系 统及 16S rRNA 基因测序的鉴定结果对比
为了确认 10 个样品菌株的种属,运用 HK-MID 细菌生化鉴定系统、VITEK 2 Compact 全自动微生 物鉴定系统及 16S rRNA 基因测序三种不同的微生 物鉴定方法,对样品菌株进行检测,并以标准菌株 ATCC 27853 和 CICC 21630 为阳性对照。结果见表 2。
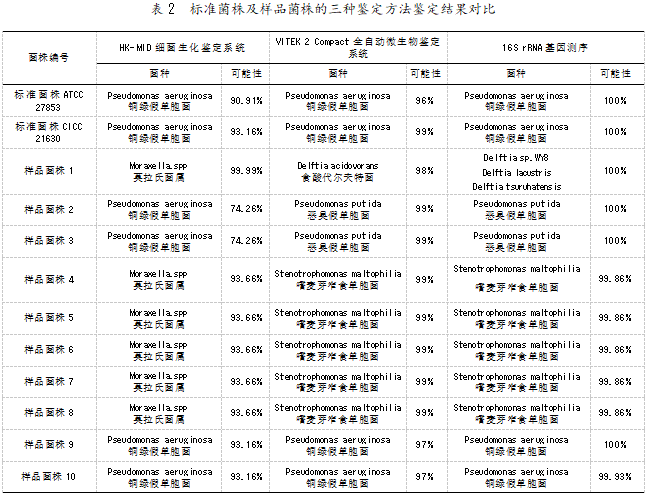
由表 2 可知,经过上述三种鉴定方法的检测,标 准菌株 ATCC 27853、CICC 21630 和样品菌株 9、10 均被判定为铜绿假单胞菌,且可能性都在 90%以 上,结果与 GB 8538-2022 法的判定结果一致。说明 三种鉴定方法均可用于鉴定饮用水中的铜绿假单胞 菌。
然而以 16S rRNA 基因测序结果作为最终判定 依据进行比较后发现,HK-MID 细菌生化鉴定系统 将样品菌株 1、4~8 共六株菌均被误判为莫拉氏菌属(Moraxella.spp)。同时 ,将属于恶臭假单胞菌 (Pseudomonas putida)的样品菌株 2、3 误判为铜绿 假单胞菌。造成该现象的原因推测为:广东环凯生 物科技有限公司提供的《HK-MID 革兰氏阴性杆菌 生化鉴定系统使用说明书》的数据表中,没有代尔夫 特 菌 属 (Delftia) 和 嗜 麦 芽 窄 食 单 胞 菌 (Stenotrophomonas maltophilia)的相关数据,导致样 品菌株 1、4~8 被误判为莫拉氏菌属。
与 HK-MID 细菌生化鉴定系统相比,梅里埃公 司的VITEK 2 Compact 全自动微生物鉴定系统不仅 可明确将食酸代尔夫特菌(Delftia acidovorans)、嗜 麦芽窄食单胞菌与莫拉氏菌属区分开,还正确鉴定 出了样品菌株 2、3 为恶臭假单胞菌。对于样品菌株 1,VITEK 2 Compact 的鉴定结果为食酸代尔夫特菌 (Delftia acidovorans),而 16S rRNA 基因测序的结果 显示该菌种为 Delftia sp. WY8、Delftia lacustris 和 Delftia tsuruhatensis,虽然菌种不同,但均为代尔夫 特菌属细菌。可见,VITEK 2 Compact 全自动微生物 鉴定系统的检测范围更加广泛,鉴定结果也更精准。
2.5 标准菌株及样品菌株的系统发育树
为了更直观地表达上述细菌之间的亲缘关系, 首先将 2 个标准菌株和 10 个样品菌株用 16S rDNA 的测序结果在 NCBI 数据库中进行 BLAST 比对,得 出了具体的所属菌种。并采用 MEGA 软件绘制系统 发育树呈现其结果,见图 2。

从图 2 可以看出,同属铜绿假单胞菌(Pseu- domonas aeruginosa)的标准菌株 ATCC 27853、CICC 21630 和样 品菌株 9、10,与同属恶臭假单胞菌 (Pseudomonas putida)的样品菌株 2、3 的亲缘关系最近,与同属嗜麦芽窄食单胞菌(Stenotrophomonas maltophilia)的样品菌株 4~8 的亲缘关系次之,而与 代尔夫特菌属(Delftia)样品菌株 1 的亲缘关系最 远。
3 结论与讨论
从研究结果可知,由于 HK-MID 细菌生化鉴定 系统中的 GN A+B 革兰氏阴性杆菌鉴定条的生化反 应孔数量较少、判定信息不足、数据库细菌种类不够 全面等,导致该系统的误判几率很大,而 VITEK 2 Compact 全自动微生物鉴定系统包含更多详细的生 化反应信息和精密仪器,其鉴定结果更加精确,可用 来进行最终的菌株判定。同时,VITEK 2 Compact 全 自动微生物鉴定系统及 16S rRNA 基因测序均可以 对疑似菌株进行精确鉴定。
值得注意的是,这些疑似铜绿假单胞菌的菌株 中包含食酸代尔夫特菌、恶臭假单胞菌和嗜麦芽窄 食单胞菌等细菌。其中,食酸代尔夫特菌可能会使免 疫力低下的病患产生伤口感染及多种炎症[13];恶臭 假单胞菌也是条件致病菌[7],且发生过医院感染的 情况[14];嗜麦芽窄食单胞菌也会引起多种炎症与感 染[15-19],其中最常见的是血液和呼吸道感染[20-23],这 两种感染的发病率和死亡率较高[24-25]。因此,出于对 消费者健康和公共卫生安全的考虑,在包装饮用水、 矿泉水乃至水源水中,除了铜绿假单胞菌之外,其他 条件致病菌(如代尔夫特菌属、恶臭假单胞菌、嗜麦 芽窄食单胞菌等)也应当受到重视,相关部门适当监 督并控制这些细菌的造成污染非常有必要。
参 考 文 献
[1] 中华人民共和国国家卫生健康委员会, 国家市场监督 管理总局. 食品安全国家标准 饮用天然矿泉水检验方 法: GB 8538-2022[S]. 北京: 中国标准出版社, 2022.
[2] 中华人民共和国国家质量监督检验检疫总局. 化妆品 微生物检验方法 绿脓杆菌 PCR 法: SN/T 2206.12-2014 [S]. 北京: 中国标准出版社, 2014.
[3] 中华人民共和国海关总署. 出口食品中病原微生物快 速筛选方法 MALDI-TOP MS 法: SN/T 5228.9-2019[S]. 北京: 中国标准出版社, 2019.
[4] 宁夏回族自治区市场监督管理厅. 包装饮用水中铜绿 假单胞菌的快速检测方法: DB64/T 1682-2019[S]. 北京: 中国标准出版社, 2019.
[5] Moehario Lucky Hartati, et al. Performance of TDR-300B and VITEK® 2 for the identification ofPseudomonas aerugi- nosa in comparison with VITEK® -MS[J]. Journal of In- ternational Medical Research, 2021, 49 (2): 0300060521989893-0300060521989893.
[6] EBP, EAC, TDH. The Use of Tn-Seq and the FiTnEss Analysis to Define the Core Essential Genome of Pseu- domonas aeruginosa[J]. Methods in Molecular Biology (Clifton, N.J.), 2022: 2377179-197.
[7] OMBEGA M J, ZHONG H Z. Loop Mediated Isothermal Amplification as a Rapid Molecular Method for Pseu- domonas aeruginosa T3SS ExoY Gene Septicemia Detec- tion in Beta- Lactamase Species Co-Infections[J].Current Journal of Applied Science and Technology, 2021: 19-29.
[8] 张庆勋, 景胜凡, 韩姝伊, 等. 水貂源铜绿假单胞菌的分 离鉴定、耐药性及毒力基因检测[J]. 中国畜牧兽医, 2021, 48(6): 2230-2237.
[9] 邹洁建, 古河祥, 翟俊琼, 等. 小熊猫源铜绿假单胞菌耐 药性和耐药基因的研究[J]. 野生动物学报, 2021, 42(2): 437-444.
[10] 中华人民共和国福建出入境检验检疫局, 中国检验检 疫科学研究院. 进出 口食品中绿脓杆菌检测方法: SN/T 2099-2008[S]. 北京: 中国标准出版社, 2019.
[11] 卫生部. 化妆品微生物标准检验方法 绿脓杆菌: GB7918.4-1987[S]. 北京: 中国标准出版社, 1987.
[12] 中华人民共和国海关总署. 出口食品中病原微生物快 速筛选方法 MALDI-TOP MS 法 : SN/T 5228.9-2019 [S]. 北京: 中国标准出版社, 2019.
[13] DEB AMIT K, CHAVHAN PRATIMA, CHOWDHURY SUSHMITA S, et al. Endophthalmitis due to Delftia aci- dovorans: An unusual ocular pathogen[J]. Indian Journal of Ophthalmology, 2020, 68(11): 2591-2594.
[14] BAYKAL HÜSNÜ, ÜELIK DENIZ, ÜLGER A. FÜSUN, et al. Clinical features, risk factors, and antimicrobial re- sistance of Pseudomonas putida isolates[J]. Medicine, 2022, 101( 48): e32145.
[15] HUSAIN UNEZA, GUPTA VIVEK. Liver abscess caused by multidrug-resistant pathogen Stenotrophomonas mal- tophilia: A rare case report[J]. Journal of Family Medicine and Primary Care, 2023,12(1) :174-176.
[16] HSU ALICE J, SIMNER PATRICIA J, BERGMAN YEHUDIT, et al. Successful Treatment of Persistent Stenotrophomonas maltophilia Bacteremia With Cefide-rocol in an Infant[J]. Open Forum Infectious Diseases. 2023, 10(4):174.
[17] VALENTINO L , CARLOS L , PABLO S , et al . Stenotrophomonas maltophilia Periprosthetic Joint Infec- tion after Hip Revision Arthroplasty[J]. Hip Pelvis, 2023, 35(2): 142-146.
[18] IKUMI T, NAONORI H, MAKOTO N, et al.Fulminant Metastatic Cellulitis Caused by Stenotrophomonas Mal- tophilia Infection and Subsequent Candida Parapsilosis Fungemia After Cord Blood Transplantation[J].Trans- plantation Proceedings, 2023, 55(3): 706-710.
[19] MARC R, MARC H A, RACHA I, et al. Stenotrophomonas maltophilia pneumonia in critical COVID-19 patients. [J]. Scientific Reports, 2023, 13(1): 3392-3392.
[20] HADIS D, YOUSEF M A, LEILI S. Molecular Epidemi- ology of Stenotrophomonas maltophilia Strains Isolated from Bacteremia in Hospitalized Children[J]. Oman medi- cal Journal, 2023, 38(3): e505-e505.
[21] HUMAYOUN M R, YAMIN N S B, ALIAA M, et al. Cefiderocol as a Treatment Option for Stenotrophomonas maltophilia Causing Hospital-Acquired/Ventilator-Asso- ciated Pneumonia[J]. Cureus, 2023, 15(5): e38613-e38613.
[22] LARINA P, P R S, SHIVAKIRAN A, et al. Functional network analysis identifies multiple virulence and antibi- otic resistance targets in Stenotrophomonas maltophilia [J]. Microbial Pathogenesis, 2023, 183106314-106314.
[23] NATÁLIA T A D, RONALDO J M, FERNANDO L L B, et al. Synergistic combination of aztreonam and cef- tazidime/avibactam against resistant Stenotrophomonas maltophilia on pancreatitis[J]. Journal of Infection in De- veloping Countries, 2023, 17(6): 881-885.
[24] LIANG C, JIE H, SHUJIE H, et al. Assessment of the relative benefits of monotherapy and combination therapy approaches to the treatment of hospital-acquired Stenotrophomonas maltophilia pneumonia: a multicenter, observational, real-world study[J]. Annals of Intensive care, 2023, 13(1): 47-47.
[25] PATCHRAPA B, WORAPONG N, NARISORN L, et al. The Activities of Antimicrobials Against Stenotrophomonas maltophilia Isolates and Evaluation of Clinical Outcomes Among Treatment Regimens in Pa- tients with Stenotrophomonas maltophilia Infections: A Retrospective Multicenter Cohort Study[J]. Infection and Drug Resistance, 2023, 165173-5184.










