人类肠道菌群活菌保存的研究进展论文
2025-04-25 11:08:18 来源: 作者:xujingjing
摘要:肠道菌群对于人体健康具有重要的作用。当前,随着人们逐渐认识到肠道菌群的重要性,肠道菌群研究成为研究热点,同时肠道菌群的保存也受到了广泛关注。基于此,文章介绍了肠道菌群的组成及保存方法,对比分析了不同保存手段,并探究了不同因素对保存效果的影响,以及不同保存评价标准的优劣。
摘要:肠道菌群对于人体健康具有重要的作用。当前,随着人们逐渐认识到肠道菌群的重要性,肠道菌群研究成为研究热点,同时肠道菌群的保存也受到了广泛关注。基于此,文章介绍了肠道菌群的组成及保存方法,对比分析了不同保存手段,并探究了不同因素对保存效果的影响,以及不同保存评价标准的优劣。
关键词:肠道菌群;活性保存;粪菌移植;保存评价;保存影响因素
近年来,随着培养组学和高通量测序的发展,肠道菌群的研究取得了显著进展。肠道细菌在参与机体代谢[1]、抵御病原体[2]和调节免疫[3]等方面发挥着重要作用。肠道细菌组成上的改变,与多项炎症性疾病[4]、代谢疾病[5]和神经性疾病[6]的发病机制存在密切关联。研究肠道菌群的组成和功能对疾病的预防、诊断及有效治疗具有突出的支撑和促进作用,同时利用粪菌移植治疗多种肠道代谢疾病也逐步进入大众视野。
粪菌移植(fecal microbiota transplantation,FMT)作为一种创新疗法,强调将健康人的粪便转化为液体形式,通过特定途径移植到患者体内,以利用健康粪便中的功能菌群重建患者体内的肠道菌群多样性,实现对疾病的有效治疗[7-8]。近年来,FMT在生物学和临床医学领域引起了广泛关注,然而如何有效地储存粪菌仍是一项严峻挑战[9]。在现有储存方法中,将粪菌于-80℃下冷冻是较为常见的技术手段。研究表明,尽管冷冻菌液和新鲜菌液在治疗上的效果相近,但相较于新鲜样本,冻干样本的治疗效果仍要略逊一筹[10]。因此,保存方法对粪菌活性及功能发挥具有重要影响。粪菌移植和肠道细菌研究的发展,有利于促进肠道菌群保存条件及方式的优化。
本文阐述了肠道菌群组成和功能的相关概念,总结了肠道菌群的保存方式和保存效果的影响因素,比较了群落组成和代谢物两方面的评价方法,并分析了现有保存方法的不足,以及对未来新型保存方法的展望,以期为未来肠道菌群保存研究提供借鉴。
1肠道菌群
1.1肠道菌群的基本介绍
1.1.1肠道菌群的功能
肠道菌群在维持人体健康方面发挥着重要作用,能显著提高肠道完整性,塑造肠道上皮结构,维护肠道环境稳定性。肠内微生物群落构筑起的首个防卫屏障——肠壁,能够有效阻隔外界致病因子的侵袭。肠道菌群还与宿主免疫系统、中枢神经系统,以及肠神经系统间存在密切的交互作用[11]。研究表明,肠道微生物的不同构成与多种突发性和长期性疾病的发生密切相关。例如,某些特定的肠道细菌比例可能会加剧癌症[12]、肥胖[13]、老年痴呆[14]、代谢异常[15]等疾患风险。因此,对肠内微生物群落结构及其功能性的研究,在疾病诊断和治疗上占据着重要地位。
在肠道菌群的代谢产物中,短链脂肪酸(SC-FAs)是一类重要的化合物,在肠道中发挥着多种关键作用。例如,丙酸盐、丁酸盐和醋酸盐3种主要的SCFAs通常以特定比例存在,有助于维持肠道内的平衡[16]。这些SCFAs能够被肠道上皮细胞迅速吸收,并参与多种细胞调节过程,包括基因表达、细胞趋化、分化、增殖和凋亡[17]。乙酸盐是由肠道厌氧菌产生的;丙酸盐和丁酸盐则是由不同的肠道细菌亚群通过分子途径产生的[18]。丁酸由糖酵解和乙酰辅酶a作用产生,而丙酸则可通过琥珀酸或丙二醇2种途径形成,且主要取决于糖的性质[19]。除参与细胞过程的调节外,SCFAs还在免疫系统和炎症反应调节中发挥着重要作用。
1.1.2肠道菌群的组成
肠道菌群包括定栖于消化道中的多种原核与真核微生物,包括细菌、古细菌及真菌等,与人类宿主间形成了一整套互惠互利的关系机制[20-21]。这些微生物共同体通过长达数千年的共同进化,在维持人类健康的过程中扮演着关键角色。目前,针对肠道微生物领域的研究成果颇丰,成功辨识了12个不同门中的2 172种属。在这些物种中,变形菌门、厚壁菌门、放线菌门和拟杆菌门尤为常见,而有些门类的代表性物种则极为稀少,甚至有的门只有一个从人体中分离出来的物种。例如,黏性阿克曼菌,是疣状梭菌门唯一已知的代表。此外,肠道菌群的组成在不同个体间存在高度可变性,且这种差异可能会受到多种因素影响,包括饮食、生活习惯、遗传背景及环境因素等[22-24]。
1.2肠道菌群的应用
1.2.1粪菌移植
部分炎症、免疫疾病、糖尿病、肥胖症及某些癌症的发病机制与肠道微生物群的功能和组成变化有关。随着病患体内微生物多样性减少,将健康供体的粪便微生物群移植(FMT)给患者,是恢复微生物平衡的有效治疗策略之一。
肠道菌群移植在艰难梭菌感染[25-27]、肥胖症[28]和炎症性肠道疾病[29]的治疗中被证明具有较大治疗潜力。近年来,FMT成为生物医学和临床医学的研究热点。多项研究揭示了FMT在治疗炎症性肠病[30]、肠易激综合征[31]、便秘[32]、代谢综合征[33]等疾病中的潜在治疗价值。
尽管FMT在抗生素相关性腹泻治疗中具有较高的治疗效率(>90%),但安全性、高成本、卫生安全和及时获得性等问题仍限制了其实际应用。《上海市菌群移植技术管理规范(2021年版)》对菌群移植供体的生理状态和菌液质量提出了详尽且严格的规定。首先,其明确规定了供体的生理状态,包括血常规、肝肾功能等指标须正常,以及粪便常规检查正常且隐血实验为阴性。同时,对可能对人体健康造成威胁的病菌也要求检测结果必须为阴性。其次,对菌液质量提出了严格的质控规定,并要求其与供体同批次样本的菌群组成应一致。这些规定确保了菌群移植过程中使用菌液的稳定性和一致性,提高了菌群移植的有效性和可靠性。对供体生理状态和菌液质量的严格规定,为菌群移植技术的临床应用提供了有力保障[34]。
尽管FMT推荐使用新鲜粪菌液,但在实际应用中,受到外界因素限制,新鲜样本的获取较为困难。因此,如何实现粪菌的有效储存,成为FMT技术发展中亟待解决的问题[35]。同时,粪菌保存效果也是影响FMT治疗效果的因素之一,研究肠道菌群保存对FMT治疗具有深远影响。
1.2.2科学研究
保存的粪菌不仅可用于临床治疗,还在人类生命健康研究中发挥着重要作用。虽然目前FMT已成为治疗复发性艰难梭菌感染的有效方法,但FMT的长期效果尚不清楚。为减少FMT带来的风险问题,现有研究从供体粪便中分离出33株细菌[36],并从17株产丁酸梭菌属细菌的混合物中分离出移植物,发现其可作为FMT的粪便替代品[37]。肠道菌群特定培养基定向富集益生菌也是肠道菌群保存的一个重大应用方向。保存的粪菌不仅在临床治疗上具有突出的实际应用价值,还为科研工作者提供了宝贵的研究资源。宏基因组利用粪便样本,对人类健康与肠道微生物群间的复杂关系展开了深入探索[38];流行病学研究对大规模人群的粪便样本进行了微生物群落分析,并探讨了肠道微生物与各种疾病间的关联[39];针对保存粪菌的代谢组学分析,揭示了肠道微生物与宿主代谢间的相互作用,为理解人体代谢过程及代谢相关疾病的发病机制提供了新的视角[40]。
2肠道菌群的活菌保存方法
肠道菌群活性保存是运用特定保护剂,在较低温度下或冷冻干燥后长期保存,使肠道菌群细胞活性、群落组成及功能发生较少变化的一种保存方式。为满足粪菌移植的临床应用需求,保持菌种活性至关重要,尤其需要长期保持菌种不发生改变。
以较高活性保存肠道菌群是重要的研究方向。目前,在-80。C下添加甘油作为冷冻保护添加剂实施冷冻保存,是保存粪便样本中微生物群的“黄金标准”[41]。对于细菌微生物的低温保存,常用甘油和二甲基亚砜(DMSO)作为渗透性冷冻保护剂(CPA)。以5%~15%(W/W)的浓度添加这种物质,有利于减少负面冻结效果(negative freezing effect)[42]。非渗透性冷冻保护剂,如不同的糖(海藻糖[43]、蔗糖[44]、菊粉[45])、明胶、黏蛋白、果聚糖和聚乙二醇(PEG)[44]等,被用于纯培养,以减少冰的形成,稳定膜脂,并在复苏阶段提供营养支持[46]。此外,一些抗氧化剂,如半胱氨酸和核黄素等,可用来促进严格厌氧菌的生长繁殖[47-48]。
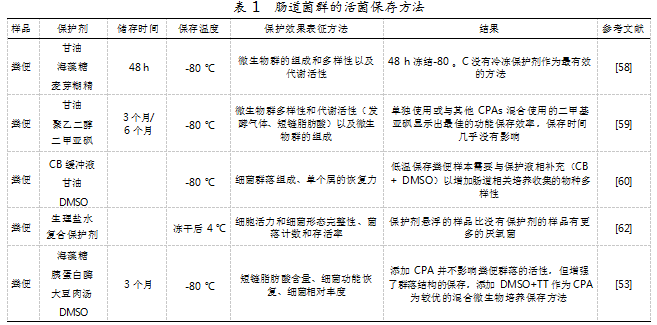
通过对多样性、群落组成、气体组成及短链脂肪酸代谢等指标的评价,现有研究分析了粪便在-80℃下的冷冻保存效果,并发现48 h时,没有冷冻保护剂的情况下效果最佳[49]。GACI等[50]评估了使用细胞内和细胞外冷冻保护剂单独保存与不同组合保存后微生物的生存能力和复苏情况。其在3个月和6个月后测定保存效果,并将其与新鲜初始微生物群多样性和代谢活性进行比较,发现二甲基亚砜(DMSO)单独或与其他保护剂混合使用时,功能保存效率最高。BICLOT等[51]提取了11个健康人类志愿者的粪便样本,并分析了其在-80℃不添加任何介质冻干或不同Cary-Blair介质条件下的保存情况,通过对粪便进行16S rRNA基因测序,并将其在改良后的厌氧培养基上进行稀释涂布,发现含DMSO的Cary-Blair保护液可增加肠道相关培养物物种的多样性。
除低温保存外,添加保护剂冻干保存也是细菌活性保存的一种重要方法。BELLALI等[52]评估了一种含有蔗糖(10%)、海藻糖(10%)、脱脂牛奶(10%)和抗氧化剂的新型保护剂在不同储存条件下对肠道细菌活力的影响。同时,通过使用涂布、流式细胞术和扫描电镜,研究了上述保护剂存在和不存在时粪便样本中的细胞活力和细菌形态,并发现保护剂悬浮的样品比没有保护剂的样品产生了更多的厌氧菌。肠道菌群的活菌保存方法具体如表1所示。
3肠道菌群保存效果的影响因素
3.1保存时间
保存时间的延长可能会影响粪便样本中遗传信息的保存情况及其内部细菌菌群的构成。现有研究推荐在肠道微生物学研究领域,对于收集到的粪便样本迅速执行核酸抽取或将其置于-20℃环境下保存,以确保样本的质量标准[53]。同时,另有研究对保护剂ABCDE(A:Hcode;B:SGENE;C:MEDISHARK(GL18V1-2);D:PSP®Spin Stool DNA Kit;E:OM-NIgene·GUT)在不同储存时长下对细菌多样性和菌群结构的保护作用进行了评估,并发现在维护肠道菌群稳定性方面,保护剂C表现相对优异[54]。
3.2保存温度
反复的冻结解冻过程是导致粪便样本中DNA分解的主要原因,可能会使宏基因组DNA的质量变差[55]。数据显示,储存温度应低于-80℃,以避免在更高温度下水重结晶及其他过程的继续发生[56]。解冻过程通常在37℃的水浴中进行。同时,通过分析氧气暴露、冻融循环和移植滞后时间对细菌群落组成的影响,发现氧暴露降解了粪便细菌群落,且-80℃在肠道菌群活性保存手段中是较为常见的保存温度[57]。通过对比DETs、GITC和RNAlater这3种防腐剂在-80℃下对不同时间内菌群结构和数量变化的影响,得知在能提供持续低温冷藏的状况下,将粪便样本存放在-80℃环境中是首选[58]。
3.3保护剂
保护剂在肠道菌群保存中发挥着重要作用,主要功能在于防止菌群受到不利条件干扰,从而保持其活性和稳定性。KERCKHOF等[43]研究了不同保护剂在-80℃下保存3个月后SCFAs含量、细菌功能恢复、细菌相对丰度的变化,并发现添加CPA不会影响粪便群落的活性且促进了群落结构的保存。其中,添加DMSO+TT作为CPA是一种较好的混合微生物培养保存方法。
4肠道菌群保存评价方法
4.1群落结构评价法
探讨肠道菌群保存前后微生物群落功能和组成的全面准确表征,对于设计有效的保存方案至关重要。目前,基于16S rRNA扩增子测序的分子方法,是鉴定肠道菌群最常用且有效的工具。16S rRNA扩增子基因测序可在多种平台上进行,如Illumina[43]、MiSeq[59-60]、HiSeq和PacBio等。此外,一些工作还会用到Roche 454焦磷酸测序[61-62]。
定量PCR也可用于功能性细菌鉴定,并能与16S rRNA分析相结合,用于检测目标引物靶向菌株或群体分化基因[51,63],抑或是某个特定功能的存在[45]。但该方法存在一定局限,主要体现为无法在物种和品系水平上区分细胞,也无法区分活细胞和死细胞。对此,基于荧光显微镜[64]或流式细胞术[44]的膜完整性测试,可有效解决这一难题。
4.2功能评价法
保存的微生物群的功能表征主要基于在选择性培养基中培养后的代谢活性测量,检测手段包括HPLC-RI和气相色谱法。评估代谢活性的主要标志物是SCFAs(乙酸盐、丙酸盐和丁酸盐)、BCFA[59](异丁酸盐和异戊酸盐)及其总和[43]。这些微生物代谢物可调节肠道和代谢途径,维持能量稳态、促进葡萄糖/脂质代谢,以及缓解炎症甚至免疫和癌症等。因此,保存后肠道菌群的功能评价,对于后续FMT的应用至关重要。
5结语
本文对人类肠道菌群活菌及其标志物的保存进行了综述,阐述了肠道菌群结构和功能的相关概念,总结了肠道菌群的多方面应用,回顾了影响肠道菌群活性保存方式和效果的影响因素,研究了群落结构和功能评价方法,并列出了现有保存方法的不足,以及对未来新型保存方法的展望。目前,人类肠道菌群保存方法的局限性主要体现在以下几方面:第一,缺乏标准和统一的保存后评价方法;第二,急需新型保护剂和通用保护剂,以降低保护毒性并增强保存效果;第三,肠道菌群保存主要局限于标志物(DNA、RNA和蛋白质)的研究,缺乏对活菌保存的系统性探索。这些局限性的克服,将有助于设计人类肠道菌群长期保存方案,实现肠道菌群在医学和生物技术领域中的广泛应用。
[1]DEN B G,VAN E K,GROEN A K,et al.The role of short-chain fatty acids in the interplay between diet,gut microbiota,and host energy metabolism[J].Journal of Lipid Research,2013,54(9):2325-2340.
[2]B魧UMLER A J,SPERANDIO V.Interactions between the microbiota and pathogenic bacteria in the gut[J].Nature,










