功能性食品中肠炎动物模型循证应用的研究进展论文
2025-04-17 17:51:51 来源: 作者:xuling
摘要:文章综述了功能性食品在肠炎动物模型中的应用,并对未来研究进行了展望,以期为功能性食品缓解相关病症的机制研究及未来临床应用与推广提供可靠参考。
摘要:功能性食品现被广泛用于调节机体功能、预防疾病、促进健康,在缓解和治疗溃疡性结肠炎方面发挥着良好效果。然而,在功能性食品的补充过程中,相关成分的作用机制尚未明晰。动物模型作为研究功能性食品缓解肠炎作用机制的重要手段,有助于为功能性食品的补充与应用提供较为准确的指导。鉴于此,文章综述了功能性食品在肠炎动物模型中的应用,并对未来研究进行了展望,以期为功能性食品缓解相关病症的机制研究及未来临床应用与推广提供可靠参考。
关键词:功能性食品;溃疡性结肠炎;肠道炎症;动物模型;活性成分
作为日常饮食的一部分,功能性食品在消费者养生意识中发挥着重要作用。功能性食品指含有生物活性成分的食品或化合物,既可以是天然产物,又可以是通过技术干预获得的食品[1]。功能性食品通常不以治疗疾病为目的,只发挥调节机体功能的作用,不仅能帮助人体保持健康的生活方式,还有利于减少疾病的侵害。合理添加功能性食品,能使疾病的预防、调理及康复等变得更加简单、高效。调查研究发现,功能性食品能够促进肠道健康[2],而肠道正是连接人体与外部环境的纽带。可见,功能性食品在维持宿主健康方面具有重要作用。
人体肠道是一个复杂的生态系统,是人体消化和免疫系统的重要组成部分。不健康的肠道会对人体的新陈代谢、免疫力和精神状况产生严重影响。例如,肠道菌群失调会破坏肠道生物屏障,影响肠道内环境,进而破坏肠黏膜功能的稳定性。这种共生关系一旦被扰乱,就容易引发疾病,如炎症性肠炎(Inflammation bowel disease,IBD)等。IBD包括溃疡性结肠炎(Ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD),且目前研究以UC为主。UC是一种影响结肠和直肠的慢性炎症性肠病,患者的黏膜炎症始于直肠,可连续延伸至结肠近端段[3],但发病机理目前尚不明确。随着我国生活水平的不断提高,人们的饮食习惯、生活方式,以及生活环境发生了显著变化,而同时肠道免疫系统所受到的外部刺激也逐渐增多,导致UC发病率提高,威胁着人们的生活与健康。日常膳食是影响肠道健康的一个关键因素。随着人们对健康养生的重视,功能性食品作为一种食品新概念受到了广泛关注。功能性食品能够提供一定的营养素,为宿主带来有益于健康的成分[4]。很多功能性食品,如功能性低聚糖、多酚类物质、膳食纤维、益生菌和益生元等,都有缓解肠炎或治疗肠炎的潜力。其中,多酚具有较强的抗炎活性[5];膳食纤维在调节肠道微生物群组成和宿主代谢的过程中发挥重要作用[6];益生菌和益生元可调节肠道微生物群,维持肠道免疫稳态[7]。因此,从天然产物中提取生物活性成分,成为治疗肠炎的重要手段之一[8]。
功能性食品与肠道菌群间存在着细枝末节的联系。通过功能性食品的饮食干预,可维持肠道与宿主的整体健康,改善已紊乱的肠道菌群结构,控制疾病的发生发展。然而,这一过程仍需要科学的证明和循证,如建立动物模型等。动物模型的构建为病理生理学研究作出了巨大贡献,有助于探究疾病的发病机制和寻找潜在的治疗药物,同时也是功能性食品开发研究的必要手段(见图1)。因此,本文综述了功能性食品在肠炎模型中应用的研究进展,并介绍了肠炎动物模型的建立方法及功能性食品缓解肠炎的实例,以期为功能性食品的开发与应用,以及UC的临床研究与发病机制探索提供参考。
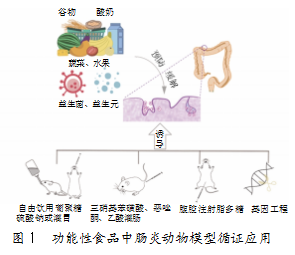
近年来,很多食品中的功能性组分均展现出了缓解肠炎或治疗肠炎的潜力。功能性食品及其活性组分包括益生元、酚类化合物,以及益生菌等。益生元给药能够调节肠道微生物稳态,下调炎症因子水平。常用的益生元有低聚糖类、多糖类,以及天然植物类。现有研究发现,功能性低聚糖具有安全、优良的生理活性,对于治疗IBD有着巨大的应用潜力[8]。研究表明,小鼠UC模型中的结肠炎症可通过摄入低聚木糖得到缓解,同时改善结肠上皮完整性,降低结肠炎症与氧化应激,减轻损伤[9]。作为益生元的一种,低聚半乳糖也能起到预防结肠炎的效果,助力修复葡聚糖硫酸钠诱导的肠道屏障损伤,改善肠道通透性与完整性[10]。酚类化合物广泛存在于自然界中,且多数酚类化合物具有抗氧化能力,对人体具有保健功效[11]。然而,该类化合物的生物利用度会因其结构的复杂多样性表现迥异。一部分酚类化合物会被小肠吸收,在肠道消化过程中进入结肠[12],最终抵达大肠并参与大肠内的相互作用[13];另一部分则会通过肠道菌群进行生物转化[14]。同样,益生菌也可调节肠道菌群,提升肠道抵抗力,修复肠黏膜、缓解炎症[15],助力治疗IBD。这些研究,为功能性食品及其活性成分在肠道损伤动物模型中的应用提供了理论依据,证实了该类成分的开发和应用可能是一种更安全、更具潜力的预防和缓解IBD的方法。
2肠炎动物模型评价指标
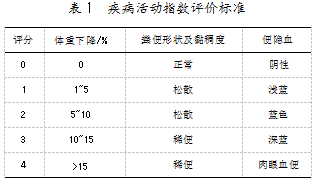
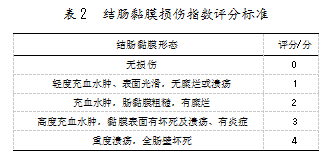
为探寻功能性食品对缓解肠炎的效果评价,需要建立合适的肠炎动物模型。然而,当前的造模方法成功率并不稳定,显著影响了实验效果,亟需通过一定的标准来评判造模效果。评价指标是衡量实验进程、效果的标准,能有效评价模型是否建立成功或者评估疾病病变的程度。由于肠道炎症会出现腹泻、体重减轻等症状,判断小鼠结肠炎造模成功的指标之一便是小鼠体重。研究表明,野生型小鼠在活动性结肠炎期间通常会失去10%~20%的体重[16]。此外,疾病活动指数(Disease activity index,DAI)、髓过氧化物酶(Myeloperoxidase,MPO)、结肠长度,以及结肠黏膜损伤指数(Colon mucosa damage index,CMDI)等,均可作为判断造模成功的评价指标。DAI评分主要从体重变化、腹泻、便隐血3方面评估打分,评分标准如表1所示。MPO是中性粒细胞的功能标志和激活标志;结肠长度是反应炎症与修复的指标;CMDI强调通过肉眼对结肠大体损伤程度进行打分,评分标准如表2所示。这些评分标准已在一些研究中被用作判断的重要依据。例如,陈佳音等[17]通过小鼠体重减轻、结肠缩短、DAI指数增加等症状,判定了结肠炎小鼠造模成功;牛叶雨等[18]建立的结肠炎小鼠模型,反映了实验小鼠体重减轻、粪便软散出血、DAI与CMDI指数明显升高。由此可见,这些评分标准的存在具有重要意义和现实价值。
3化学试剂诱导的肠炎动物模型在功能性食品中的应用研究
目前,UC动物模型造模方法众多,包括化学药物诱导、基因工程修饰等。受限于造模方法和价格,较为常用的仍是以化学药物诱导的UC动物模型。常用的化学诱导剂包括葡聚糖硫酸钠(Dextran sulphate sodium,DSS)、三硝基苯磺酸(TNBS)、恶唑酮(Oxazolone,OXZ)、乙酸等。化学诱导的模型模拟了人类UC的关键免疫学和病理学特征,如腹泻、黏性血便、体重减轻,以及肠上皮形态损伤、肠黏膜屏障功能障碍等,能够为功能性食品预防与缓解肠炎提供佐证。
3.1 DSS模型在功能性食品治疗肠炎中的研究
DSS诱导的结肠炎模型方法简单、效果显著,是目前应用广泛的造模方法之一。葡聚糖对内稳态的干扰可能会造成出血增加、结肠炎和肾衰竭,而DSS作为葡聚糖的聚阴离子衍生物,则可通过与结肠中链脂肪酸结合诱导炎症[19]。其操作方法是将DSS溶解于水中,给动物自由饮用数天。自1985年首次报道采用DSS构建仓鼠溃疡性结肠炎模型以来[20],已有大量研究证明了DSS结肠炎模型与人类溃疡性结肠炎相似。该模型症状主要表现为腹泻、黏液样便、粪便隐血、肉眼血便、重量减轻、活动度减少、毛色变差等。研究表明,小鼠种类、DSS浓度,以及给药周期等均会对造模效果产生影响。用3%的DSS溶液饮用7 d诱导雌性UC小鼠时,更易于模型的建立[21]。对于雌性C57小鼠,2.5%浓度的DSS是诱导IBD模型的较佳选择[22]。急性溃疡性结肠炎造模通常让小鼠自由饮用DSS溶液7 d,浓度一般为2%~5%[23];若要诱导慢性UC,则可采用1.5%的DSS作用于C57BL/6小鼠[24]。
膳食纤维对健康具有诸多益处,尤其是在肠道疾病的缓解方面。藜麦麸可溶性膳食纤维可显著缓解DSS诱导小鼠的结肠炎相关症状,是维持肠道稳态和预防结肠炎的功能性食品成分。相关研究发现[25],藜麦麸可溶性膳食纤维的添加,提高了小鼠DAI评分与组织病理学评分,降低了炎症因子水平,改善了肠道屏障功能。LIAO等[26]使用低聚果糖或合生元对DSS诱导的结肠炎小鼠进行了灌胃,并发现低聚果糖或合生元补充剂能够促进急性结肠炎小鼠肠道菌群的改变。此外,含益生菌乳酸乳杆菌NCDO 2118的Minas Frescal奶酪也能减轻小鼠模型中DSS诱导的结肠炎程度,限制组织病理学损伤,并通过增加与紧密连接蛋白相关的基因表达来恢复肠道屏障,调节小鼠细胞因子的产生。同时,益生菌Minas Frescal奶酪还能防止杯状细胞的变性,减少结肠黏膜中的炎症细胞浸润,为益生菌功能性食品的开发提供新的思路[27]。作为益生元的一种,海藻酸盐低聚糖能够调节肠道菌群,增加有益菌数量。研究指出,海藻酸盐低聚糖能够预防和缓解DSS诱导的结肠炎并改变肠道微生物群组成[28]。另有研究发现,蜂蜜多酚也可调节肠道菌群,对炎症性肠病具有一定的治疗作用[29]。蜂蜜多酚显著改善了SOD、GSH-Px、NO和MPO水平,减少了DSS诱导的结肠细胞凋亡,下调了相关炎症因子水平[30]。总之,以DSS诱导的小鼠结肠炎模型应用广泛,在评估功能性食品影响、预防,以及缓解肠炎方面发挥着重要作用。
3.2 TNBS模型在功能性食品治疗肠炎中的研究
三硝基苯磺酸(TNBS)诱导的结肠炎模型具有较高的稳定性。一般来说,在造模的第7天,相关炎症反应最为明显,能够体现出急性炎症慢性迁移的过程[31]。急性模型的优势在于其对短期屏障改变、先天免疫效应和耀斑的分析;慢性模型的优点在于其可更好地洞察适应性免疫和并发症,如肿瘤的形成和组织纤维化等[16]。TNBS不具有抗原性,但与宿主蛋白结合后会引起免疫反应,可与不同质量浓度的乙醇溶液结合使用。乙醇作为载体使用,可破坏上皮屏障,使肠黏膜对TNBS的通透性提升。TNBS诱导的结肠炎模型的特点是体重减轻、便出血、肠壁增厚、结肠病理病变,以及纤维化等,同时也会出现溃疡、炎症和白细胞浸润等组织学改变[32]。TNBS诱导的UC小鼠模型是研究T细胞介导的免疫反应发病机制和疾病潜在治疗方法的有力工具。
TNBS模型目前主要被用于针对益生菌及食品功能性组分有效性的应用研究中。低聚糖是一种益生元,可通过降低MPO活性和增加ALP活性来减轻肠道炎症大鼠的炎症反应[33]。为探究乳蔗糖在肠道中的抗炎与免疫调节功能,ZHOU等[34]建立了TNBS诱导的大鼠结肠炎模型,并通过食物补充乳蔗糖缓解了结肠炎症状。与DSS相比[33],动物炎症从第14天才逐渐缓解。同时,乳蔗糖通过促进Th2型细胞因子的产生和重新平衡Th1/Th2的比例,减轻了TNBS诱导的结肠炎,可作为一类功能性食品用于缓解炎症性肠病。多项研究表明,益生菌可缓解胃肠道疾病,重塑肠道稳态。PERAN等[35]比较了3种益生菌在大鼠TNBS结肠炎模型中的预防作用,并发现这3种益生菌均表现出一定的肠道抗炎活性。MATEUS等[36]从红葡萄酒中提取出了酚类化合物,同时通过直肠内给予TNBS诱导小鼠实验性结肠炎,用酚类化合物提取物腹腔内治疗小鼠,并发现结肠中的TNF-α水平显著降低,且没有明显的副作用。ORTIZ等[37]构建了TBNS诱导的Z急性动物模型,用以评估多酚冻干提取物对临床、组织学和炎症参数的影响。在该项研究中,口服多酚冻干提取物恢复了杯状细胞中隐窝结构和黏膜的保护作用,表明该类多酚冻干提取物可作为一种潜在的功能性食品,用于调节肠道内部稳态和炎症反应。
3.3恶唑酮模型在功能性食品治疗肠炎中的研究
与TNBS不同,恶唑酮是一种半抗原,也是一种重要的有机染料[38],长期接触有致癌风险,多被用于研究皮肤的迟发型超敏反应[39]。因此,与前两种模型相比,该模型在当前的功能性食品应用中的研究较少。恶唑酮与乙醇经直肠给药可引起急性结肠炎。鉴于该种疾病的特点是辅助性Th2型免疫反应,常用恶唑酮诱导的结肠炎来评估Th2在模型中的作用。其特征在于产生IL-13的自然杀伤T细胞(Natural killer T cells,NKT)[40],同时引起上皮细胞屏障变化并激活其他Th2免疫细胞[41]。在Th2型免疫反应中,来自病变组织的受刺激T细胞会使产生的白细胞介素IL-4和IL-5的量显著增加[42],并伴有体重减轻、腹泻、溃疡等症状,同时使大肠上皮细胞损失,以及杯状细胞减少、固有层浸润中性粒细胞、巨噬细胞和淋巴细胞减少。
常用的恶唑酮诱导结肠炎造模方法有2种:一种是一次性灌肠。该方法下小鼠炎症维持时间短、死亡率高;另一种是先涂抹3%恶唑酮溶液致敏,再用1%恶唑酮进行灌肠[43],应用较为普遍。一般来说,恶唑酮诱导的结肠炎模型的症状比TNBS诱导出现得稍早一些,在灌肠的第1天便会出现体重减轻、腹泻等症状,同时组织学评分达到峰值[44],并在后续几天逐渐下降。
植物乳杆菌YS4是一种优质乳酸菌。通过恶唑酮诱导小鼠结肠炎并进行灌胃治疗,观察结肠组织及血清样本,发现乳杆菌可恢复小鼠的炎症指标水平[45]。这为植物乳杆菌YS4的进一步研究及其在功能性食品中的应用提供了可能。魔芋葡甘露聚糖是一种可溶性膳食纤维,不同粒径粉碎的魔芋葡甘露聚糖不仅抑制了恶唑酮诱导的结肠炎症恶化,还限制了先天免疫和适应性免疫的介质[46]。恶唑酮诱导的结肠炎模型具有操作简便、可重复性强、实验周期短等特点,为UC的发病机制提供了一种研究手段,可推广用于该领域内的相关实验研究,为功能性食品在肠炎疾病中的应用提供保障。
3.4乙酸模型在功能性食品治疗肠炎中的研究
乙酸可诱导急性UC,与人类结肠炎的发病模式相似。乙酸模型机制是利用乙酸的化学刺激来刺激肠黏膜、破坏屏障,造成结肠黏膜损伤、炎症浸润与氧化应激。病变部位的细胞因子水平与人类UC患者变化相似,主要被用于研究UC发病机制,以及活性物质的药效筛选和评价。乙酸造模后的病理学变化,主要表现为出血性结肠炎、黏膜下层内严重水肿和杯状细胞增生[47],损伤严重,可见隐窝破坏、表面有坏死、空泡化、炎症细胞透壁浸润[48]。在动物模型中,常用的乙酸浓度为4%~10%。浓度较高,大鼠对化学试剂的抵抗力较强。因此,以往的研究多用大鼠造模。近年来,多项研究发现,乙酸诱导的UC模型也能运用于小鼠及其他动物。总之,乙酸诱导的结肠炎模型是一种简便有效、适应性强的造模方法,可诱导急性结肠炎的反应过程。然而,乙酸本身是一种刺激性较强的化合物,会通过直接刺激肠道而引发损伤。因此,其不能模拟人类UC复发性、慢性的特点,在实际研究中较为受限。
研究表明,仙人掌鲜汁在抑制乙酸诱导的大鼠UC中发挥着重要作用。推测其原因可能是仙人掌果汁中含有酚类、类黄酮和甜菜碱,具有显著的抗氧化和抗炎潜力[49]。鉴于胡椒碱是一种酚类物质,GRPTA等[50]探讨了胡椒碱对小鼠5%乙酸诱导的IBD体内模型的抗炎和抗氧化作用,并发现胡椒碱治疗可改善以溃疡面积、溃疡指数、脾脏肿大减少和结肠重长比抑制为特征的大体形态学病变,展现出了对IBD的治疗潜力。桑树果实提取物中含有类黄酮、酚酸和脂肪酸等生物活性成分,具有对IBD的抗炎活性[51]。在乙酸诱导的大鼠UC模型中,桑树果实提取物降低了UC大鼠的DAI指数,减轻了黏膜溃疡,保留了结肠完整性,有效缓解了水肿和坏死变化,以及炎症细胞浸润的情况[52]。总之,这些酚类化合物有助于炎症相关疾病的治疗,在与肠细胞和免疫细胞表面的受体结合后,能够抑制促炎信号,改善肠道微生物群失调。
3.5 LPS模型在功能性食品治疗肠炎中的研究
脂多糖(Lipopolysaccharide,LPS)是革兰氏阴性细菌细胞壁的特征成分,主要通过刺激宿主细胞产生促炎性细胞因子诱导急性炎症,被认为是造成急性器官损伤的重要原因[53]。LPS可用于诱导小鼠B细胞活化增殖或其他免疫细胞活化表达细胞因子,常被用作构建炎症动物模型,如肺炎、肝炎、肠炎等[54-56]。鉴于LPS能直接作用于肠黏膜,其也可诱导小鼠急性结肠炎,但造模用量需要谨慎。研究表明,5~20 mg/kg的LPS注射能导致小鼠腹泻[57]。临床试验中,常用10 mg/kg的量进行腹腔注射,注射后小鼠会出现精神萎靡、食欲不振、腹泻等症状,且粪便粘连在皮毛及肛门附近,同时垫料中也可明显观察到软粪便,出现明显聚堆瑟缩等行为。WILCZAK[58]等利用该模型进行β-葡聚糖的功能性研究,并发现膳食补充β-葡聚糖后部分逆转了肠炎导致的IL-10、IL-12、TNF-α水平,促进了结肠组织中上皮内淋巴细胞和固有层淋巴细胞数量的变化,有效改善了结肠炎症状。这种情况与益生菌的增多相关,证实了β-葡聚糖的益生元特性。此外,从大麦叶中提取的多糖成分在缓解LPS诱导的小鼠结肠炎症研究中[59],可通过抑制NF-KB和AP-1通路来发挥抗炎活性和调节免疫等作用,显著改善了结肠损伤的严重程度,减轻了肠道损伤。CHORWALA等[60]报道了乳酸菌属的细胞壁内容物显著减轻炎症和氧化应激,从而改善了LPS诱导的小鼠结肠炎模型的长期功能结果。这些研究成功利用了LPS诱导的肠炎模型,表明益生元能够部分促进益生菌的繁殖,修复被破坏的肠道稳态,营造酸性环境,抑制有害菌的生长。
4基因工程小鼠
用化学试剂诱导的动物模型可模拟肠道炎症症状,并定位造成炎症的可能原因,但却无法精准分析发病机制,不利于功能性食品或活性组分的精准补充。为此,基因工程小鼠可帮助解决功能性活性组分机制解释不清的问题。近年来,在基因工程的高速发展下,多种转基因和基因敲除(Knockout,KO)的小鼠品系被研发出来,加速了动物模型的研究进程,丰富了模型的种类。基因工程是利用DNA重组技术的工程操作。基因工程小鼠,又被称为遗传修饰小鼠、基因编辑小鼠,关注利用基因工程技术有目的地对实验小鼠进行基因修饰或敲除。转基因技术发展迅速,已成为当代生命科学热门的研究之一。转基因技术可培育动物新品种,目前已被广泛应用于生物学、医学、农业、食品等领域。常见的基因工程小鼠有IL-10、IL-2、NOD2基因敲除小鼠,以及Winnie转基因小鼠等。
4.1 IL-10基因敲除模型
IL-10也被称为细胞因子合成抑制因子,是一种参与炎症和免疫抑制的细胞因子,可抑制由巨噬细胞释放的炎症因子,同时调节T、B淋巴细胞。大量研究指出,IL-10是调节肠道炎症的重要细胞因子。IL-10表达量降低,则代表炎症反应受到了抑制。IL-10敲除是一种常见的肠道炎症动物模型,主要表现为Th1和Th17极化炎症[61]。该过程类似于CD的自发肠道炎症,被广泛应用于免疫介导的肠道炎症发病机制研究。IL-10能够阻断多种炎性细胞因子的诱导合成,包括TNF-α、IL-1、IL-6和IL-8[62]。此外,IL-10还可通过抑制Th2应答的分化,促进Th1细胞反应[63]。在IL-10缺陷小鼠中,经常会出现动物生长迟缓与贫血等现象,并伴有结肠炎、上皮细胞脱落、黏膜下层暴露和中性粒细胞大量积累,表明IL-10是肠道中必不可少的免疫调节剂[64]。
4.2 IL-2基因敲除模型
IL-2主要由活化的CD4+T细胞产生,是一种重要的免疫调节细胞因子。作为T细胞成长因子,IL-2具有促进稳态和调节性T细胞(Treg)的功能[65]。其可能在UC的发病中起到抑炎作用,通过减少因子表达量,使T细胞的免疫功能减弱,引起肠黏膜溃疡。IL-2 KO小鼠在5周内发育正常,5周后则会出现体重减轻、腹泻、间歇性消化道出血等症状,并在结肠黏膜处出现大量炎症浸润。IL-2能够双重调控CD4+Th1和CD4+Treg功能,维持体内免疫稳态。IL-2基因敲除后,CD4+Treg功能会受到抑制,而CD4+Th1功能则会变得活跃。可见,IL-2基因敲除具有自身免疫表现。与IL-10 KO小鼠相比,IL-2 KO小鼠死亡率更高。研究显示,约有50%的小鼠在早期会因脾肿大、淋巴腺病和严重贫血而死亡[66]。同时,IL-2 KO小鼠也会表现出贫血、淋巴细胞增生、骨髓造血细胞紊乱等自身免疫性疾病,而这并未在IL-10 KO小鼠身上体现[67]。
4.3 NOD2基因敲除模型
NOD2是一种胞内受体,属于先天免疫蛋白的Nod样受体(NLR)家族,可识别来自革兰氏阳性和革兰氏阴性细菌的加工胞壁二肽(MDP)[68]。NOD2基因会产生NOD2蛋白质,并存在于肠道内的细胞中。在入侵性微生物存在的情况下,NOD2将触发炎症反应,阻止细菌进入肠壁。
目前,多项研究正在探索NOD2的其他功能作用和临床应用。ROCHEREAU等[69]发现,与没有NOD2突变的CD患者或健康个体相比,有NOD2突变的CD患者SIgA转运显著增加。NOD2通过下调参与逆行转运的两种受体——Dectin-1和Siglec-5的表达,影响了SIgA在人和小鼠M细胞中的转运。这一发现,明确了NOD2介导的肠黏膜对肠道微生物群反应的调节机制。该机制参与了CD肠道炎症和生态失调。NABHANI等[70]通过对野生型、NOD1敲除小鼠、NOD2敲除小鼠的比较分析,发现NOD2 KO小鼠表现出了与野生型和NOD1 KO小鼠不同的结肠细菌微生态失调。同时,通过胚胎移植获得的NOD KO和野生型小鼠的细菌组成与在NOD2 KO小鼠中观察到的相似,认为NOD2 KO相关的微生态失调具有主导作用。
NOD2缺陷会引发构成性弱的炎症反应,导致肠道细菌增多,并逐渐形成慢性肠道炎症[69]。未来有必要针对这一致病机制展开深入探索,借助NOD2 KO小鼠,为CD的治疗提供相关证据和理论支持。
4.4 Winnie基因敲除模型
Winnie小鼠是携带MUC2黏蛋白基因错义突变的小鼠模型,具有自发性和进行性的特点,且具备某些形态和微生物特征,已使用常规育种方法得到确定[71]。Winnie小鼠模型常被用于研究自发性慢性结肠炎。这是一种慢性、自发性、反复性的炎症性疾病,具有IBD疾病的特点。Winnie小鼠模型是研究肠道微生物群和代谢组在IBD病理生理学中作用机制的合适动物模型。
通常来说,自发性结肠炎在4周龄的Winnie小鼠中很明显,并在12周龄时发展到最严重程度[72]。Liso等比较了WT和Winnie小鼠的炎症状态,并发现16周龄Winnie小鼠中出现了粪便稠度的丧失,同时结肠长度/小鼠体重,以及结肠重量/小鼠体重指数也显著增长;Winnie小鼠的免疫响应(DAI)更高,存在中度结肠炎,并伴有上皮侵蚀和免疫细胞浸润,且16周龄Winnie的乳过氧化物酶(LP)免疫细胞浸润增加[71]。
通过基因敲除技术建立的动物模型,能够较好地模拟发病原因、机制,以及治疗方法,但同时也可能会出现由遗传缺陷引起的发育异常。此外,该技术还需要较高的技术水平,成本高昂,甚至会涉及伦理问题,具有突出的技术缺陷。目前,基因工程小鼠在临床医学中的应用较多,但在探究功能性食品对人体营养机制方面的应用还十分有限,需要在后续应用研究中重点考量。
5总结与展望
功能性食品不仅要满足常规食品提供的需求,更要适应维持身心健康及改善能量水平等功能性需求。近年来,功能性食品的兴起,与当下人们健康养生意识的提升存在直接联系。功能性食品及其组分在缓解或治疗溃疡性结肠炎方面展现出了较好的效果,但相关成分发挥作用的功能机制尚不明晰,限制了精准的膳食补充。动物模型是研究功能性食品或组分发挥效用机制的有力工具,能增强功能性食品的临床推广与认证的准确性与安全性。本文通过对功能性食品组分研究中采用的一些动物模型进行总结,对比了方法间的优劣,分析了应用广泛的主要功能性食品及其组分类别,为研究功能性食品及其组分缓解相关病症机制提供了新策略和新思路。然而,人类肠炎病因极为复杂,不能完全依靠动物模型模拟,未来还需进一步寻找成本低、造模方法简便、与人类肠炎相似度更高的动物模型,筛选出更多具有预防和缓解肠炎疾病的有效且具有特异性的功能性食品,从而推动对肠炎发病机制、病理进程和治疗手段等的深入探索,为功能性膳食组分的补充提供精准指导。
参考文献
[1]MONICA B,IOAN S.Functional food[J].International Journal of Nutrition,2019,3(3):7-16.
[2]WAN M L Y,LING K H,EL-NEZAMI H,et al.Influence of functional food components on gut health[J].Critical Reviews in Food Science and Nutrition,2019,59(12):1927-1936.
[3]UNGARO R,MEHANDRU S,ALLEN P B,et al.Ulcerative colitis[J].The Lancet,2017,389(10080):1756-1770.
[4]DAMI魣N M R,CORTES-PEREZ N G,QUINTANA E T,et al.Functional foods,nutraceuticals and probiotics:A focus on human health[J].Microorganisms,2022,10(5),1065.
[5]SANGIOVANNI E,DELL’AGLI M.Special issue:Anti-inflammatory activity of plant polyphenols[J].Biomedicines.2020,8(3):64.
[6]CRONIN P,JOYCE S A,O’TOOLE P W,et al.Dietary fibre modulates the gut microbiota[J].Nutrients.2021,13(5):1655.
[7]AZAD M A K,SARKER M,LI T,et al.Probiotic species in the modulation of gut microbiota:An overview[J].BioMed Research International,2018,2018:9478630.
[8]YANG X,ZENG D,LI C,et al.Therapeutic potential and mechanism of functional oligosaccharides in inflammatory bowel disease:A review[J].Food Science and Human Wellness,2023,12(6):2135-2150.
[9]SHENG K,HE S,SUN M,et al.Synbiotic supplementation containing Bifidobacterium infantis and xylooligosaccharides alleviates dextran sulfate sodium-induced ulcerative colitis[J].Food&Function,2020,11(5):3964-3974.
[10]LIU X,ZHANG Y,LI W,et al.Differential responses on gut microbiota and microbial metabolome of 2’-fucosyllactose and galactooligosaccharide against DSS-induced colitis[J].Food Research International,2022,162:112072.
[11]肖婧泓,辛嘉英,路雪纯,等.天然结合酚类化合物的研究进展[J].中国调味品,2022,47(8):210-215.
[12]MOSELE J I,MACI魥A,ROMERO M P,et al. Application of in vitro gastrointestinal digestion and colonic fermentation models to pomegranate products(juice,pulp and peel extract)to study the stability and catabolism ofphenolic compounds[J].Journal of Functional Foods,2015,14:529-540.
[13]MOSELE J I,MACI魥A,MOTILVA M J.Metabolic and microbial modulation of the large intestine ecosystem by non-absorbed diet phenolic compounds:A review[J].Molecules,2015,20(9):17429-17468.
[14]MONAGAS M,URPI-SARDA M,S魣NCHEZ-PAT魣N F,et al.Insights into the metabolism and microbial biotransformation of dietary flavan-3-ols and the bioactivity of their metabolites[J].Food&Function,2010,1(3):233-253.
[15]JAVED H N,ALSAHLY B M,KHUBCHANDANI J. Oral Feeding of probiotic bifidobacterium infantis:Colonic morphological changes in rat model of TNBS-induced colitis[J].Scientifica,2016:9572596.
[16]WIRTZ S,POPP V,KINDERMANN M,et al.Chemically induced mouse models of acute and chronic intestinal inflammation[J].Nature Protocols,2017,12(7):1295-1309.
[17]陈佳音,上官发炜,王萍,等.虾青素对DSS诱导的小鼠溃疡性结肠炎的影响[J].药物生物技术,2023,30(2):124-129.
[18]牛叶雨,沈琪,白勇,等.基于溃疡性结肠炎模型探讨锦灯笼提取物的抗炎及抗氧化作用[J].中国畜牧兽医,2023(6):2531-2539.
[19]SCHREINER P,MARTINHO-G,STUDERUS D,et al.Nutrition in inflammatory bowel disease[J].Digestion,2020,101(1):120-135.
[20]OKAYASU I,HATAKEYAMA S,YAMADA M,et al.Anovel method in the induction of reliable experimental acute and chronic ulcerative colitis in mice[J].Gastroenterology,1990,98(3):694-702.
[21]张琳珮,陆洪艳,史雯雪,等.葡聚糖硫酸钠诱导不同性别溃疡性结肠炎小鼠模型的比较[J].药品评价,2022,19(3):141-144.
[22]董若曦,蒋笑影,陆金根,等.不同浓度葡聚糖硫酸钠诱导小鼠炎症性肠病模型的实验研究[J].老年医学与保健,2022,28(2):366-9,74.
[23]茶亚飞,郭雪艳,李宝晶,等.葡聚糖硫酸钠自由饮用与灌胃诱导小鼠溃疡性结肠炎模型的比较[J].中国药理学通报,2021,37(5):735-740.
[24]ZHOU Y,JI G,YANG X,et al.Behavioral abnormalities in C57BL/6 mice with chronic ulcerative colitis induced by DSS[J].BMC Gastroenterology,2023,23(1):84.
[25]LIU J,WANG Z,MAI P,et al.Quinoa bran soluble dietary fiber ameliorates dextran sodium sulfate induced ulcerative colitis in BALB/c mice by maintaining intestinal barrier function and modulating gut microbiota[J].International Journal of Biological Macromolecules,2022,216:75-85.
[26]LIAO M,ZHANG Y,QIU Y,et al.Fructooligosaccharide supplementation alleviated the pathological immune response and prevented the impairment of intestinal barrier in DSS-induced acute colitis mice[J].Food&Function,2021,12(20):9844-9854.
[27]CORDEIRO B F,ALVES J L,BELO G A,et al.Therapeutic effects of probiotic minas frescal cheese on the attenuation of ulcerative colitis in a murine model[J].Frontiers in Microbiology,2021,12.
[28]WU A,GAO Y,KAN R,et al.Alginate oligosaccharides prevent dextran-sulfate-sodium-induced ulcerative colitis via enhancing intestinal barrier function and modulating gut microbiota[J].Foods,2023,12(1):220.
[29]ALVAREZ-SUAREZ JM,GIAMPIERIF FAU-BATTINO M,BATTINO M.Honey as a source of dietary antioxidants:Structures,bioavailability and evidence of protective effects against human chronic diseases[J].Current Medicinal Chemistry,2013,20(5):621-638.
[30]ZHAO H,CHENG N,ZHOU W,et al.Honey polyphenols ameliorate DSS-Induced ulcerative colitis via modulating gut microbiota in rats[J].Molecular Nutrition&Food Research,2019,63(23):1900638.
[31]周亚妮,宋云.2,4,6-三硝基苯磺酸诱导灌肠法建立炎症性肠病模型的实验研究[J].现代中西医结合杂志,2020,29(22):2420-2423,2436.
[32]ZHANG Z,ZHENG M,BINDAS J,et al.Critical role of IL-17 receptor signaling in acute TNBS-induced colitis[J].Inflammatory Bowel Diseases,2006,12(5):382-388.
[33]WAKUDA T,AZUMA K,SAIMOTO H,et al.Protective effects of galacturonic acid-rich vinegar brewed from Japanese pear in a dextran sodium sulfate-induced acute colitis model[J].Journal of Functional Foods,2013,5(1):516-523.
[34]ZHOU Y,RUAN Z,ZHOU X,et al.Lactosucrose attenuates intestinal inflammation by promoting Th2 cytokine production and enhancing CD86 expression in coliticrats[J].Bioscience,Biotechnology,and Biochemistry,2015,79(4):643-651.
[35]PERAN L,CAMUESCO D,COMALADA M,et al.A comparative study of the preventative effects exerted by three probiotics,bifidobacterium lactis,lactobacillus casei and lactobacillus acidophilus,in the TNBS model of rat colitis[J].Journal of Applied Microbiology,2007,103(4):836-844.
[36]MATEUS V,ESTARREJA J,SILVA I,et al.Effect of aqueous extract of phenolic compounds obtained from red wine in experimental model of colitis in mice[J].Current Issues in Molecular Biology,2022,44(6):2745-2758.
[37]ORTIZ T,ARG譈ELLES-ARIAS F,ILLANES M,et al.Polyphenolic maqui extract as a potential nutraceutical to treat TNBS-induced Crohn’s disease by the regulation of antioxidant and anti-inflammatory pathways[J].Nutrients,2020,12(6):1752.
[38]WANG X,OUYANG Q,LUO W J.Oxazolone-induced murine model of ulcerative colitis[J].Chinese Journal of Digestive Diseases,2004,5(4):165-168.
[39]MIZOGUCHI A.Animal models of inflammatory bowel disease[M]//CONN P M.Progress in Molecular Biology and Translational Science.Academic Press,2012.
[40]SCHIECHL G,BAUER B,FUSS I,et al.Tumor development in murine ulcerative colitis depends on MyD88 signaling of colonic F4/80+CD11b high Gr1low macrophages[J].The Journal of Clinical Investigation,2011,121(5):1692-1708.
[41]FUSS I J,STROBER W.The role of IL-13 and NK T cells in experimental and human ulcerative colitis[J].Mucosal Immunology,2008,1:S31-S33.
[42]BOIRIVANT M,FUSS I J,CHU A,et al.Oxazolone colitis:A murine model of helper cell type 2 colitis treatable with antibodies to interleukin 4[J].Journal of Experimental Medicine,1998,188(10):1929-1939.
[43]HELLER F,FUSS I J,NIEUWENHUIS E E,et al.Oxazolone colitis,a Th2 colitis model resembling ulcerative colitis,is mediated by IL-13-producing NK-T cells[J].Immunity,2002,17(5):629-638.
[44]ITANI S,WATANABE T,NADATANI Y,et al.NLRP3 inflammasome has a protective effect against oxazolone-induced colitis:A possible role in ulcerative colitis[J].Scientific Reports,2016,6(1):39075.
[45]YI R K,TAN F,SUO H Y,et al.Prophylactic effect of lactobacillus plantarum YS4 on oxazolone-induced colitis in BALB/c mice[J].Evidence-Based Complementary and Alternative Medicine,2020:9048971.
[46]ONITAKE T,UENO Y,TANAKA S,et al.Pulverized konjac glucomannan ameliorates oxazolone-induced colitis in mice[J].European Journal of Nutrition,2015,54(6):959-969.
[47]SERRYA M S,EL-SHEAKH A R,MAKLED M N.Evaluation of the therapeutic effects of mycophenolate mofetil targeting Nrf-2 and NLRP3 inflammasome in acetic acid induced ulcerative colitis in rats[J].Life Sciences,2021,271:119154.
[48]FARID A,SHEIBANI M,SHOJAII A,et al.Evaluation of anti-inflammatory effects of leaf and seed extracts of Plantago major on acetic acid-induced ulcerative colitis in rats[J].Journal of Ethnopharmacology,2022,298:115595.
[49]BABITHA S,BINDU K,NAGEENA T,et al.Fresh fruit juice of opuntia dillenii Haw.Attenuates acetic acid induced ulcerative colitis in rats[J].Journal of Dietary Supplements,2019,16(4):431-442.
[50]GUPTA R A,MOTIWALA M N,DUMORE N G,et al.Effect of piperine on inhibition of FFA induced TLR4 mediated inflammation and amelioration of acetic acid induced ulcerative colitis in mice[J].Journal of Ethnopharmacology,2015,164:239-246.
[51]FARZAEI M H.Role of dietary polyphenols in the management of peptic ulcer[J].World Journal of Gastr-oenterology,2015,21(21):6499-6517.
[52]SALAMA R M,DARWISH S F,EL SHAFFEI I,et al.Morus macroura Miq.Fruit extract protects against acetic acid-induced ulcerative colitis in rats:Novel mechanistic insights on its impact on miRNA-223 and on the TNFα/NFKB/NLRP3 inflammatory axis[J].Food and Chemical Toxicology,2022,165:113146.
[53]EVANS C E,PENG Y,ZHU M M,et al.Rabeprazole promotes vascular repair and resolution of sepsis-induced inflammatory lung injury through HIF-1α[J].Cells,2022,11(9):1425.
[54]SHARMA A,ACHI S C,IBEAWUCHI S R,et al.The crosstalk between microbial sensors ELMO1 and NOD2 shape intestinal immune responses[J].Virulence,2023,14(1):2171690.
[55]陈方.槲皮素对LPS诱导小鼠肝损伤的保护作用[D].雅安:四川农业大学,2020.
[56]陈永平,寇玉红,焦文静,等.辅酶Q10改善LPS诱导小鼠急性肺损伤的效应分析[J].畜牧兽医学报,2023,54(4):1730-1741.
[57]谭娅,甘麦邻,范源,等.金荞麦对脂多糖诱导小鼠小肠炎症的保护作用[J].中国畜牧兽医,2020,47(2):597-604.
[58]WILCZAK J,BLASZCZYK K,KAMOLA D,et al.The effect of low or high molecular weight oat beta-glucans on the inflammatory and oxidative stress status in the colon of rats with LPS-induced enteritis[J].Food&Function,2015,6(2):590-603.
[59]HAN H S,KIM S Y,SHIN J S,et al.Polysaccharide fraction isolated from the leaves of Hordeum vulgare L protects against colonic inflammation of systemic immune responses[J].Journal of Functional Foods,2021,87:104765.
[60]CHORAWALA M R,CHAUHAN S,PATEL R,et al. Cell wall contents of probiotics(lactobacillus species)protect against lipopolysaccharide(LPS)-induced murine colitis by limiting immuno-inflammation and oxidative stress[J].Probiotics and Antimicrobial Proteins,2021,13(4):1005-1017.
[61]WANG H,SHI P,ZUO L,et al.Dietary non-digestible polysaccharides ameliorate intestinal epithelial barrier dysfunction in IL-10 Knockout mice[J].Journal of Crohn's and Colitis,2016,10(9):1076-1086.
[62]KANG S J,KIM J M,KOH S J,et al.The guggulsterone derivative GG-52 inhibits NF-KB signaling in bone marrow-derived dendritic cells and attenuates colitis in IL-10 knockout mice[J].Life Sciences,2013,92(22):1064-1071.
[63]BETTELLI E,DAS M P,HOWARD E D,et al.IL-10 is critical in the regulation of autoimmune encephalomyelitis as demonstrated by studies of IL-10-and IL-4-deficient and transgenic mice[J].Journal of Immunology,1985,15(7):87-89.
[64]K譈HN R,L魻HLER J,RENNICK D,et al.Interleukin-10-deficient mice develop chronic enterocolitis[J].Cells,1993,75(2):263-274.
[65]JACQUES Y,MORTIER E.Le renouveau de l’interleukine 2[J].Medicine Science(Paris),2016,32(6-7):612-618.
[66]SADLACK B,MERZ H,SCHORLE H,et al.Ulcerative colitis-like disease in mice with a disrupted interleukin-2 gene[J].Cells,1993,75(2):253-261.
[67]李卓,蚁梓希,周报春,等.白细胞介素2基因敲除诱发小鼠炎症性肠病的特点及其机制初步分析[J].生理科学进展,2018,49(6):456-460.
[68]MUKHERJEE T,HOVINGH E S,FOERSTER E G,et al.NOD1 and NOD2 in inflammation,immunity and disease[J].Archives of Biochemistry and Biophysics,2019, 670:69-81.
[69]ROCHEREAU N,ROBLIN X,MICHAUD E,et al.NOD2 deficiency increases retrograde transport of secretory IgA complexes in Crohn's disease[J].Nature Communications,2021,12(1):261.
[70]NABHANI Z,LEPAGE P,MAUNY P,et al.Nod2 deficiency leads to a specific and transmissible mucosa-associated microbial dysbiosis which is independent of the mucosal barrier defect[J].Journal of Crohn's and Colitis,2016,10(12):1428-1436.
[71]LISO M,DE SANTIS S,VERNA G,et al.A specific mutation in muc2 determines early dysbiosis in colitis-prone winnie mice[J].Inflammatory Bowel Diseases,2019,26(4):546-556.
[72]MOVVA R,MURTAZA N,GIRI R,et al.Successful manipulation of the gut microbiome to treat spontaneous and induced murine models of colitis[J].Gastro Hep Advances,2022,1(3):359-374.










