非载药聚乳酸 - 羟基乙酸共聚物降解特性研究论文
2025-04-17 16:48:22 来源: 作者:xuling
摘要:文章考察了非载药PLGA与体内相近降解周期的体外释放条件,有助于缩短辅料筛选周期,为载药微球的体外释放研究提供科学依据。
摘要:文章以乳酸-羟基乙酸共聚物(PLGA)制备的非载药微球为模型,研究PLGA微球的缓释机理,以筛选出能反映体内降解行为的体外释放方法。同时,建立凝胶渗透色谱(GPC)方法,用于测定非载药PLGA微球的分子量并验证其效果,通过体外降解研究非载药微球在降解过程中的动态变化,结合差示扫描量热仪(DSC)和扫描电子显微镜(SEM)等辅助表征手段全面考察其降解特性。文章考察了非载药PLGA与体内相近降解周期的体外释放条件,有助于缩短辅料筛选周期,为载药微球的体外释放研究提供科学依据。
关键词:生物可降解材料;缓释微球;聚乳酸-羟基乙酸共聚物
微球技术通过将药物嵌入生物可降解材料中的微小颗粒,显著提升小分子、蛋白质及多肽药物的生物利用率与半衰期。乳酸-羟基乙酸共聚物(PLGA)作为核心载体材料,具有良好的生物相容性和可控降解性,在癌症、精神疾病等临床领域展现出了广阔的应用前景。然而,PLGA种类繁多,开发过程中需要精心筛选合适型号,并借助动物实验深入探究其体内降解特性[1-2]。
文章聚焦模拟市售多肽缓释微球常用的PLGA型号,采用复乳化-溶剂挥发法制备非载药微球,同时通过系统分析微球在不同温度与pH条件下的体外降解行为,并结合多种表征技术,致力于开发一种能精准反映体内降解过程的体外释放方法。
1材料
1.1仪器设备
高速剪切机(IKA®T18,德国IKA公司);冷冻干燥机(VirTis advantage ES-53,P Industries Inc);差示扫描量热仪(METTLER公司,瑞士);电子分析天平(赛多利斯科学仪器有限公司);S-3400扫描电镜型场发射扫描电子显微镜(Hitachi公司,日本)。
1.2试剂和耗材
聚乳酸-羟基乙酸共聚物(PDLG5002,分子量约20 kDa,Corbion);PVA(KURARAY POVAL 22-88,醇解度87.0%~89.0%,日本KURARAY公司);甘露醇(药用级,Merck);二氯甲烷(色谱纯,TEDIA);滤膜(Millex HV Nylon 0.45μm)。
2方法
2.1非载药PLGA微球制备方法[3]
称取1 g的PLGA(A∶GA=50∶50;Mw:20 kDa),溶于4 mL二氯甲烷中形成油相。向油相中加入1 mL蒸馏水,冰水浴条件下12 000 r/min高速剪切2 min,得到W/O初乳;将初乳注入40 mL 1%的PVA溶液中,8 000 r/min高速剪切3 min,得到W/O/W复乳;将复乳加入80 mL 3%的NaAc溶液中,常温搅拌2 h,水洗3次去除表面残留的乳化剂,离心(3 000 r/min,10 min)收集微球,加入适量甘露醇溶液(甘露醇占冻干后总重的10%~15%),冷冻干燥24 h,过孔径0.074~0.038 5 mm组合筛网,收集孔径0.074~0.0385 mm筛网中间截留的微球,即得非载药PLGA微球。
2.2分子量检测方法
2.2.1样品溶液配制
空白溶液:精准吸取0.5 mL二氯甲烷置于10 mL量瓶中,加四氢呋喃稀释至刻度,混匀,作为空白溶液。
标准溶液:分别取聚苯乙烯对照品A(含重均分子量约为100 000、20 000和1 000)、聚苯乙烯对照品B(含重均分子量约为700 000、50 000和3 000)、聚苯乙烯标准样品C(含重均分子量约为300 000和7 000)各分子量约10 mg,精密称定,分别置于10 mL量瓶中,加入0.5 mL二氯甲烷振摇溶解,再加四氢呋喃稀释至刻度,分别制成各分子量质量浓度为1 mg/mL的溶液,作为标准溶液A、B和C。
供试品溶液:取非载药微球约150 mg,精密称定,置于10 mL量瓶中,加入0.5 mL二氯甲烷充分振摇溶解,加四氢呋喃稀释至刻度,摇匀,用滤膜过滤,弃去初始续滤液5滴,取剩余续滤液作为供试品溶液。
专属性溶液:①甘露醇溶液:取甘露醇150 mg,精密称定,置于10 mL量瓶中,加入0.5 mL二氯甲烷充分振摇溶解,加四氢呋喃稀释至刻度,摇匀,用滤膜过滤,弃去初始续滤液5滴,取剩余续滤液作为甘露醇溶液。②聚乙烯醇(PVA)溶液:精准称取150 mgPVA聚乙烯醇置于10 mL量瓶中,加入0.5 mL二氯甲烷充分振摇溶解,加四氢呋喃稀释至刻度,摇匀,用滤膜(Millex HV Nylon 0.45μm)过滤,弃去初始续滤液5滴,取剩余续滤液作为PVA聚乙烯醇溶液。
2.2.2 GPC测试条件
依据中华人民共和国药典2020年版四部通则0512检测方法进行测定。
检测器:示差折光检测器;色谱柱:Waters Styrage HR4(7.8×300 mm)-Waters Styrage HR4(7.8×300 mm)-Waters Styrage HR3(7.8×300 mm)串联;流动相:四氢呋喃;检测器温度:35℃;柱温:35℃;进样量:100μL;流速:1.0 mL/min;运行时间:60 min;采样速率:5点/s;样品盘温度:10±5℃。
2.2.3 GPC测试方法验证
考察系统适用性、线性、专属性、重复性、中间精密度和耐用性,以验证当前GPC测试条件是否满足供试品测试需求。
2.2.3.1系统适用性
分别取空白溶液和标准样品溶液,按照“2.2.2”项下的方法进行测定,记录并绘制色谱图。空白溶液图谱无明显基线漂移,在主峰位置无明显干扰峰;标准样品溶液除空白溶液峰,各峰的分离度均大于2.0。
线性:取标准曲线样品,以x为横坐标,y为纵坐标,将x与y进行线性回归。
方法:空白溶液、标准样品溶液每个进样1针,记录并绘制色谱图。
标准:采用GPC专用软件绘制标准曲线,相关系数(R)不小于0.998。同时,标准样品溶液各峰必须在V0~Vt。
2.2.3.2专属性
方法:空白溶液、标准样品溶液每个进样1针;甘露醇溶液、PVA聚乙烯醇和供试品溶液每个进样1针,记录并绘制色谱图。
标准:标准溶液中聚合体分子量峰的检测没有受到其他峰的影响,且与供试品溶液在同一位置出峰。
2.2.3.3重复性
方法:同一天由同一分析员测定空白溶液、标准样品溶液每个进样1针;供试品溶液6份,每份1针,记录并绘制色谱图。
标准:6份供试品溶液的重均分子量(Mw)的相对标准偏差(SRSD)不大于10.0%,保留时间(RT)的相对标准偏差(SRSD)不大于1.0%。
2.2.3.4中间精密度
方法:在不同日期,由2名测试人员使用不同仪器及色谱柱重复按照“重复性”项下方法进行操作。
标准:在满足系统适用性和线性要求的基础上,要求12份精密度(包括重复性与中间精密度)供试品溶液Mw的SRSD不大于10.0%,RT的SRSD不大于1.0%。
2.2.3.5耐用性
方法:各变动色谱条件下空白溶液、标准样品溶液和供试品溶液各进样1针,记录并绘制色谱图。
标准:各色谱条件下,在满足系统适用性和线性要求的基础上,将各变动条件下测定的结果与正常条件下测定的结果进行比较,Mw的SRSD不得大于10.0%(除改变流速条件外);Mw回收率在90.0%~110.0%。
2.3体外降解条件考察方法
分别采用不同pH(4.5、7.4、10.0)和温度条件开展体外释放探索,观察非载药PLGA微球在不同释放条件(37、45℃)下0、1、3、7、14、21、35 d各时间点的分子量变化。
2.4 DSC检测方法
为防止甘露醇干扰检测,在测试DSC的样品冻干时未加入甘露醇。称取3~5 mg非载药微球置于铝制坩埚中,扎孔压片,升温范围控制在25~150℃,升温速率为10℃/min,在氮气环境下测定热量变化。
2.5扫描电镜检测方法
在体外释放过程中,分别取出体外释放条件下孵育0 d、1 d、3 d、7 d、14 d、21 d、28 d、56 d、84 d的样品,以2 000 r/min的速度低速离心,10 min后去除上清液,用蒸馏水洗涤3次后冻干,置于双面胶带上涂布均匀,喷金后,通过扫描电镜观察微球表面形态。
3实验结果
3.1 GPC测试方法学验证结果
系统适用性:空白溶液图谱无明显基线漂移,在主峰位置无明显干扰峰;标准样品溶液各峰分离度R均满足要求。
线性:标准曲线R值为0.999,满足要求。
专属性:非载药微球保留时间为26.826 min,Mw为15 602 Da;PVA聚乙烯醇未出峰,甘露醇未出峰,满足要求。具体如图1所示。
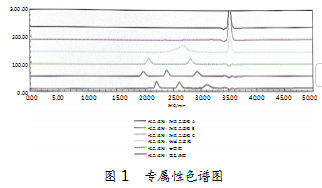
重复性:同一实验员制备的6个平行样品的保留时间SRSD为0.1%,Mw(Da)SRSD为0.5%,满足要求。
中间精密度:不同实验员使用不同仪器和不同色谱柱在不同时间分别制备6个平行样品。12个样品的保留时间SRSD为0.3%,Mw(Da)SRSD为1.6%,满足要求。
耐用性:考察该方法在不同流速(0.8、1.2 mL/min)、不同柱温(30、40℃)、不同检测器温度(30、40℃)条件下的耐用性。保留时间、Mw(Da),以及Mw回收率的SRSD分别为0.5%、0.5%、0.6%,满足要求。
GPC方法学验证结果表明,该方法的系统适用性、线性、专属性、中间精密度、重复性和耐用性均满足供试品溶液检测需求。
3.2非载药微球DSC检测结果
非载药微球的相转变温度(Tg)约为31.92~49.28℃,同时体温在非载药微球相转变温度区间内。因此,在体内非载药微球处于玻璃态,而在体外其释放温度普遍为37℃和45℃[4],非载药微球同样呈玻璃态。
3.3体外释放筛选结果
在35 d的体外释放过程中,观察到3组处于不同pH环境下的微球在37℃和45℃下的分子量降解存在差异。特别是在45℃、不同pH条件下的降解趋势相似,且均快于37℃、不同pH条件下的降解速度。进一步研究中,分别设定45℃,pH为7.4和10.0的条件开展为期3个月的体外释放考察。对比pH 7.4和pH 10.0介质中的非载药微球,发现两者在第28天的分子量降解均超过了90%。研究发现,碱性环境(pH 10.0)能显著加速微球降解,第3天降解了约40%,第7天便达到了82%。因此,选择45℃、pH 7.4作为优选的体外释放条件,并在此条件下观察各采样点非载药微球的扫描电镜形貌变化。具体结果如表2所示。
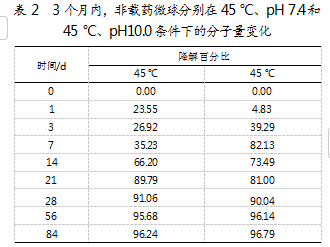
3.4体外释放过程中微球外观变化
利用扫描电镜观察非载药微球在45℃、pH 7.4条件下的形貌变化:开始时微球表面光滑,形态圆整;0~3 d外观无明显变化;第7天起表面出现孔道并逐渐扩大;第14天表面粗糙度显著提升,呈溶蚀状态;第21天时电镜下微球已不可见,转为碎片,聚合物形态发生显著改变。体外释放1个月后,样品仍为碎片且明显变薄变小;2个月后微球消失,仅见少量碎片。整体降解过程与分子量变化保持一致。具体如图3所示。
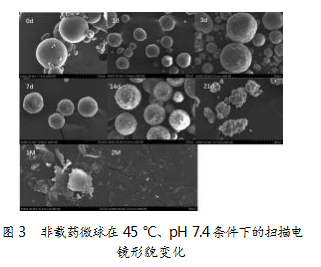
4讨论
文章通过分子量测试及DSC、扫描电镜等表征手段,研究了非载药聚乳酸-羟基乙酸共聚物微球的体外释放条件,旨在找到与体内相近的降解周期。
DSC结果显示,非载药微球在31.92~49.28℃温度范围内呈玻璃态。因此,选定该范围内的37℃和45℃作为研究条件。进一步研究发现,不同pH条件下微球分子量的下降程度各异,且微球在pH 7.4介质中的降解速率与本型号PLGA每月注射1次的给药频次相符。因此,最终选定45℃、pH 7.4作为体外释放条件。其分子量降解与文献报道[4]的降解周期基本一致。文章为药物开发提供了优先考察聚合物基质降解周期的体外条件,有助于筛选出符合给药周期的聚合物型号,缩短辅料筛选周期;同时也可用于载药微球的体外释放研究,指导药物开发过程中的处方筛选,减少体内药代研究次数。
参考文献
[1]张瑶.缓释微球制剂的研究进展[J].医药导报,2004,23(11):843-844.
[2]Freiberg S,Zhu X X.Polymer microspheres for controlled drug release[J].International Journal of Pharmaceutics,2004,282(1-2):1-18.
[3]QI P,BU R,ZHANG H,et al.Goserelin acetate loaded poloxamer hydrogel in PLGA microspheres:Core-shell di-depot intramuscular sustained release delivery system[J].Molecular Pharmaceutics,2019,16(8):3502-3513.
[4]RAJESH K,J M P.Points to consider when establishing drug product specifications for parenteral microspheres[J].The AAPS Journal,2010,12(1):27-32.










