小鼠肠道细菌E.caecimuris GAM9抑制单增李斯特菌感染的作用研究论文
2025-03-19 11:10:47 来源: 作者:xujingjing
摘要:从肠道菌群中筛选功能细菌应用于病原微生物防治,并将其作为替代抗生素治疗的一种新手段,该策略已得到了广泛研究。在此背景下,文章使用厌氧培养方法从健康小鼠粪便中筛选得到一株肠杆菌属细菌Enterorhabdus caecimuris GAM9。体外培养实验结果显示,GAM9能够在3 h内显著抑制单增李斯特菌(Lm)生长;动物实验结果显示,GAM9能够降低Lm感染小鼠的死亡率及其粪便的Lm载菌量,同时下调感染小鼠肝脏和脾脏中IL-1β、IL-6、IL-10、TNFα和IFN-酌的表达量。上述结果表明,分离株GA
摘要:从肠道菌群中筛选功能细菌应用于病原微生物防治,并将其作为替代抗生素治疗的一种新手段,该策略已得到了广泛研究。在此背景下,文章使用厌氧培养方法从健康小鼠粪便中筛选得到一株肠杆菌属细菌Enterorhabdus caecimuris GAM9。体外培养实验结果显示,GAM9能够在3 h内显著抑制单增李斯特菌(Lm)生长;动物实验结果显示,GAM9能够降低Lm感染小鼠的死亡率及其粪便的Lm载菌量,同时下调感染小鼠肝脏和脾脏中IL-1β、IL-6、IL-10、TNFα和IFN-酌的表达量。上述结果表明,分离株GAM9能够治疗单增李斯特菌感染,是一种潜在的功能益生菌。
关键词:肠道菌群;筛选;单增李斯特菌;治疗
食品安全是“健康中国”战略的重要组成部分。2023年2月,中共中央、国务院印发的《质量强国建设纲要》,提出要深入实施食品安全战略,推进食品安全放心工程。目前,我国食品安全形势稳中向好,但仍面临一定的困难和挑战。其中,微生物污染是影响中国食品安全的主要因素之一。单核细胞增生李斯特氏菌(Listeria monocytogenes,Lm),简称单增李斯特菌,广泛分布于各种环境中,是食品中常见的致病微生物之一。其主要感染群体包括免疫力低下的老年人、孕妇和新生儿,症状表现为败血症或脑膜炎;通过胎盘感染则表现为孕妇流产、死胎,致死率高达20%~30%[1-2]。2019年,对武汉259份超市零售猪肉的检测发现,Lm的检出率高达24.71%;2001—2022年,我国畜禽食品中Lm的合并检出率为7.2%,其中生肉检出率为10.7%[3-4]。数据表明,食品微生物污染问题已十分严峻,极易引发食源性疾病重大安全事故。为解决食品安全问题、保障公众健康,寻找预防和治疗Lm感染的新方法已迫在眉睫。Lm主要通过被污染的食品进入人类胃肠道,并会在人体肠道环境中生长繁殖,持续入侵宿主[5]。Lm通过黏附蛋白,能够操纵中枢核因子kB和肌球蛋白轻链激酶调节途径,打开并穿过肠上皮紧密连接屏障[6];Lm通过侵袭蛋白InlA,能够诱导膜蛋白重组,促进上皮屏障的胞吞作用[7]。因此,Lm进入并定植在胃肠道内,是造成宿主感染的第一步,也是至关重要的一个环节。不过,健康宿主摄入少量Lm,一般比较难感染李斯特菌病[8]。动物实验证明,小鼠或大鼠口服Lm的LD50可能高达5×109 CFU[9]。研究表明,肠道菌群可能在抵御Lm定植肠道的过程中发挥着重要的作用[10-11]。例如,肠道拟杆菌通过产生短链脂肪酸丙酸盐,可破坏细胞内的pH稳定性,从而限制鼠伤寒沙门氏菌生长[12];肠道芽孢杆菌通过抑制金黄色葡萄球菌群体感应,可消除金黄色葡萄菌[13]。在前期研究中,本课题组证明了粪菌移植技术能够利用健康小鼠的肠道菌群治疗Lm感染的小鼠,并利用16S rDNA测序技术发现了肠道梭菌属在治疗Lm感染方面的积极作用[14-16]。基于前期研究,假设健康小鼠肠道菌群中存在主要功能细菌,并在治疗Lm感染的过程中发挥着主要作用。文章将利用厌氧培养技术对健康小鼠粪便中的肠道菌群进行筛选、分离和培养,并通过体外实验和动物实验探讨分离株对单增李斯特菌的作用效果,以期为预防和治疗单增李斯特菌感染提供潜在新方法。
1材料与方法
1.1实验动物和试剂
实验动物:8周龄雄性SPF BALB/c小鼠,购自济南朋悦实验动物繁育有限公司,许可证号为SCXK(鲁)20220006,在实验室动物房适应性饲养1周后用于实验。试剂:Lm在37℃的脑心浸液培养基(brain heart infusion medium,BHI)(购自北京陆桥技术有限公司)中过夜生长;李斯特菌显色培养基(CHROMagar Listeria)购自上海欣中生物工程有限公司;引物均由生物工程(上海)股份有限公司合成。
1.2单菌落分离和筛选
将小鼠放置在无菌盒内自由排便,收集粪便加入无菌PBS(phosphate-bu-ered saline)进行匀浆处理,1 000 r/min离心5 min,收集上清液进行适当梯度稀释后涂布于BHI平板上,37℃厌氧箱内培养48 h。挑取不同形态的单菌落接种到BHI液体培养基中,经过重新划线纯培养,进行甘油菌冻存。使用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-ACGGCTACCTTGTTACGACTT-3’)扩增分离菌16S基因序列,将得到的DNA片段进行产物纯化,送至华大基因测序公司进行测序。测序结果使用DNAman软件进行拼接,并使用NCBI进行BLAST,最后使用Clustal 2软件和MEGA 7软件进行作图分析。
1.3体外抑菌实验
分离单菌在BHI液体培养基中厌氧培养48 h,并6 000 r/min离心5 min收集菌体,梯度稀释到菌质量浓度为107 CFU/mL;将Lm接种于BHI液体培养基中,37℃培养24 h后,6 000 r/min离心5 min收集菌体,梯度稀释到菌质量浓度为106 CFU/mL。取96孔细胞培养板,共同加入200 mL BHI液体培养基、10 mL分离单菌、10 mL Lm,37℃分别培养3 h和6 h后,对培养基内的Lm展开涂平板计数。
1.4动物实验
对30只小鼠分别灌胃接种1×1011 CFU/Lm,作为实验组,同时以PBS灌胃小鼠作为对照组。灌胃接种1 d后,使用分离菌进行灌胃治疗。治疗剂量确定为2×108 CFU/只,连续治疗7 d。每天记录小鼠死亡数量,并在治疗2、4、6 d时取所有存活小鼠的粪便进行稀释,并涂平板计数Lm,并分别取3只小鼠的肝脏和脾脏用于炎症因子表达。在感染9 d后,麻醉脱颈处死所有存活小鼠。
1.5 RT-PCR实验
使用试剂盒从肝脏和脾脏中分离出总RNA,利用逆转录RNA进行qPCR,并用AceQ qPCR SYBR Green Master Mix通过RT-PCR对所得cDNA进行定量。用于细胞因子扩增的引物序列具体如表1所示。将每个基因的mRNA表达水平标准化为GAPDH的表达水平,使用2-ΔΔCT方法计算并量化RT-PCR结果。其中,ΔCT是平均CT(靶基因)-CT(GAPDH基因);-ΔΔCT是平均[ΔCT(实验组)-ΔCT(对照组)]。
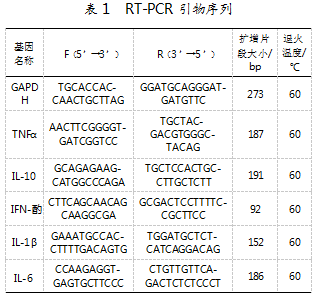
2结果与分析
2.1分离菌抑制Lm生长
分离菌GAM9与Lm共培养后的Lm活菌数量如图1所示。与Lm单独生长(E组)相比,GAM9在共培养3 h后,能显著降低培养基中的Lm数量(P<0.01);在共培养6 h后,两组差异进一步扩大。
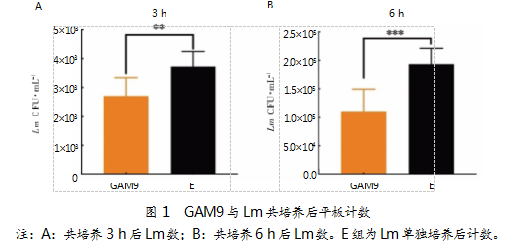
2.2分离菌降低感染小鼠体内Lm载菌量
小鼠在Lm灌胃感染1 d后,持续灌胃GAM9治疗7 d,并以PBS灌胃治疗为对照组。小鼠粪便中的Lm数量如图2所示。与PBS组相比,治疗2 d后,GAM9组小鼠粪便中的Lm数量没有显著降低(见图2A)。但通过比较分析发现,GAM9组中未检出(低于涂平板计数检出限)的小鼠数量低于PBS组(见图2B、C)。由此证明,GAM9灌胃处理能够减少感染小鼠体内Lm数量,抑制Lm在肠道内的定植,未检出率达到25%(见图2B)。治疗4 d后,GAM9组中Lm数量约为104~105 CFU/mL,低于PBS组两个数量级(106~108 CFU/mL)。同时,显著性分析发现,两组没有差异,可能是因为两组均存在未检出情况,导致两组的数据差异被缩小;GAM9组未检出率上升至41.7%。治疗6 d后,GAM9组仅有1只小鼠粪便中能够检出Lm数量,其他小鼠均无法检出。
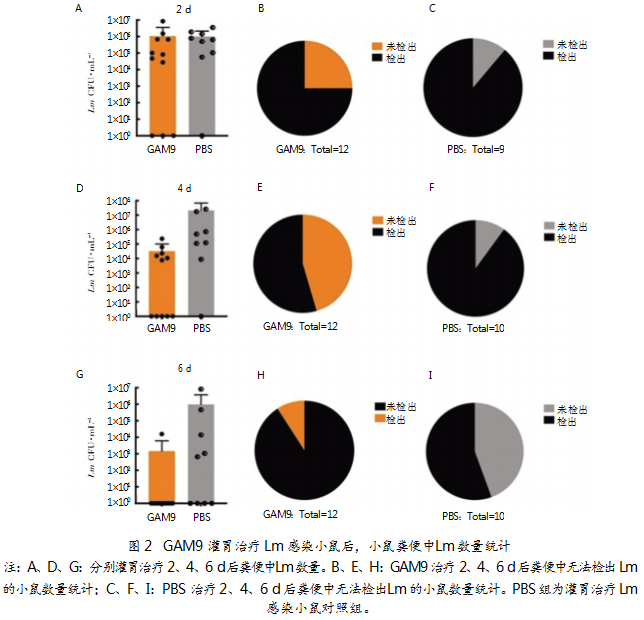
2.3分离菌降低感染小鼠死亡率
GAM9治疗小鼠的存活情况如图3所示。研究发现,PBS组小鼠在感染3 d时,生存率下降至80%;5 d时,下降至50%,之后剩余存活小鼠未出现死亡情况。GAM9组在感染3 d后,生存率下降至90%,最终降至80%,远远低于PBS组。结果表明,GAM9菌株能够降低Lm感染小鼠死亡率。
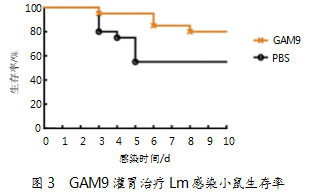
2.4分离菌下调感染小鼠炎症因子表达
GAM9治疗小鼠肝脏、脾脏炎症因子表达情况如图4所示。数据显示,与PBS组相比,GAM9治疗2 d后感染小鼠肝脏和脾脏中的IL-1β和TNFα显著下调,脾脏中的IL-10和IFN-酌也显著下调。治疗4 d后,GAM9使肝脏和脾脏中的IL-1β、IL-6、IL-10和TNFα显著下调。其中,IL-1β和IL-10的下调在6 d仍具有显著性。结果证明,GAM9能够通过减轻感染小鼠肝脏和脾脏中的炎症程度来起到保护小鼠的作用。

3结论
当前,肠道菌群已被证明可通过营养竞争、定植抗性和激发宿主的免疫反应来抵抗病原感染。然而,在临床实践中,肠道菌群在治疗病原菌感染方面的应用仍然较少。因此,利用肠道菌群取代抗生素治疗病原性细菌感染是一种相对较新的尝试。文章通过研究发现,GAM9分离菌能够降低感染小鼠的死亡率,下调小鼠肝脏和脾脏中的炎症因子表达,减少感染小鼠体内的Lm活菌数量。结果表明,从健康小鼠肠道菌群中筛选分离得到的功能菌株可通过降低过度炎症因子表达和抑制Lm肠道定植活性来治疗感染小鼠。该项发现为取代抗生素治疗Lm感染提供了新的思路和方法,也促进了肠道菌群在临床实践中的开发与应用。
[1]MAGALH魨ES R,MENA C,FERREIRA V,et al.Bacteria:Listeria monocytogenes[J].Encyclopedia of Food Safety,2014,14(3):450-461.
[2]CAMEJO A,CARVALHO F,REIS O,et al.The arsenal of virulence factors deployed by Listeria monocytogenes to promote its cell infection cycle[J].Virulence,2011,2(5):379-394.
[3]WANG Y Q,JI Q,LI S W,et al.Prevalence and genetic diversity of listeria monocytogenes isolated from retail pork in Wuhan,China[J].Front Microbiol,2021,12:620482.
[4]张皓琪,董鹏程,朱立贤,等.中国畜禽源单核细胞增生李斯特菌流行性的系统回顾及荟萃分析[J].中国食品卫生杂志,2023,35(7):1120-1128.
[5]LATORRE E,PRADILLA A,CHUECA B,et al.Listeria monocytogenes inhibits serotonin transporter in human intestinal Caco-2 cells[J].Microbial Ecology,2016,72(3):730-739.
[6]DROLIA R,BHUNIA A K.Crossing the intestinal barrier via listeria adhesion protein and internalin A[J].Trends Microbiol,2019,27(5):408-425.
[7]LECUIT M,VANDORMAEL-POURNIN S,LEFORT J,et al.A transgenic model for listeriosis:Role of internalin in crossing the intestinal barrier[J].Science,2001,292(5522):1722-1725.
[8]BRUSCHI C,KOMORA N,CASTRO S M,et al.High hydrostatic pressure effects on Listeria monocytogenes and L.innocua:Evidence for variability in inactivation behaviour and in resistance to pediocin bacHA-6111-2[J].Food Microbiol,2017,64:226-231.
[9]MANOHAR M,BAUMANN D O,BOS N A,et al.Gut colonization of mice with actA-negative mutant of Listeria monocytogenes can stimulate a humoral mucosal immune response[J].Infection and Immunity,2001,69(6):3542-3549.
[10]BECATTINI S,LITTMANN E R,CARTER R A,et al. Commensal microbes provide first line defense against Listeria monocytogenes infection[J].Journal of Experimental Medicine,2017,214(7):1973-1989.
[11]张文敏,耿方琳,方太松,等.应用乳酸菌生物保护剂控制肉制品中单增李斯特菌的研究进展[J].工业微生物,2019,49(4):39-45.
[12]JACOBSON A,LAM L,RAJENDRAM M,et al.A gut commensal-produced metabolite mediates colonization resistance to salmonella infection[J].Cell Host Microbe,2018,24(2):296-307.
[13]PIEWNGAM P,ZHENG Y,NGUYEN T H,et al. Pathogen elimination by probiotic Bacillus via signalling interference[J].Nature,2018,562(7728):532-533.
[14]LIANG G,XIANHONG Y,QING L.Fecal microbiota transplantation reduces mouse mortality from Listeria monocytogenes infection[J].Microbial Pathogenesis,2023,178:106036.
[15]LIANG G,QING L,XIANHONG Y.Clostridiales in the Gut Against Listeria monocytogenes Infection Through Growth Inhibition.[J].Foodborne Pathogens and Disease,2023,
[16]郭亮,张闻桐,闫帅帅,等.一株抑制单增李斯特菌感染的S.epidermidis G26菌株的分离筛选[J].工业微生物,2020,50(2):1-6.










