靶向 CD47 单克隆抗体结构表征与生物学特性分析论文
2025-02-26 15:21:10 来源: 作者:xuling
摘要:文章通过转染中国仓鼠卵巢(CHO)细胞系制备抗CD47单克隆抗体,并对其进行综合表征,实现了对其结构验证和作用原理的深入探究。具体采用超高效液相色谱-串联质谱(UPLC-MS/MS)对单抗分子质量、氨基酸覆盖率、二硫键连接方式进行结构表征,同时通过阻断试验研究其与CD47的相互作用。
摘要:文章通过转染中国仓鼠卵巢(CHO)细胞系制备抗CD47单克隆抗体,并对其进行综合表征,实现了对其结构验证和作用原理的深入探究。具体采用超高效液相色谱-串联质谱(UPLC-MS/MS)对单抗分子质量、氨基酸覆盖率、二硫键连接方式进行结构表征,同时通过阻断试验研究其与CD47的相互作用。结构确证显示,单抗分子质量与理论一致,氨基酸覆盖率达100%;二硫键配对方式与理论一致。阻断实验证明,anti-CD47可与CD47-his结合,并阻断CD47-his与信号调节蛋白α(SIRPα)的结合。该靶向单抗的分子结构与理论设计结构一致,可特异性结合CD47,阻断CD47-SIRPα信号轴,显示出了潜在的抗肿瘤效果。
关键词:CD47;结构表征;阻断作用;超高效液相色谱串联质谱
CD47是一种普遍存在于细胞表面的跨膜糖蛋白,是细胞增殖、迁移和免疫反应调节等多种生理过程的关键调节因子。CD47主要与信号调节蛋白α(SIRPα)相互作用,释放“别吃我”的信号[1-2],从而发挥抑制吞噬的作用,实现免疫逃逸。继PD-1/PD-L1后,CD47-SIRP琢阻断已成为各种恶性肿瘤中一个高度竞争的免疫检查点[3]。现有研究表明,CD47单抗不仅可以阻止CD47与SIRP琢的结合,还可以与巨噬细胞上的激活型Fc酌受体(Fc酌R)结合,向巨噬细胞传递强大的吞噬信号[4],进而促进巨噬细胞对肿瘤细胞的吞噬作用,有效连接先天和适应性免疫实现抗肿瘤效果[5]。
1仪器与材料
实验仪器:高分辨质谱仪Triple-TOF 6600(AB Sciex公司);超高效液相色谱ExionLC(AB Sciex公司);Octet(PALL);恒温振荡培养箱HZQ-F160(HDL APPARATUS);移液器(Eppendorf);CO2培养箱(Thermo);高速冷冻离心机(Eppendorf)。
材料:甲酸(Thermo Fisher);乙腈(Thermo Fisher);三氟乙酸(Thermo Fisher);二硫苏糖醇(Promega);糖苷酶F(NEB);盐酸胍(国药集团);乙二胺四乙酸二钠(国药集团);三羟甲基氨基甲烷(中国惠世试剂);盐酸(北京化工厂);碳酸氢铵(Sigma);碘乙酰胺(Sigma);胰蛋白酶(Promega);Glu-C酶(Roche);胰凝乳蛋白酶(Roche);N-乙基马来酰亚胺(Thermo);Lys-C酶(Wako);尿素(Sigma);一水合柠檬酸(国药集团);氯化钠(国药集团);磷酸氢二钠(湖南九典);磷酸二氢钾(北京化工厂);CD47-his(ACRO);SIRPα-his(ACRO)。
色谱柱Thermo MAbPacTM RP,4μm,2.1 mm×100 mm;Waters ACQUITY UPLC Peptide BEHC18,300 A,1.7μm,2.1 mm×100 mm。
2方法与结果
2.1质谱分子质量分析
2.1.1单抗供试品的处理
未切糖样品处理:取单抗用20 mM NH4HCO3稀释至1 mg/mL。
切糖后样品处理:取单抗用20 mM NH4HCO3稀释至12 mg/mL,按照100:1的质量比(W/W)加入PNGase F,37℃孵育过夜。
2.1.2色谱条件
流动相A:0.02%三氟乙酸,0.1%甲酸-水;流动相B:0.02%三氟乙酸,0.1%甲酸,-90%乙腈水;检测波长:210~220 nm;流速:0.3 mL/min;柱温:70℃;色谱柱:Thermo MAbPacTM RP,4μm,2.1 mm×100 mm;运行时间:15 min;洗脱程序为:0.01~1 min 20%B、1~11 min 20%~45%B,保持1 min;12~14 min 45%~20%B,保持1 min。
2.1.3质谱条件
样品采用Triple-TOF 6600高分辨质谱仪进行质谱分析,GS1:50;GS2:50;CUR:35;TEM:550℃;ISVF:5 500 V;m/z:600~5 000;Accumulation Time:0.25 s;Time Bins To Sum:40;DP:250;CE:10;CAD:4。
2.1.4质谱分子质量结果
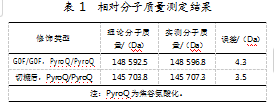
供试品使用高分辨质谱仪Triple-TOF 6600进行检测。切糖前后的相对分子质量如表1所示。切糖前后相对分子质量与理论分子质量误差均小于5 Da,表明分子质量测定结果与理论分子质量一致。
变性还原:取200 mg单抗样品,加入5mL 1 mol/L的Tris-HCl、75 mL 8 mol/L的盐酸胍、1 mL 0.5 mol/L的EDTA、2 mL 1 mol/L的DTT,用水补足体积至100 mL,混匀,56℃孵育1 h。
烷基化:将5 mL 1 mol/L的碘乙酰胺加入变性后的样品中,混匀,并于室温避光孵育30 min。
置换:用20 mM NH4HCO3将烷基化样品置换,稀释成蛋白质量浓度约1 mg/mL的溶液。
酶解:分别取50 mg置换后样品,加入2 mL 0.5 mg/mL的Trypsin、Chymotrypsin、Glu-C,37℃孵育过夜,离心取上清液检测。
2.2.2色谱条件
流动相A:0.05%三氟乙酸-水溶液;流动相B:0.05%三氟乙酸-乙腈溶液;检测波长:210~220 nm;流速:0.25 mL/min;进样体积:20μL;柱温:40℃;运行时间:80 min;洗脱程序为:0.01~2 min 0%B,2~72 min 0%~37%B,72~72.5 min 37%~90%B,保持1.5 min;74~74.5 min 90%~0%B,保持5.5 min。
2.2.3质谱条件
经超高效液相色谱分离后用Triple-TOF 6600质谱仪进行检测分析。分析时长80 min,检测方式为正离子。TOF MS参数:GS1:50;GS2:50;CUR:35;TEM:550℃;ISVF:5 500 V;m/z:200~1 800;Accumulation Time:0.5 s;Time Bins To Sum:4;DP:80;CE:10;CAD:4。Product Ion参数:GS1:50;GS2:50;CUR:35;TEM:550℃;ISVF:5 500 V;m/z:50~1 600;Accumulation Time:0.1 s;Time Bins To Sum:4;DP:80;CE:Rolling CE。
2.2.4氨基酸序列覆盖率结果
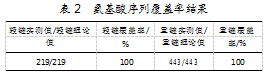
经LC-MS/MS采集样品并分析整合数据后[6-7],单抗轻链和重链肽段的覆盖率均达到100%。结果如表2所示。
2.3二硫键分析
2.3.1单抗供试品的处理
蛋白质变性:取200 mg anti-CD47加入200 mL 3 mol/L的盐酸胍,室温条件下变性1 h。
烷基化:将4 mL 0.4 mg/mL的NEM加入变性后的样品中,室温孵育30 min。
酶解:用1 M Tris-HCl-1M urea(pH 7.0)溶液将烷基化后样品进行置换。超滤完成后,将蛋白质量浓度控制在1 mg/mL左右。先加入4 mL 0.5 mg/mL的Lys-C,37℃孵育8 h,再加入4 mL 0.5 mg/mL的Chymotrypsin,37℃孵育过夜。取出后放置于4℃冰箱终止反应,离心取上清液检测[8-9]。
2.3.2色谱条件
流动相A:0.05%三氟乙酸-水溶液;流动相B:0.05%三氟乙酸-乙腈溶液;检测波长:220 nm;流速:0.25 mL/min;进样体积:20 mL;柱温:40℃;运行时间:80 min;色谱柱Waters ACQUITY UPLCPeptide BEH C18,300 A,1.7μm,2.1 mm×100 mm。
洗脱程序:0.01~2 min 0%B,2~72 min 0%~37%B,72~72.5 min 37%~90%B,保持1.5 min;74~74.5 min 90%~0%B,保持5.5 min。
2.3.3质谱条件
单抗供试品经超高效液相色谱分离后,用Triple-TOF 6600质谱仪(AB Sciex)进行质谱检测分析。分析时长为80 min,检测方式为正离子。TOF MS参数:GS1:50;GS2:50;CUR:35;TEM:550℃;ISVF:5 500 V;m/z:200~1 800;Accumulation Time:0.5 s;Time Bins To Sum:4;DP:80;CE:10;CAD:4。Product Ion参数:GS1:50;GS2:50;CUR:35;TEM:550℃;ISVF:5 500 V;m/z:50~1 600;Accumulation Time:0.1 s;Time Bins To Sum:4;DP:80;CE:Rolling CE。
2.3.4二硫键分析结果
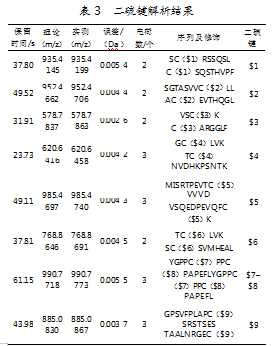
经质谱数据分析发现,轻链内含有2对二硫键;重链内含有4对二硫键及3种链间二硫键,且所有二硫键肽段理论分子质量和实测分子质量均满足误差小于0.1Da的要求,确认二硫键的位置均与理论二硫键位置一致。结果如表3所示。
2.4阻断实验研究
2.4.1单抗供试品的制备
用PBS将单抗稀释至10 mg/mL;将CD47-his稀释至500 nmol/L;将SIRPα-his稀释至500 nmol/L;PBS缓冲液作为Baseline;再生液为pH 1.5的甘氨酸溶液;中和液为pH 7.4的PBS缓冲液。
2.4.2样品的检测
将ProA传感器在PBS中预湿30 min。将样品分别置于板孔中,并以PBS为对照孔,每孔200 mL。
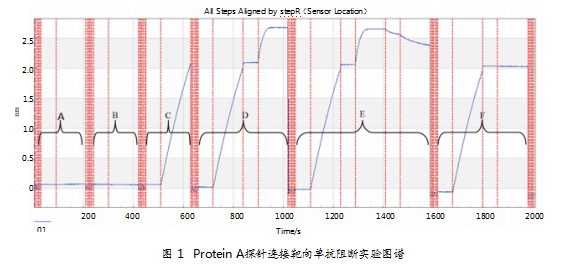
步骤检测:(1)按照Baesline-(SIRPα-his)的顺序进行检测,检测时间分别为60、120 s;(2)按照Baesline-(CD47-his)顺序进行检测,检测时间分别为60、120 s;(3)按照Baesline-单抗的顺序进行检测,检测时间分别为60、120 s;(4)按照Baesline1-单抗-Baesline2-(CD47)的顺序进行检测,检测时间分别为60、120、60、120 s;(5)按照Baesline1-单抗-Baesline2-(CD47-his)-Baesline3-(SIRPα-his)的顺序进行检测,检测时间分别为60、120、60、120、60、120 s;(6)按照Baesline1-单抗-Baesline2-(SIRPα-his)的顺序进行检测,检测时间分别为60、120、60、120 s。检测前后分别对探针进行再生及中和,时间为5 s,重复3次。
2.4.3阻断实验结果分析
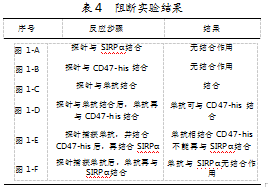
采用OCTET方法,使用Protein A探针,捕获单抗,并依次结合CD47-his和SIRPα,考察已与本品结合的CD47-his能否继续与SIRPα结合。试验结果显示,在分子水平上,单抗可与CD47-his结合,同时也可阻断CD47与SIRPα结合。结果如图1、表4所示。
3结论
本文通过转染CHO细胞系制备了IgG4型抗CD47单克隆抗体,并发现该抗体能够阻断CD47与SIRPα的相互作用,避免过度激活免疫反应。同时,研究利用LC-MS/MS技术对抗体进行了结构确证。结果显示,分子质量与理论值一致,氨基酸覆盖率达100%,并确认了16个二硫键的位置。此外,还采用OCTET技术分析了抗体的生物学特性,证实了其能够特异性结合CD47-his并阻断其与SIRPα的相互作用。
综上所述,通过表征靶向单抗的分子结构和生物学性质,可为CD47靶向治疗提供新的理论和实验数据,为临床应用打下基础。
参考文献
[1]OLDENBORG P,ZHELEZNYAK A,FANG Y,et al.Role of CD47 as a marker of self on red blood clls[J].Science,2000,288(5473):2051-2054.
[2]BARCLAY N A,BERG D V K T.The Interaction between signal regulatory protein alpha(SIRPα)and CD47:Structure,function,and therapeutic target[J].Annual Review of Immunology,2014,32(1):25-50.
[3]L H M,KATKA S,A N B,et al.The CD47-SIRPαsignaling axis as an innate immune checkpoint in cancer[J].Immunological Reviews,2017,276(1):145-164.
[4]ZHONGXING J,HAO S,JIFENG Y,et al.Targeting CD47 for cancer immunotherapy[J].Journal of Hematology&Oncology,2021,14(1):180.
[5]HAI Z,SHUANGSHUANG S,JUNWEI M,et al.CD47 as a promising therapeutic target in oncology[J].Frontiers in Immunology,2022,13:757480-757480.
[6]LUCA F,KRISTINA S,ROMAIN H,et al.Accurate sequence analysis of a monoclonal antibody by Top-Down and Middle-Down orbitrap mass spectrometry applying multiple ion activation techniques[J].Analytical Chemistry,2018,90(14):8421-8429.
[7]A.M B D,FRANCOIS J G,SEM T,et al.Selectivity over coverage in de novo sequencing of IgGs[J].Chemical Science,2020,11(43):11886.
[8]XIAOJUAN L,LI X,BRENT K,et al.Extended characterization of unpaired cysteines in an IgG1 monoclonal antibody by LC-MS analysis[J].Analytical Biochemistry,2021,622:114172.
[9]EVOLENED,THOMAS B,H魪LENED,et al.High-Resolution IMS-MS to assign additional disulfide bridge pairing in complementarity-determining regions of an IgG4 monoclonal antibody[J].Journal of the American Society for Mass Spectrometry,2021,32(10):2505-2512.










