2-酰基-4-酯基取代噻唑天然骨架的绿色仿生制备论文
2024-11-29 10:26:23 来源: 作者:dingchenxi
摘要:2-酰基-4-酯基取代噻唑为具有抗癌活性的Tubulysin、ITE以及除藻活性优良的结构类似物Bacillamide家族核心骨架,经典合成方案路线繁琐,条件相对苛刻,收率低。本文结合最新生源路径,仿生改进关键氧化脱氢步骤,高效率制备该类型中间体,并且初步阐明相应机理,为其工业化生产提供新颖策略。
摘要:2-酰基-4-酯基取代噻唑为具有抗癌活性的Tubulysin、ITE以及除藻活性优良的结构类似物Bacillamide家族核心骨架,经典合成方案路线繁琐,条件相对苛刻,收率低。本文结合最新生源路径,仿生改进关键氧化脱氢步骤,高效率制备该类型中间体,并且初步阐明相应机理,为其工业化生产提供新颖策略。
关键词:噻唑骨架;Tubulysin;ITE;Bacillamide;仿生制备;绿色工艺
Tubulysins是从海洋黏细菌中分离得到的一类四肽化合物,其作用机制与秋水仙碱和长春花碱等相似,通过抑制微管蛋白聚合进而破坏纺锤体的形成,诱导肿瘤细胞凋亡。其中活性最强的结构类型强度达到皮摩尔级,并对耐药肿瘤细胞显示很强的抑制活性。此外,Tubulysins还具有抗血管生成的作用,在体内具有良好的肿瘤生长抑制作用。针对转移和侵染性肿瘤,其与靶向递送策略结合将具有广阔的研究前景[1]。

ITE在2002年从猪肺里面提取得到,是一个天然的内源性芳香烃受体(AhR)激活剂,体内和体外毒性都很低。具有抗肝癌、前列腺癌、乳腺癌和卵巢癌作用。可结合至AhR,调节由AhR控制的功能和信号通路,从而影响癌细胞的生长与增殖以及肿瘤细胞的侵袭。化合物ITE相关衍生化的药物组合物能够用作AhR抑制剂或非组成型AhR激动剂,可用于抑制癌细胞生长以及肿瘤细胞的转移和侵袭[2-3]。
许多海洋来源的细菌有杀藻作用,通过对相关特殊蛋白酶、次生代谢产物的系统研究可促进发掘新颖的抑制有害藻华的先导物。2003年,Bacillamide A从海洋细菌Bacillus sp.SY-1中分离出来,对腰鞭毛虫类海藻有杀灭效果[4]。2007年,Socha等从超高盐度的微生物中分离出同系物Bacillamide B和C[5]。从生源途径推导,Bacillamide A的羰基经过立体选择性还原可得到Bacillamide B。而Bacillamide A立体选择性还原胺化后生成Bacillamide D,后者酰化即得Bacillamide C。Bacillamide D相关生物合成路径已经确证,先脱水形成噻唑啉环,然后氧化脱氢得噻唑[6-7](图1)。
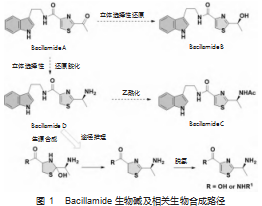
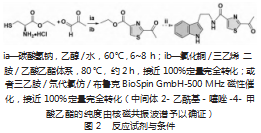
研究表明Bacillamide类化合物对赤潮藻等具有显著抑制效果,为化学与生物领域相关研发热点。国内外多个研究组采用不同的方案,大多数反应路线繁琐,条件相对苛刻,总体收率低。2018年,Aggarwal等设计了3步的仿生合成路线[8]。L-半胱氨酸乙酯盐酸盐与丙酮醛经由[4+1]环合得到噻唑烷酯,碘苯二乙酸(IBD)氧化得到噻唑中间体,最后有机碱催化无溶剂酯氨交换制备Bacillamide A,该路线有一定的优点,然而2当量具有一定危险性的有机高价碘IBD并不利于放大工艺。为此,针对该步骤反应难题,本课题组系统筛选多批次金属与非金属催化剂,其中,氯化铜与DABCO的组合[约10%(摩尔分数)CuCl2/25%(摩尔分数)DABCO],在80℃加热条件下,实现了空气参与的绿色脱氢芳构化,接近100%定量完全转化,反应产物粗品纯度极高(NMR粗谱)。并且后处理过程简捷,常规萃取结合水洗后,旋蒸浓缩除去溶剂得到较纯粗品,免去柱层析等复杂操作。为Bacillamide类化合物的工业化生产,提供了新的替代思路(图2)。
1实验部分
1.1仪器与试剂
丙酮醛,上海阿拉丁,40%水溶液;L-半胱氨酸乙酯盐酸盐,上海阿拉丁,98%;三乙胺,广东光华,AR;氯化铜二水合物,国药化试,99%;DABCO,Adamas,CP;乙酸乙酯,成都科隆,AR;氘代氯仿,TMS内标,Cambridge Isotope Laboratories,99.8%。
C-MAG HS 7型数显恒温可控加热磁力搅拌器,德国IKA;N-1300V-WB型旋转蒸发仪,日本东京理化;Bruker BioSpin GmbH 500 MHz核磁共振波谱仪,布鲁克。
1.2中间体2-乙酰基-噻唑-4-甲酸乙酯的合成
2-乙酰基-噻唑烷-4-甲酸乙酯依文献方案制备[8]:将该酯粗品约1 mmol放入25 mL的圆底烧瓶中,随后依次加入摩尔分数为10%的CuCl2、摩尔分数为25%的DABCO,加入乙酸乙酯约8 mL,搅拌使其混合均匀,升温至80℃,反应时间约2 h。通过TLC检测反应完成后,转移溶剂,适量水洗有机相,重复操作2次。取上层乙酸乙酯相,旋转蒸发仪除去溶剂,真空干燥后即得纯度较高的2-乙酰基-噻唑-4-甲酸乙酯。
或者将2-乙酰基-噻唑烷-4-甲酸乙酯粗品约8 mg(含有痕量三乙胺),溶于0.5 mL氘代氯仿,转移入常规核磁管,在Bruker BioSpin GmbH 500 MHz磁场催化作用下,氧化脱氢得到相应的噻唑,即纯度较高的2-乙酰基-噻唑-4-甲酸乙酯。
2数据分析与反应机理
1H NMR(500 MHz,CDCl3)δH 8.43(s,1H),4.45(q,J=7.2 Hz,2H),2.79(s,3H),1.43(t,J=7.2 Hz,3H)。
13C NMR(126 MHz,CDCl3)δC 191.62,167.47,160.83,148.75,133.32,61.87,26.10,14.29。
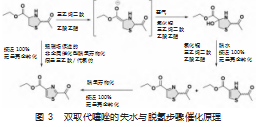
根据相关文献,反应机理初步推测如下,噻唑烷在DABCO作用下发生烯醇化,然后空气氧化引入一个角部氢氧取代基[9]。值得注意的是,无铜盐催化条件下,单独依赖DABCO,或者相反,最终噻唑产物收率都极低。因此,该空气参与的氧化关键步骤,可能需要金属与配体的协同作用。后续脱水反应,生成噻唑啉与其异构体,最终经由自动脱氢流程[10],形成热力学稳定的多共轭取代芳环片段。同时,另一个高效率的直接转化被意外发现,噻唑烷在痕量三乙胺存在情况下,以氘代氯仿为溶剂,在核磁分析过程的强磁场作用下,直接氧化为噻唑。而在无强磁场时,不论空气中,或者氮气保护下,室温至80℃区间,该脱氢芳构化都无法实现。初步推测,氧化还原反应的磁催化效应促进了非金属参与下的转化效率(图3)。
3结论
根据Bacillamide类化合物经典合成的难点与挑战,成功改进合成2-乙酰基-噻唑-4-甲酸乙酯中间体的仿生方案,使用CuCl2作为催化剂,空气中敞口加热回流,接近完全转化。该方法具有反应条件温和、操作步骤简便、产率高、催化剂绿色、氧源清洁等优点。同时发现非金属催化条件下,氧化还原反应的磁催化效应也可实现高效率的转化。对比相关研究,上述噻唑核心骨架的绿色合成,易于拓展应用到Bacillamide结构类似物。为Bacillamide、Tubulysin和ITE家族大规模工业化制备与衍生物改造与修饰,提供了新颖实用的替代策略,有利于深入挖掘该类天然产物的应用价值。
参考文献
[1]Nicolaou K C,Yin J,Mandal D,et al.Total synthesis and biological e-valuation of natural and designed tubulysins[J].Journal of the Ameri-can Chemical Society,2016,138(5):1698-1708.
[2]Song J,Clagett-Dame M,Peterson R E,et al.A ligand for the aryl hy-drocarbon receptor isolated from lung[J].Proceedings of the National Academy of Sciences,2002,99(23):14694-14699.
[3]Cheng J,Li W,Kang B,et al.Tryptophan derivatives regulate the tran-scription of Oct4 in stem-like cancer cells[J].Nature Communica-tions,2015,6(1):7209.
[4]Jeong S Y,Ishida K,Ito Y,et al.Bacillamide,a novel algicide from the marine bacterium,Bacillus sp.SY-1,against the harmful dinoflagel-late,Cochlodinium polykrikoides[J].Tetrahedron Letters,2003,44(43):8005-8007.
[5]Socha A M,Long R A,Rowley D C.Bacillamides from a hypersaline microbial mat bacterium[J].Journal of Natural Products,2007,70(11):1793-1795.
[6]Zhang F,Mulati N,Wang Y,et al.Biosynthesis in vitro of bacillamide intermediate-heterocyclic AlaCysthiazole by heterologous expression of nonribosomal peptide synthetase(NRPS)[J].Journal of Biotechnol-ogy,2019,292:5-11.
[7]Fortinez C M,Bloudoff K,Harrigan C,et al.Structures and function of a tailoring oxidase in complex with a nonribosomal peptide synthetase module[J].Nature Communications,2022,13(1):548.
[8]Kumara S,Aggarwal R.A concise and efficient route to the total syn-thesis of bacillamide A and its analogues[J].Arkivoc,2018,part iii:354-361.
[9]Dawsey A C,Li V,Hamilton K C,et al.Copper-catalyzed oxidation of azolines to azoles[J].Dalton Transactions,2012,41(26):79948002.
[10]Lu Y,Li C M,Wang Z,et al.Discovery of 4-substituted methoxyben-zoyl-aryl-thiazole as novel anticancer agents:synthesis,biological e-valuation,and structure-activity relationships[J].Journal of Medici-nal Chemistry,2009,52(6):1701-1711.










