基于紫胶红素的靶标有色化免疫层析试纸条联检大肠杆菌O157∶H7和沙门氏菌论文
2024-09-24 15:21:15 来源: 作者:liziwei
摘要:为摆脱免疫层析试纸条对配对抗体的依赖,文章设计了一种新型靶标有色化免疫层析试纸条,使用紫胶红素和十二合水硫酸铝钾媒染剂,通过先媒后染的方法,实现了免疫层析试纸条的“可视化”。验证结果显示,该试纸条对大肠杆菌O157∶H7和沙门氏菌的检测限均达到了106 CFU/mL;同时,与常见食源性致病菌间不存在交叉反应,在鸡胸肉、鸡蛋、牛奶等食品基质中能够在增菌9 h内检出。文章成功设计了一种操作简单、检测成本低,更易国产化的快速检测免疫层析试纸条,为后续免疫层析试纸条的设计提供了新思路。
摘要:为摆脱免疫层析试纸条对配对抗体的依赖,文章设计了一种新型靶标有色化免疫层析试纸条,使用紫胶红素和十二合水硫酸铝钾媒染剂,通过先媒后染的方法,实现了免疫层析试纸条的“可视化”。验证结果显示,该试纸条对大肠杆菌O157∶H7和沙门氏菌的检测限均达到了106 CFU/mL;同时,与常见食源性致病菌间不存在交叉反应,在鸡胸肉、鸡蛋、牛奶等食品基质中能够在增菌9 h内检出。文章成功设计了一种操作简单、检测成本低,更易国产化的快速检测免疫层析试纸条,为后续免疫层析试纸条的设计提供了新思路。
关键词:大肠杆菌O157∶H7;沙门氏菌;紫胶红素;靶标有色化;免疫层析试纸条
大肠杆菌O157∶H7(Escherichia coli O157∶H7)和沙门氏菌(Salmonella)同为革兰氏阴性菌,是两种常见的毒性极强的食源性致病菌。大肠杆菌O157∶H7作为一种肠道出血性大肠杆菌,是引发食物中毒的重要原因之一,多发于低龄、高龄、免疫功能匮乏人群,感染者通常会出现出血性腹泻症状,严重者甚至会引发肾衰竭,如果不能及时则医很可能危及生命。沙门氏菌是全球范围内导致食源性疾病重要的人畜共患病原菌之一。沙门氏菌极易污染水源、动物性食品(如肉蛋奶等)、生鲜蔬菜等,使感染者出现腹泻、发热、腹痛等症状。这两种菌都可通过食物传播,引起人体不适,因此,对食品中的两种菌进行准确检测至关重要。
近年来,关于两种食源性致病菌的检测方法一直在不断更新发展,包括传统培养鉴定法、免疫学方法和分子生物学方法等。传统培养鉴定法被认为是国家或行业食源性致病菌检测的基础标准,主要通过预增菌、分离培养、生化鉴定等途径进行检测。但这种方法检测时间长、操作复杂,严重影响了检测的及时性和有效性。而分子生物学和免疫学检测方法由于可以高效、快速地提供准确结果,故已成为近年来的主要研究方向。其中,分子生物学检测方法主要包括聚合酶链式反应(Polymerase Chain Reaction,PCR)、多重PCR、real time-PCR[6,12]、环介导等温扩增技术(Loop-mediated isothermal Amplification,LAMP)、酸探针技术、扩增片段长度多态性技术(Amplified fragment length polymorphism,AFLP)、基因芯片技术等。该类方法虽然检测灵敏度高、周期短,但均需要配备相应的仪器和操作熟练的技术人员,且检测体系易被污染,造成假阳性结果,使该类检测技术受限于实验室而无法满足现场检测的需求。最常用的免疫学检测方法是酶联免疫吸附测定法(Enzyme Linked Immunosorbent Assay,ELISA)[17-18],但该方法检测时间较长(6~8 h)。而同样基于抗原抗体结合原理的免疫层析试纸条(Immunochromatographic Strip(ICS),可实现对靶标的快速、准确检测,操作简单且价格低廉,当前已被广泛应用于食品生产和监管、环境保护,以及临床诊断等领域。
紫胶红素也被称为紫胶色酸,是从紫胶昆虫分泌物中提取的一种天然染料,主要由紫胶色酸A、B、C、D和E组成。该物质可以充当安全、环保的着色剂,也可被应用于潜在抗肿瘤药物的研究中。本研究将以紫胶红素为新型细菌传感器,用于食源性致病菌的染色和检测中。该方法检测的特异性较强,可用于对食品中大肠杆菌O157∶H7和沙门氏菌的快速检测,且无需抗体标记材料,更无需双抗体夹心的配对抗体,能够有效摆脱免疫层析试纸条对抗体和标记材料的过度依赖,为试纸条的研究带来了新的突破。
1材料与方法
1.1材料与试剂
实验所用主要试剂及菌株的具体信息如表1、2所示。

1.2实验方法
1.2.1抗体制备
通过小鼠体内诱生法制备大肠杆菌O157∶H7和沙门氏菌单克隆抗体,具体方法如下。将不完全弗氏佐剂(55℃预热30 min)按照0.6 mL/只的标准对小鼠实施腹腔注射,3 d后单只腹腔接种约106个杂交瘤细胞,约10 d后,可见小鼠腹部明显胀大,使用2 mL注射器抽取腹水,即可获得大量大肠杆菌O157∶H7和沙门氏菌单克隆抗体。
1.2.2靶标有色化试纸条的组装
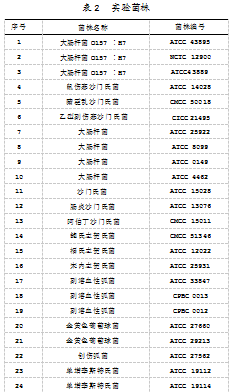
本实验所研制设计的试纸条由样品垫、NC膜、吸水纸和PVC底板组成,形状如图1所示。大肠杆菌抗体喷涂于NC膜上作为T1线,沙门氏菌抗体喷涂于NC膜上作为T2线,将其自然晾干后密封保存。样品垫(300 mm×200 mm)、NC膜(300 mm×200 mm)和吸水纸(300 mm×300 mm)均固定于PVC支撑板上,相邻组件之间覆盖1 mm,便可得到组装好的试纸条。
1.2.3靶标有色化试纸条的研制
将0.2 g紫胶红素溶于80 mL二甲基亚砜溶液中,用0.22μm滤膜过滤,取出滤液即为配制好的紫胶红素溶液,保存备用。分别配制0.01 mol/mL的无水硫酸镁、六水合氯化铁、柠檬酸铁氨、六水合氯化镁、十二合水硫酸铝钾、硫酸铁、硫酸高铁铵、硫酸亚铁铵作为媒染剂,采用不同的媒染方法(如先媒后染、先染后媒、同时媒染等)对大肠杆菌O157∶H7和沙门氏菌进行染色,根据染色效果确定最佳染色方式和最佳媒染剂。
利用先媒后染的方法染色沙门氏菌的具体操作步骤如下。将两种菌置于营养肉汤中培养过夜,依次取出1 mL菌液于8个离心管中,以8 000 r/min的速度离心10 min,弃去上清液;将8种不同的媒染剂各取100μL分别加入8个离心管中并进行沉淀重悬,置于振荡器上以1 200 r/min的速度振荡10 min,再在8 000 r/min的条件下离心10 min,弃去上清液;分别在沉淀中加入100μL紫胶红素溶液重悬,置于振荡器上以1 200 r/min的速度振荡10 min,再在8 000 r/min条件下离心10 min,弃去上清液;沉淀用超纯水重悬至原体积。
利用先染后媒方法染色沙门氏菌的具体操作步骤如下。将两种菌置于营养肉汤中培养过夜,依次取出1 mL菌液于8个离心管中,以8 000 r/min的速度离心10 min,弃去上清液;分别在沉淀物中加入100μL紫胶红素溶液重悬,置于振荡器上以1 200 r/min的速度振荡10 min,再在8 000 r/min条件下离心10 min,弃去上清液;将8种不同的媒染剂各取100μL分别加入8个离心管中重悬沉淀,置于振荡器中以1 200 r/min的速度振荡10 min,再于8 000 r/min的条件下离心10 min,弃去上清液;沉淀用超纯水重悬至原体积。
利用媒染方法染色沙门氏菌的具体操作步骤如下。将沙门氏菌置于营养肉汤中培养过夜,依次取1 mL菌液于8个离心管中,以8 000 r/min的速度离心10 min,弃去上清液;将8种不同的媒染剂各取100μL分别加入8个离心管中,同时向每个离心管中加入100μL紫胶红素溶液,将重悬的沉淀物置于振荡器上以1 200 r/min的速度振荡10 min,再于8 000 r/min条件下离心10 min,弃去上清液;沉淀物用超纯水重悬至原体积。
将使用不同媒染剂和不同媒染方式染色后的两种菌利用试纸条进行检测,并选择无假阴性和假阳性结果且染色效果最佳的染色方式和媒染剂作为最佳的染色条件。
1.2.4样品测定与结果判读
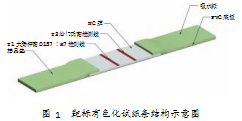
基于紫胶红素染色沙门氏菌试纸条的测定流程如下。取100μL样品溶液加入96孔板的小孔中,并将试纸条放入小孔中。样品会层析作用由于向上层析,若样品中含有目标菌,染色后目标菌在向上层析,流经T1、T2线时,会被T线上的抗体捕获,产生可视化颜色,即T线显色。若T1显色,则单一菌为大肠杆菌O157∶H7;若T2显色,则单一菌为沙门氏菌;若双线显色,则皆含有大肠杆菌O157∶H7和沙门氏菌;若样品中没有目标菌,则样品流经T线后继续向上层析,T线不显色。具体效果如图2所示。
1.2.5靶标有色化试纸条灵敏度测定
将大肠杆菌O157∶H7和沙门氏菌置于营养肉汤中培养过夜,采用平板计数法计数,并利用上述确定的最佳媒染剂和媒染方式进行紫胶红素染色,将待测液梯度稀释为不同质量浓度的液体,用试纸条进行检测。
1.2.6靶标有色化试纸条特异性测定
将3株大肠杆菌O157∶H7、6株沙门氏菌和15株其他食源性致病菌过夜培养,使菌液的质量浓度高于108 CFU/mL,对沙门氏菌采用紫胶红素染色沙门氏菌的方法进行染色,并使用试纸条检测,观察试纸条对沙门氏菌的检测结果。若T线显色,则证明该试纸条可以检测,反之,则不可以检测。
1.2.7靶标有色化试纸条模拟带菌测定
为验证该方法在食品样品检测中的可行性,可以使用试纸条来检测人工污染的食品,模拟检测被大肠杆菌O157∶H7和沙门氏菌污染的实际样品,具体方法如下。将从本地超市购买的鸡胸肉、鸡蛋和牛奶取25 mL或25 g分别添加到营养肉汤培养基(225 mL)中,均质2 min后置于121℃的环境中高温高压灭菌15 min,待降至室温后在无菌环境中通过无菌操作向其中加入约250 CFU的大肠杆菌O157∶H7和沙门氏菌,使其质量浓度达到1 CFU/mL左右,培养12 h,期间每隔1 h从细菌培养瓶中收集1 mL培养液,染色后检测靶标有色化试纸条的检测效果。
2结果与分析
2.1媒染剂和媒染方法的筛选结果
选择8种媒染剂,从1到8依次为无水硫酸镁、六水合氯化铁、柠檬酸铁氨、六水合氯化镁、十二合水硫酸铝钾、硫酸铁、硫酸高铁铵、硫酸亚铁铵,以及三种方式筛选结果。如图3a、b、c所示,在对大肠杆菌O157∶H7进行染色时,先媒后染方式下检测线颜色最深者最易于观察,且通过图3d、e、f中对沙门氏菌的染色也得出了相同的结论。因此,选择先媒后染的方式作为后续实验的染色方法。通过图3a、d发现,5、6号染色剂效果良好,但6号背景颜色相对较深。因此,选择5号十二合水硫酸铝钾作为后续实验的媒染剂。具体染色情况如图3所示。

2.2联检大肠杆菌O157∶H7和沙门氏菌靶标有色化试纸条灵敏度测定
在本研究中,为测定靶标有色化试纸条的灵敏度,对过夜培养的大肠杆菌O157∶H7菌液(1.6×108 CFU/mL)、沙门氏菌菌液(2.8×108 CFU/mL)和等比例混合的两种菌液进行梯度稀释(108~104),将按照同种方法进行染色处理的营养肉汤作为阴性对照,并分别取100μL滴加在样品点上。结果如图4a所示,靶标有色化试纸条检测到大肠杆菌O157∶H7的检测限为1.6×106 CFU/mL;图4b显示靶标有色化试纸条检测到沙门氏菌的检测限为2.8×106 CFU/mL;图4c显示进行联检时,大肠杆菌O157∶H7的检测限为1.6×106 CFU/mL,沙门氏菌的检测限为2.8×106 CFU/mL;图4c中3号试纸条的T2受拍照限制颜色并不明显,但在肉眼下效果可视,且图4a、b、c三图中6号均无假阳性结果。具体结果如图4所示。

2.3联检大肠杆菌O157∶H7和沙门氏菌靶标有色化试纸条特异性测定
将3株大肠杆菌O157∶H7、6株沙门氏菌、15株其他食源性致病菌和以同样方法染色的营养肉汤用上述确定的染色方式进行染色处理。研究发现,大肠杆菌O157∶H7(ATCC 43895、NCTC 12900、ATCC43889)、沙门氏菌(ATCC 14028、CMCC 50018、CICC 21495)分别出现了明显条带,而其余18种常见菌株和阴性对照均未出现条带。由此可知,该靶标有色化试纸条特异性较好,并未出现交叉反应。具体情况如图5所示。

2.4联检大肠杆菌O157∶H7和沙门氏菌靶标有色化试纸条模拟带菌实验
使用猪霍乱沙门氏菌CMCC 50018和大肠杆菌O157∶H7 NCTC 12900对鸡胸肉、鸡蛋、牛奶进行人工污染。研究发现,如图6d、e、f所示,靶标有色化试纸条在沙门氏菌污染的肉蛋奶样品中均在第9小时出现条带;图6g、h、i显示,靶标有色化试纸条在大肠杆菌O157∶H7污染的肉蛋奶样品中分别在第8小时、第9小时、第8小时出现条带;图6a、b、c显示,靶标有色化试纸条在受到两种菌污染的肉蛋奶样品中均在第9小时出现条带。在鸡蛋中效果较差可能是由于食品机制对菌的染色影响较大,导致检测时间延后。综上所述,靶标有色化试纸条可以在复杂的食品环境中准确快速地检测出两种食源性致病菌。具体染色结果如图6所示。

3结论
本文通过紫胶红素染料与十二合水硫酸铝钾媒染剂先媒后染的方法,开发了一种新型联检大肠杆菌O157∶H7和沙门氏菌靶标有色化的免疫层析试纸条,并对其灵敏度、特异性进行验证,模拟了真实食品机制下的检测效果。研究表明,该方法特异性良好,在模拟带菌实验中多种食品基质的影响下,仍能在9 h内检出目标物。在灵敏度方面,两种菌的检测限均达到了106 CFU/mL。但相比于常用胶体金试纸条,该方法仍低一个数量级,分析其原因可能为:经过多重离心重悬操作后菌的数量有所损失,导致实际浓度低于原有浓度,同时胶体金颗粒较小,可在T线处富集更多颗粒,使其颜色更加鲜明;也可能是紫胶红素为天然色素,部分溶于水中,容易导致其颜色变浅。然而,相较于胶体金试纸条,该方法有效解决了免疫层析试纸条对配对抗体和胶体金颗粒过度依赖的问题,极大程度地降低了制作难度和制作成本,并在后续使用中延长了保存时间,具有普及化和国产化的应用前景。
参考文献
[1]KARCH H,TARR P I,BIELASZEWSKA M.Enterohaemorrhagic Escherichia coli in human medicine[J].International Journal of Medical Microbiology,2005,295(6-7):405-18.
[2]GWAVAVA C,CHIHOTA V,GANGAIDZO I,et al.Dysentery in patients infected with human immunodeficiency virus in Zimbabwe:an emerging role for Schistosoma mansoni and Escherichia coli O157[J].Annals of Tropical Medicine&Parasitology,2001,95(5):509-13.
[3]ABONG'O B,MOMBA M,MALAKATE V,et al.Prevalence of Escherichia coli O157∶H7 among diarrhoeic HIV/AIDS patients in the Eastern Cape Province-South Africa[J].Pakistan Journal of Biological Sciences:PJBS,2008,11(8):1066-75.
[4]LUPINDUA A M.Epidemiology of Shiga toxin-producing
Escherichia coli O157∶H7 in Africa in review[J].Southern African Journal of Infectious Diseases,2018,33(1):24-30.
[5]WONG S Y,PASCHOS A,GUPTA R S,et al.Insertion/deletion-based approach for the detection of Escherichia coli O157∶H7 in freshwater environments[J].Environmental Science&Technology,2014,48(19):11462-70.
[6]ZHAO X,XIA J,LIU Y.Contrast of real-time fluorescent PCR methods for detection of Escherichia coli O157∶H7 and of introducing an internal amplification control[J].Microorganisms,2019,7(8):230.
[7]LIU Y,HAN R,WANG J,et al.Magnesium sensing regulates intestinal colonization of enterohemorrhagic Escherichia coli O157∶H7[J].MBio,2020,11(6):10.1128/mbio.02470-20.
[8]ABDELHASEIB M U,SINGH A K,BAILEY M,et al.Fiber optic and light scattering sensors:Complimentary approaches to rapid detection of Salmonella enterica in food samples[J].Food Control,2016,61:135-45.
[9]ZHU A,ALI S,JIAO T,et al.Advances in surface enhanced Raman spectroscopy technology for detection of foodborne pathogens[J].Comprehensive Reviews in Food Science and Food Safety,2023,22(3):1466-94.
[10]HU J,HUANG R,SUN Y,et al.Sensitive and rapid visual detection of Salmonella Typhimurium in milk based on recombinase polymerase amplification with lateral flow dipsticks[J].Journal ofMicrobiological Methods,2019,158:25-32.
[11]MOEZI P,KARGAR M,DOOSTI A,et al.Multiplex touchdown PCR assay to enhance specificity and sensitivity for concurrent detection of four foodborne pathogens in raw milk[J].Journal of Applied Microbiology,2019,127(1):262-73.
[12]LIANG T,ZHOU P,ZHOU B,et al.Simultaneous quantitative detection of viable Escherichia coli O157:H7,Cronobacter spp.,and Salmonella spp.using sodium deoxycholate-propidium monoazide with multiplex real-time PCR[J].Journal of Dairy Science,2019,102(4):2954-65.
[13]SHANG Y,YE Q,CAI S,et al.Loop-mediated isothermal amplification(LAMP)for rapid detection of Salmonella in foods based on new molecular targets[J].Lwt,2021,142:110999.
[14]MACHADO I,GARRIDO V,HERNANDEZ L I,et al.Rapid and specific detection of Salmonella infections using chemically modified nucleic acid probes[J].Analytica Dhimica Acta,2019,1054:157-66.
[15]ROSS I L,WILLMORE R,HEUZENROEDER M W.A fluorescent amplified fragment length polymorphism study of Salmonella enterica serovar Sofia,the major Salmonella serovar isolated from chickens in Australia[J].International Journal of Medical Microbiology,2003,293(5):371-5.
[16]LI Y.Establishment and Application of a Visual DNA Microarray for the Detection of Food-borne Pathogens[J].Analytical Sciences,2016,32(2):215-8.
[17]WANG C,XING K,ZHANG G,et al.Novel ELISA based on fluorescent quenching of DNA-stabilized silver nanoclusters for detecting E.coli O157∶H7[J].Food Chemistry,2019,281:91-6.
[18]ARIBAM S D,OGAWA Y,MATSUI H,et al.Monoclonal antibody-based competitive enzyme-linked immunosorbent assay to detect antibodies to O:4 Salmonella in the sera of livestock and poultry[J].Journal of Microbiological Methods,2015,108:1-3.
[19]WANG Q,LONG M,LV C,et al.Lanthanide-labeled fluorescent-nanoparticle immunochromatographic strips enable rapid and quantitative detection of Escherichia coli O157:H7 in food samples[J].Food Control,2020,109:106894.
[20]LIU C,FANG S,TIAN Y,et al.Rapid detection of Escherichia coli O157:H7 in milk,bread,and jelly by lac dye coloration based bidirectional lateral flow immunoassay strip[J].Journal of Food Safety,2021,41(1):e12862.
[21]REN Y,WEI J,HE Y,et al.Ultrasensitive label-free immunochromatographic strip sensor for Salmonella determination based on salt-induced aggregated gold nanoparticles[J].Food Chemistry,2021,343:128518.
[22]BURWOOD R,READ G,SCHOFIELD K,et al.1133.The pigments of stick lac.Part I.Isolation and preliminary examination[J].Journal of the Chemical Society(Resumed),1965,60:67-73.
[23]SANTOS R,HALLETT J,OLIVEIRA M C,et al.HPLC-DAD-MS analysis of colorant and resinous components of lac-dye:A comparison between Kerria and Paratachardina genera[J].Dyes and Pigments,2015,118:129-36.
[24]OKA H,ITO Y,YAMADA S,et al.Separation of lac dye components by high-speed counter-current chromatography[J].Journal of Chromatography A,1998,813(1):71-7.
[25]NANDKISHORE T,SANJAY S,MURARI P.Chronic toxicity assessment of lac dye as potential food colorant[J].2017.
[26]COOKSEY C J.The red insect dyes:carminic,kermesic and laccaic acids and their derivatives[J].Biotechnic&Histochemistry,2019,94(2):100-7.










