海洋真菌Talaromyces sp.1116的次生代谢产物研究论文
2024-09-23 17:05:43 来源: 作者:liziwei
摘要:现有研究利用多种色谱层析技术从一株来源于南海海洋的篮状菌属真菌1116的发酵粗提物中分离纯化获得了4个芳香族化合物,包括2个异香豆素类衍生物和2个多羟基蒽酮类化合物。通过核磁共振(NMR)、质谱(MS)等现代波谱分析方法,鉴定其结构分别为penicixanthones G(1),penicixanthones A(2),sclerotinin A(3),6-methoxymellein(4)。由此,菌株1116经18S rDNA序列分析比对被鉴定为篮状菌属真菌。基于此,文章旨在对Talaromyces s
摘要:现有研究利用多种色谱层析技术从一株来源于南海海洋的篮状菌属真菌1116的发酵粗提物中分离纯化获得了4个芳香族化合物,包括2个异香豆素类衍生物和2个多羟基蒽酮类化合物。通过核磁共振(NMR)、质谱(MS)等现代波谱分析方法,鉴定其结构分别为penicixanthones G(1),penicixanthones A(2),sclerotinin A(3),6-methoxymellein(4)。由此,菌株1116经18S rDNA序列分析比对被鉴定为篮状菌属真菌。基于此,文章旨在对Talaromyces sp.1116中的这4个化合物进行分离与鉴定。
关键词:多羟基蒽酮;异香豆素;海洋真菌;篮状菌属;次级代谢产物
地球上蕴藏着丰富且宝贵的微生物资源。微生物作为活性天然产物的重要来源,有着悠久的历史,尤其是在药物研发领域中。占地球总面积70%的海洋生态系统具有高压、低温、高盐等独特的生境,是探索药物先导化合物的重要宝库。因此,来源于海洋微生物的天然产物成为海洋新药开发领域的研究热点。这些海洋真菌次级代谢产物包含聚酮、生物碱、萜类、甾体、卤代物、脂肪酸、肽类、糖苷等众多结构型,生物活性涉及抗菌、抗炎、抗病毒、抗肿瘤和酶抑制活性等诸多方面。
篮状菌广泛存在于陆地和海洋生态系统中,其活性代谢产物结构多样,且活性优良。例如,大环内酯类化合物wortmannilactone A-D对多种人体恶性肿瘤细胞(MDA-MB-231、HCT-5、HCT-115、K562和A549)具有良好的生物学活性;醌类化合物vanitaracin A展现出了优良的抗乙肝病毒活性,IC50为10.5μmol/L;聚酮类化合物talaromycesone A-B对金黄色葡萄球菌表现出了较高的活性等。上述案例表明,篮状菌具有广阔的开发前景,用篮状菌来开发新型药物未来可期。
1材料与方法
1.1仪器与材料
赛默飞Dionex UltiMate U3000 HPLC高效液相色谱仪;Agilent 6410 Triple Quad LC/MS液质联用仪;Bruker AVANCE NEO核磁共振仪;Welch Ultimate XB-C18色谱柱;EYELA N-1300旋转蒸发仪;色谱纯乙腈、甲醇。
PDA培养基:马铃薯浸出粉300 g/L、葡萄糖20 g/L、海盐30 g/L、琼脂20 g/L;TSBY培养液:蔗糖103 g/L、胰酪大豆胨30 g/L,酵母提取物5 g/L,115℃条件下灭菌30 min;大米培养基:大米100 g,酵母粉0.2%,蛋白胨0.2%,葡萄糖0.05%,海盐3%,121℃条件下灭菌30 min。
1.2方法
1.2.1菌株的发酵培养
取PDA平板上1116的菌丝体,接种到含有TSBY培养液的250 mL锥形瓶中,在28℃、200 r/min的摇床上培养2 d,得到发酵种子液。取发酵种子液,按照2.5%的比例加入200 g大米培养基中,28℃环境中静置培养28 d,共发酵3 kg。
1.2.2发酵产物的提取和分离
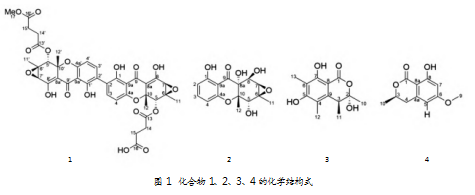
用镊子将锥形瓶中发酵好的大米捣碎,加入同体积的乙酸乙酯,充分浸润,超声萃取3次,合并萃取液,经旋转蒸发仪浓缩得到总浸膏。将粗浸膏拌样,过二氯甲烷-甲醇体系正向柱1%梯度洗脱,得到Fr.A1-A8。将Fr.A1通过正向硅胶石油醚-乙酸乙酯体系10%梯度洗脱,得到Fr.B1-B8。将Fr.B6采用高效液相色谱法制备,得到化合物1(21 mg,tR=18 min)。将Fr.B3采用正向硅胶石油醚-乙酸乙酯体系(90%~50%)梯度洗脱,得到Fr.C1-C5。将Fr.C2采用高效液相色谱法制备,获得化合物2(18 mg,tR=7.15 min)和化合物3(12 mg,tR=9.5 min)。将Fr.B5-9采用反向硅胶水-甲醇体系10%梯度洗脱,得到Fr.D1-D8,合并Fr.D1-D2并进一步使用高效液相色谱制备得到化合物4(8 mg,tR=6 min)。这4种化合物的化学结构式如图1所示。
2结果与讨论
2.1菌株鉴定
18S rDNA序列分析表明,菌株1116(GenBank accession number:PP068846)与篮状菌属Talaromyces verruculosus isolate SFE1菌株的18S rDNA序列相似性较高,因此将其鉴定为Talaromyces sp.1116。系统发育树见图2。

2.2结构鉴定
化合物1呈淡黄色粉末状,(+)ESI-MS给出分子准离子峰m/z 793.6[M+H]+,推测化合物1的分子量为792。13C谱中显示,很多信号以具有微小差异的成对碳信号存在,表明其可能是一个不完全对称的分子。结合H谱中类似的特点,初步确定除16’氧甲基之外,其他部分可以形成一个对称的分子penicixanthone E。penicixanthone E加1个16’氧甲基,最终形成一个不完全对称的penicixanthones G,这恰好与质谱的分子质量792相对应。通过与相关文献[6]报道的penicixanthones G的波谱数据进行比对,最后鉴定化合物1为penicixanthones G。1H NMR(400 MHz,CDCl3)δ:14.02(s,1H),11.76(s,1H),11.73(s,1H),7.41(d,J=2.7 Hz,OH),7.38(d,J=15.0,2.8,0.0 Hz,1H),6.43(d,J=5.0,4.0 Hz,1H),6.41(d,J=4.0 Hz,1H),5.63(s,1H),3.66(s,3H),3.43(s,1H),2.63(d,J=5.0 Hz,1H),1.64(s,3H),1.55(s,3H)。13C NMR(101 MHz,CDCl3)δ:188.2,171.6,171.4,170.1,157.3,140.6,117.5,108.4,106.2,104.5,79.0,72.4,58.9,56.0,52.0,29.2,29.0,28.7,28.6,18.3,18.2。
化合物2呈黄色粉末状,(+)ESI-MS给出分子准离子峰m/z 309.4[M+H]+,639.5[2M+Na]+,推测化合物2的分子质量为308。H谱中存在3个芳香质子δH 7.41、6.48、6.46,同时C谱低场区对应存在6个芳香碳,表明化合物结构中存在1个1,2,3-三取代苯酚。H谱高场区中存在2个甲基信号和3个连氧次甲基信号,且C谱高场区存在6个连氧脂肪碳信号和2个甲基信号,同时其低场区还有1个羰基酮信号,提示该化合物可能是一个多羟基取代蒽酮类化合物。通过查阅文献[6]发现,其波谱数据与penicixanthones A一致,因此将化合物2鉴定为penicixanthones A。1H NMR(400 MHz,CD3OD)δ:
7.41(t,J=8.3 Hz,1H),6.48(d,1H),6.46(d,1H),4.65(d,J=5.1 Hz,1H),4.06(s,1H),3.36(d,1H),
1.54(s,3H),1.48(s,3H)。13C NMR(101 MHz,CD3OD)δ:195.8,164.4,160.0,139.6,110.0,109.3,107.4,82.4,76.2,76.1,68.9,67.4,62.7,59.8,20.8,2 0.5。
化合物3为无色油状物,(+)ESI-MS给出分子准离子峰m/z 253.4[M+H]+,推测化合物3的相对分子质量为252。H谱中显示有4个甲基峰信号,包括2个苯环甲基δH 2.11、2.08和2个脂肪碳甲基δH 1.65、1.15,同时在δH 3.19中还存在1个次甲基信号。C谱中显示6个芳香碳、1个酯羰基、5个脂肪羰和1个连氧基碳。通过查阅文献发现,其与报道的sclerotinin A波谱数据一致,因此将化合物3鉴定为sclerotinin A[7]。1H NMR(400 MHz,CD3OD)δ:3.19(d,J=7.1 Hz,1H),2.11(s,3H),2.08(s,3H),1.65(s,3H),1.15(d,J=6.7 Hz,3H)。13C NMR(101 MHz,CD3OD)δ∶171.7,162.1,161.3,142.3,114.7,110.0,105.6,99.8,40.0,25.7,17.6,10.7,8.2。
化合物4为白色固体,(+)ESI-MS给出分子准离子峰m/z 209.3[M+H]+,推测化合物4的相对分子质量为208。H谱低场区存在一对间位取代的苯环烯H质子信号,高场区有2个甲基(包括1个甲氧基)和1个亚甲基。C谱的6个芳香碳信号与之前的烯H质子信号相对应,暗示存在一个单位取代了苯环,同时C谱中还存在1个酯羰基和4个脂肪羰信号,通过核磁波谱数据比对,鉴定该化合物为6-methoxymellein[8]。1H NMR(400 MHz,CD3OD)δ:6.35(d,J=2.1 Hz,1H),6.24(dd,J=2.1,1.1 Hz,1H),3.82(s,3H),3.38(m,1H),2.72(m,3H),1.85(m,1H),1.41(d,J=6.3 Hz,3H)。13C NMR(101 MHz,CD3OD)δ:167.6,166.4,165.1,145.6,108.4,104.3,99.8,75.5,56.1,37.0,20.8。
2.3讨论
多羟基蒽酮和异香豆素属于一大类含氧杂环化合物,通常具有多种生物学特性,如细胞毒性、抗真菌和抗HIV活性等,并且能够抑制α-葡萄糖苷酶、乙酰胆碱酯酶、HIV逆转录酶等[9]的活性,得到了生物学界和化学界的广泛关注。其中,penicixanthone A(2)的二聚体化合物penicixanthone G(1)对金黄色葡萄球菌和MRSA均表现出了较强的抑菌活性(MIC为0.5μg/mL),表明多羟基蒽酮的二聚化可以很好地提升化合物的活性,为该类化合物的药效研究及药物研发奠定新的基础。
参考文献
[1]朱美林,王皓天.OSMAC方法在微生物次级代谢产物研究中的应用[J].科学技术创新,2020(26):82-83.
[2]陈宁,喻圣凯,刘冰,等.海洋真菌次级代谢产物及其活性研究进展[J].中国公共卫生管理,2019(1):44-47.
[3]BASHYAL BP,WIJERATNE EMK,J T.Chlorinated dehydrocurvularins and alterperylenepoxide a from Alternaria sp.AST0039,a fungal endophyte of astragalus lentiginosus[J].J Nat Prod,2017,80(2):427-433.
[4]MATSUNAGA H,KAMISUKI S,KANEKO M,et al.Isolation and structure of vanitaracin A,a novel anti-hepatitis B virus compound from Talaromyces sp[J].Bioorganic&Medicinal Chemistry Letters,2016,47(4):4325-4328.
[5]WU B,OHLENDORFB,OESKER V,et al.Acetylcholinesterase inhibitors from a marine fungus Talaromyces sp.strain LF458[J].Marine Biotechnology,2015,17(1):1-10.
[6]XUE J,LI H,WU P,et al.Bioactive polyhydroxanthonesfrom Penicillium purpurogenum[J].Journal of Natural Products,2020,83:1480-1487.
[7]NGAN N T T,QUANG T H,KIM K W,et al.Anti-inflammatory effects of secondary metabolites isolated from the marine-derived fungal strain Penicillium sp.SF-5629[J].Archives of Pharmacal Research,2017,40(3):328.
[8]ZHAO M,YUAN L,GUO D,et al.Bioactive halogenated dihydroisocoumarins produced by the endophytic fungus Lachnum palmae isolated from Przewalskia tangutica[J].Phytochemistry,2018,148:97-103.
[9]李姗姗,陈睿轩,王伟毅,等.海洋来源氧杂蒽酮类化合物的生物活性研究进展[J].化工管理,2016(12):74-75.










