高效液相色谱法测定疫苗菌体破碎液中D-核糖的技术研究论文
2024-09-23 16:56:44 来源: 作者:liziwei
摘要:文章以示差折光为检测器,建立高效液相色谱法定量测定疫苗菌体破碎液中D-核糖的方法。该方法的测定条件为:色谱柱为安捷伦ZORBAX NH2氨基色谱柱,流动相为0.005 mol/L的稀硫酸溶液,柱温为50℃,进样量为20μL。D-核糖检测方法保留时间为3.684 min,得到的D-核糖的线性回归方程式为y=194.037 72x+10.834 09,相关性为0.999 99。式中,y为D-核糖的质量浓度;x为对应的峰面积。该方法精密度、稳定性和重现性表现良好,D-核糖的回收率范围为90.2%~102%,灵敏
摘要:文章以示差折光为检测器,建立高效液相色谱法定量测定疫苗菌体破碎液中D-核糖的方法。该方法的测定条件为:色谱柱为安捷伦ZORBAX NH2氨基色谱柱,流动相为0.005 mol/L的稀硫酸溶液,柱温为50℃,进样量为20μL。D-核糖检测方法保留时间为3.684 min,得到的D-核糖的线性回归方程式为y=194.037 72x+10.834 09,相关性为0.999 99。式中,y为D-核糖的质量浓度;x为对应的峰面积。该方法精密度、稳定性和重现性表现良好,D-核糖的回收率范围为90.2%~102%,灵敏度高,能实现目标峰与杂峰的有效分离,因此可被广泛用于疫苗菌体破碎液等样本中D-核糖浓度的测定。
关键词:D-核糖;示差检测器;疫苗菌体破碎液
在疫苗制造和纯化过程中,存在着潜在的宿主细胞DNA残留污染的风险。虽然,目前残余宿主细胞DNA对治疗性蛋白药物的影响尚不清楚,但已有研究表明,宿主细胞DNA可能携带有害的DNA片段,具有潜在的传染性和致瘤性。脱氧核糖核苷酸分子由三个组成部分构成,分别为含氮碱基、脱氧核糖和磷酸。本文主要通过检测疫苗菌体破碎液中D-核糖含量来验证宿主细胞DNA的去除效果。
在利用高效液相色谱法检测核糖时,对色谱柱、检测器等设备有较高的要求,通常需要使用示差折光检测器或蒸发光散射检测器进行检测。这是由于疫苗菌体破碎液的基质复杂,常规处理方法会带来较大的背景干扰。另一种常见方法是通过加入衍生剂生成具有紫外吸收特性的衍生物来进行检测。然而,这种方法比较繁琐,且同时会增加试剂消耗。同时,由于含糖样品的黏度较高,容易造成液质联用仪中色谱柱、喷口及毛细管入口的堵塞,因此,液质联用仪很少用于相关测试。
本文计划首先采用多种沉淀蛋白前处理方法,对前处理过程进行优化,以消除蛋白和肽链的干扰。
其次,通过微孔滤膜过滤,利用高效液相色谱仪结合多种检测器进行测试。通过调整仪器条件和流动相,降低方法检出限,并利用外标法对样品中的糖类杂质进行准确定量;同时,通过使用高效液相色谱仪配备示差折光检测器,建立一种用于疫苗菌体破碎液中D-核糖测定的技术研究方法。最后,研究将评估该方法的实用性和可靠性,包括检出限、定量限、专属性、精密度、回收率和稳定性等。
1材料与方法
1.1仪器与试剂
仪器:Agilent 1260高效液相色谱仪,示差折光检测器、紫外检测器、蒸发光散射检测器;高性能通用台式离心机;KH2-250DB超声波清洗仪;BSA224S-CW电子天平,感量为0.1 mg;BT25S高精密电子天平,感量为0.01 mg。
试剂:本试验所用水均为GB/T 6682规定的一级水;乙腈;丙酮;乙酸锌;亚铁氰化钾;硫酸;D-核糖(C5H10O5,CAS号:50-69-1,纯度≥99%)。
1.2实验方法
1.2.1前处理方法的优化
提取溶剂的选择:应选择去除蛋白质和肽类效果好的溶剂,以减少背景干扰。本实验分别将乙酸锌/亚铁氰化钾、乙腈和丙酮作为提取溶剂。结果显示,在使用乙酸锌/亚铁氰化钾为溶剂时,提取溶液会产生沉淀,且即使在离心过滤后,在色谱仪上仍会出现很强的背景干扰;同时,增加盐浓度会对各组分的分离产生有不利影响。使用丙酮作为提取溶剂时,虽然蛋白沉淀能满足方法的要求,但是丙酮属于易制毒试剂,具有毒性,特别是对神经系统具有麻醉作用,会对人体黏膜产生刺激作用。而使用乙腈作为提取溶剂时,不仅能很好地解决蛋白沉淀的问题,满足实验要求,而且经过后续方法学验证,也能满足实验要求。因此,本实验选择使用乙腈作为研究提取溶剂。
检测器的选择:本实验对高效液相色谱仪的示差折光检测器、紫外检测器和蒸发光散射检测器进行了比较,以确定最适合测定D-核糖的检测器。根据图谱比较结果显示,紫外检测器和蒸发光散射检测器的灵敏度和峰形等方面均未达到实验要求。而当示差折光检测器搭配稀硫酸作为流动相时,表现出了高灵敏度、低噪声和低检出限等优势。因此,本实验选择了差折光检测器作为疫苗菌体破碎液中D-核糖测定技术研究方法的最佳检测器。
综上所述,本实验方法如下。首先,取适量疫苗菌体破碎液;其次,加入2倍体积的乙腈进行混匀后,在超声条件下提取10 min,并以4 000 r/min的速度进行离心5 min,将上清液通过0.22μm的有机滤膜进行过滤,以供后续使用;最后,使用高效液相色谱仪-示差折光检测器进行测定,并进行试样中D-核糖含量的比较分析和重复测定,以完成方法验证。
1.2.2标准曲线的制备
精密称取适量的D-核糖标准品,并将其与乙腈按1∶2的比例配制成1 000μg/mL的标准储备液,以备使用。从标准储备液中分别取0.05 mL、0.1 mL、0.5 mL、1.0 mL、2.5 mL和5.0 mL放入10 mL容量瓶中,并将水和乙腈按1∶2的比例定容稀释,得到5μg/mL,10μg/mL,50μg/mL,100μg/mL,250μg/mL和500μg/mL的标准系列D-核糖溶液,以备测定使用。
1.2.3高效液相色谱条件
检测器:示差折光检测器;色谱柱:经过比较不同型号的色谱柱,考虑到较好的分离度和性价比,选择使用安捷伦ZORBAX NH2氨基色谱柱,其柱长250 mm,内径4.6 mm,膜厚5μm;流动相:经过试验选择0.005 mol/L稀硫酸溶液作为流动相;流速:设定为1.0 mL/min;柱温:保持在50℃。
1.2.4结果计算分析
试样中目标物含量按照下式计算,结果以平均值表示如下。
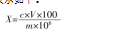
式中:X为样品中目标物含量,单位为%;c为样品上机液质量浓度,单位为μg/mL;V为定容体积,单位为mL;m为样品质量,单位为g;100、106为单位换算系数。
2结果
2.1高效液相色谱条件优化
采用以上样品的前处理方法和色谱条件,确定D-核糖在高效液相色谱洗脱过程中的保留时间。在此条件下,D-核糖色谱峰能得到有效分离,图谱峰形尖锐,无拖尾,无溶剂效应,保留时间为3.684 min,具体如图1所示。
2.2标准曲线测定
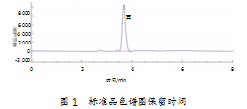
研究采用优化的仪器工作参数设定,对实验所使用的一系列标准溶液中的D-核糖含量进行分析。以浓度为横坐标、峰面积为纵坐标,绘制标准曲线,经过拟合得到二元一次线性方程。研究发现,在浓度范围为5~500μg/mL内,线性回归方程为y=194.037 72x+10.834 09,相关性为0.999 99,表明浓度和峰面积呈良好线性关系。具体数据如图2所示。
2.3专属性试验
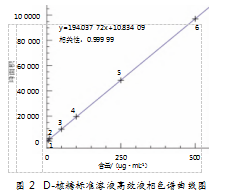
将空白溶液、D-核糖标准溶液以及待测样品溶液各进行一次进样,并在相同条件下对这3种溶液进行分析,以确保各潜在杂质间、杂质与主峰间,以及杂质与溶剂间不存在相互干扰。研究发现,D-核糖保留时间为3.684 min;待测样品溶液在相同位置没有观察到干扰峰;而空白溶液也不含干扰峰。结果表明,该分析方法的专属性良好。3种溶液的D-核糖色谱图具体如图3所示。
2.4检出限和定量限
第一,检出限溶液配制。取0.05 mL标准储备液(D-核糖,1 000μg/mL)于10 mL容量瓶中,加乙腈水溶液稀释定容,摇匀,待测。第二,定量限溶液配制。取0.10 mL标准储备液(D-核糖,1 000μg/mL)于10 mL容量瓶中,加乙腈水溶液稀释定容,摇匀,待测。以3倍信噪比确定方法的检出限,以10倍信噪比确定方法的定量限。结果表明,本方法中5μg/mL的信噪比为97.7;10μg/mL的信噪比为186.5。故本试验D-核糖的检出限为5μg/mL,定量限为10μg/mL,符合方法测定要求。
2.5精密度试验
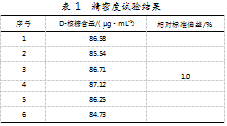
平行量取6份样品溶液,加入2倍体积的乙腈,超声提取10 min,4 000 r/min离心5 min,上清液经0.22μm有机滤膜过滤后,供高效液相色谱仪在相同色谱条件下测定,得到本方法的精密度。记录D-核糖含量和相对标准偏差,结果如表1所示。数据显示,相对标准偏差(SRSD,n=6)小于10%,说明该方法的重复性良好,精密度高可以满足分析要求。
2.6加标回收试验
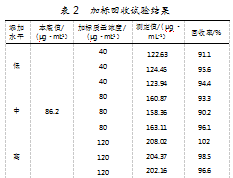
向样品溶液中加入D-核糖标准储备液,进行加标回收率实验,实际添加水平分别为疫苗菌体破碎液中D-核糖本底值的0.5倍、1倍和1.5倍,且每个水平重复测定三次。结果显示,D-核糖在3个添加水平下,回收率范围为90.2%~102%,说明本试验方法的准确度较高,可满足要求。各添加水平下的加标回收试验结果具体如表2所示。
2.7稳定性试验
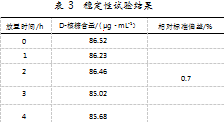
为验证菌体破碎液中D-核糖的稳定性,将5份试样溶液在室温下分别放置0 h、1 h、2 h、3 h、4 h后,在相同色谱条件下,测定其峰面积,并根据相应的线性回归方程计算出样品溶液中D-核糖的质量浓度。结果显示,D-核糖含量的相对标准偏差(SRSD)为0.7%,表明试样溶液在4 h内的稳定性良好。稳定性试验结果具体如表3所示。
3结果
本文的创新点在于以示差折光检测器建立了高效液相色谱法定量检测疫苗菌体破碎液中D-核糖的方法。该方法简便、准确、灵敏度高,稳定性和重现性良好;样品前处理方法简单,既节省试剂消耗,又节约检测时间,有助于提高工作效率;同时,所采用的色谱条件可显著减少D-核糖检测的背景干扰。综上,该方法为检测疫苗菌体破碎液中的核糖含量,验证宿主细胞DNA的去除效果提供了技术支持。
参考文献
[1]闫璐瑶,张家友,张青梅,等.宿主细胞残留DNA片段大小分布检测方法的建立及验证[J].中国生物制品学杂志,2021,34(3):335-339,348.
[2]国家药典委员会.2010年版中华人民共和国药典(第1部)[M].北京:中国医药科技出版社,2010.
[3]王亚坤,孙文敬,秦丽,等.D-核糖功能与应用研究进展[J].食品科学,2005(8):486-489.
[4]张泽虹,侯坤,张卿,等.高效液相色谱法测定体液及组织样本中D-核糖浓度[J].中国卫生检验杂志,2022,32
(15):1793-1795+1815.[5]YAQI C,JINGSHEN L,YALI S,et al.Determination of several sugars in serum by high-performance anion-exchange chromatography with pulsed amperometric detection[J].Journal of Chromatography.A,2005,1085(1):98-103.
[6]曾森,刘虹,张德芹,等.桑叶多糖提纯工艺及质量控制研究[J].时珍国医国药,2011,22(12):2892-2893.










