复合益生菌抗氧化和免疫增强作用的研究论文
2024-09-20 12:00:34 来源: 作者:dingchenxi
摘要:文章旨在深入探究复合益生菌对动物在抗氧化和免疫增强方面的影响。具体而言,文章首先对SPF级小鼠进行灌胃处理,然后检测小鼠的血清生化指标、抗氧化能力及免疫性能等,
摘要:文章旨在深入探究复合益生菌对动物在抗氧化和免疫增强方面的影响。具体而言,文章首先对SPF级小鼠进行灌胃处理,然后检测小鼠的血清生化指标、抗氧化能力及免疫性能等,并将复合益生菌作为饲料添加剂应用于奶牛的生产养殖过程中,对奶牛血清的各项生理指标展开检测试验。研究结果表明,复合益生菌的应用显著降低了免疫低下小鼠的谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、肌酐(creatinine,CREA)、尿素(UREA)的生化指标含量(P<0.05),显著提高了小鼠的脾脏指数和胸腺指数(P<0.05);用添加复合益生菌的饲料饲喂奶牛后,除甘油三酯,高密度脂蛋白、低密度脂蛋白、葡萄糖、总蛋白、白蛋白和胆固醇等的含量均显著升高(P<0.05),奶牛血清中IgA、IgG、IgM免疫指标均显著升高(P<0.05),促炎因子TNF-α显著下降(P<0.05),血清中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)指标均显著升高(P<0.05),丙二醛(MDA)含量显著降低(P<0.05)。小鼠和奶牛试验共同证明,复合益生菌制剂能够改善动物的机体健康水平,具体表现为血清生化指标在正常范围内有所提高,机体抗氧化能力提升,免疫力增强。
关键词:复合益生菌;血清生化指标;抗氧化;免疫性能
复合益生菌作为饲料添加剂,对动物机体的血清生化指标、抗氧化、免疫性能等具有重要影响。在动物饲养生产过程中饲喂复合益生菌,对提高动物生产性能和养殖经济效益具有积极的指导作用[1-3]。掌握调节消化道内微生物短期和长期定植的原理,对于使用有益微生物改善宿主的生命质量至关重要[4-5]。通过维持肠道微生物平衡、防止致病菌群建立[6]、激活关键生存途径,以及刺激上皮细胞的免疫系统,可减少病原体定植[7]。对此,可采用以下两种方法,其一是使用被称为益生菌的活性微生物,当该物质达到足够量时,就会对宿主产生有益作用[8-9]。益生菌在宿主肠道内生长繁殖的过程中会与病菌、病毒等争夺生存资源[10],同时其代谢产物可有效抑制病毒、病菌等的生长繁殖[11],从而降低宿主的患病率和发病率[12]。其二是通过施用抗生素、药物等杀死病原微生物。然而,抗菌剂对益于胃肠道的微生物群具有负面影响,并且乳制品和肉制品中抗菌剂残留超标[13],不利于养殖业的长远发展。此外,现有研究表明,单一益生菌对动物各方面生产性能的影响远不及复合益生菌[14-16]。
免疫力直接决定着机体的生产性能及健康状态[17-18]。动物血清中各成分的生化指标可以直观反映动物的健康状况。而复合益生菌及其代谢产物作为良好的免疫激活剂,可有效刺激机体免疫系统,提高其抗体水平和巨噬细胞活性。血清中的超氧化物歧化酶、谷胱甘肽过氧化物和过氧化氢酶等的含量能够反映机体的抗氧化能力[19]。细胞膜脂质氧化会产生丙二醛,而机体脂质受活性氧自由基攻击的损害程度可以通过检测丙二醛的含量来确定[20]。免疫器官脾指数和胸腺指数主要反映免疫细胞的功能和免疫器官的发育情况,可用于衡量机体免疫功能[21]。免疫球蛋白作为具备抗体活性的动物蛋白质,具有抗菌、抗病毒等多种功能[22],而检测动物血清中的免疫相关蛋白、因子等的含量,可以评价机体健康状态[23-24]。然而,目前关于复合益生菌在模式生物小鼠血清生化指标、免疫性能、抗氧化性能等方面的研究甚少,通过模式生物研究复合益生菌对机体的具体影响并将其应用于奶牛饲养中的试验更是少之又少,且缺乏有效的研究数据。因此,本文通过小鼠和奶牛试验,共同探究复合益生菌制剂对动物机体血清生化指标、抗氧化能力、免疫力等的影响,以评估复合益生菌作为饲料添加剂的有益作用,从而为畜牧业生产健康饲料提供有效、可靠的参考。
1材料与方法
1.1试验材料
雄性SPF级小鼠60只,6~8周龄,体重18~22 g(南京麦瑞斯生物科技有限公司提供);胎次、体重各方面生理指标,以及健康状态相近的中国荷斯坦奶牛60头(青岛绿草源牧场);复合益生菌(植物乳杆菌、枯草芽孢杆菌、丁酸梭菌)(山东健源生物科技有限公司提供,活菌数8.0×109 CFU/g)。所有动物实验均严格按照《实验动物护理和使用指南》进行操作。
1.2试验设计
1.2.1小鼠试验
SPF级雄性小鼠60只,适应性饲养1周后,随机选取20只小鼠作为正常组继续饲养,其余40只小鼠连续3 d腹腔注射环磷酰胺(60 mg/kg)[25],摄食和饮水维持正常水平,建立免疫功能受损模型。以出现身体消瘦、脱毛量大、嗜睡等症状的小鼠作为成功造模的标准。造模成功后,将40只小鼠随机分为免疫功能低下模型组和复合益生菌治疗组,每组各20只。实验期间,小鼠可以自由进食和活动。复合益生菌治疗组:复合益生菌制剂1 g加生理盐水1 g复配,每天灌胃1次,连用28 d。实验完成后,小鼠禁食12 h,对各组小鼠进行眼球采血,静置2 h,12 000 r/min条件下离心15 min后,取出上清液,放置在4℃的环境中保存备用。为获取小鼠的脾脏和胸腺,采用颈椎脱臼法处死小鼠,并在超净工作台中解剖,用生理盐水洗去器官表面的血污后予以称重记录。按照下式计算免疫脏器指数。
IOI=胸腺或脾脏重量(mg)/体重(g)[26]
1.2.2奶牛试验
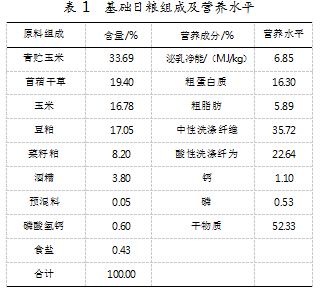
选用胎次、体重各方面生理指标及健康状况均相近的中国荷斯坦奶牛60头,随机分为4组。将其基础日粮中分别添加5、10、15 g/kg量复合益生菌进行饲喂的奶牛作为试验组,以仅用基础日粮饲喂的奶牛为对照组,每组设置3个重复试验,每个重复试验5头,并分别在每日07:30和16:30进行颈枷控制单槽饲喂,试验期67 d,预饲期7 d。试验期间,每20 d采集1次血样,于晨饲前对每头牛经尾静脉取血10 mL至真空血清管中,在25℃、3 500 r/min条件下离心15 min,采集血清至1.5 mL微管中,-20℃保存备用。基础日粮组成和营养水平如表1所示。
1.3指标测定及方法
用全自动生化分析仪测定小鼠血清中的谷丙转氨酶(ALT)、谷草转氨酶(AST)、肌酐(CRea)、尿素(UREA)指标,并测定奶牛血清中的高密度脂蛋白、低密度脂蛋白、葡萄糖、总蛋白、白蛋白、甘油三酯和胆固醇等指标[27]。通过免疫脏器指数反映小鼠免疫性能的变化;用IgA、IgG、IgM[9]和TNF-α的含量反映奶牛的机体免疫指数。使用ELISA酶联免疫法(南京建成生物工程研究所)测定超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)活性、丙二醛(MDA)等的含量,以及总抗氧化能力(T-AOC)。
1.4统计分析
使用Excel 2022软件对试验原始数据进行初步记录整理,运用SPSS22.0进行单因素方差分析,采用Duncan’s法进行多重比较,P<0.05表明组间差异显著,结果用“平均值±标准误”表示。
2结果与分析
2.1复合益生菌对小鼠血清生化指标的影响
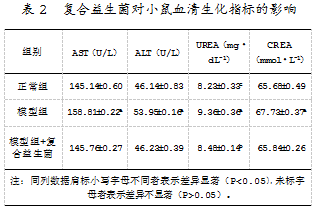
研究发现,模型组小鼠的血清生化指标证明免疫低下模型建立成功;复合益生菌灌服小鼠的AST(U/L)、ALT(U/L)、CREA(mmol/L)、UREA(mg/dL)指标与免疫低下模型小鼠相比显著降低(P<0.05),与正常组小鼠相比无显著差异。由此可见,复合益生菌能够显著改善小鼠机体的健康状态,增强小鼠的免疫力,促使免疫低下小鼠恢复健康状态。复合益生菌影响小鼠血清生化指标的具体结果如表2所示。
2.2复合益生菌对小鼠免疫器官指数的影响
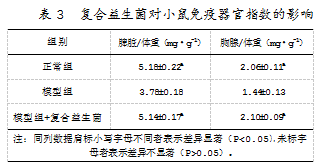
研究发现,相较于模型组小鼠,复合益生菌能使免疫功能低下小鼠的脾脏指数(mg/g)和胸腺指数(mg/g)显著升高(P<0.05),并达到正常小鼠的免疫器官指数。由此可见,复合益生菌具有增强小鼠免疫功能的作用。复合益生菌对小鼠免疫器官的具体影响如表3所示。
2.3复合益生菌对小鼠抗氧化作用
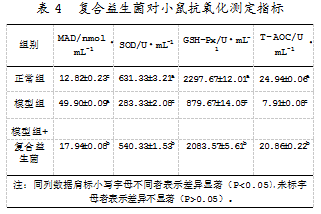
研究发现,模型组的MAD含量显著高于正常组和复合益生菌添加组;模型组的SOD、GSH-Px、T-AOC含量显著低于正常组和复合益生菌添加组(P<0.05)。该指标变化证明免疫低下小鼠模型已建立成功,复合益生菌能显著改善小鼠机体的健康状态,增强小鼠的抗氧化能力。复合益生菌影响小鼠抗氧化能力的具体结果如表4所示。
2.4奶牛饲粮中添加复合益生菌后血清生化指标的变化
研究发现,在饲粮中添加有复合益生菌制剂的奶牛的血清中,除甘油三酯,其他成分的生化指标含量均显著高于对照组(P<0.05)。同时,在合理范围内,复合益生菌添加剂量与机体各方面生理指标的变化成正比。复合益生菌影响奶牛血清生化指标的具体结果如表5所示。
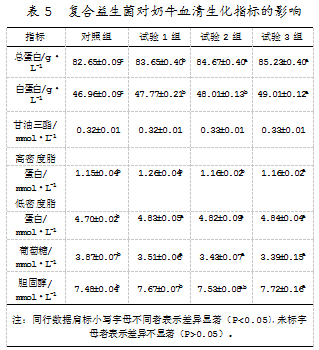
2.5奶牛饲粮中添加复合益生菌后免疫指标的变化
研究表明,在饲粮中添加有复合益生菌制剂的奶牛的血清中,IgG、IgA、IgM的含量均显著升高(P<0.05),而促炎因子TNF-α的含量则显著下降(P<0.05)。该结果表明,相比于其他免疫蛋白水平的变化,IgG蛋白含量的变化在复合益生菌高剂量试验组效果显著。复合益生菌对奶牛血清免疫指标的具体影响如表6所示。
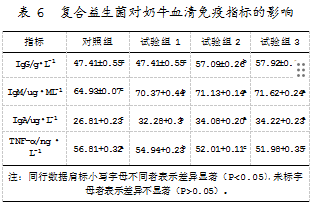
2.6奶牛饲粮中添加复合益生菌对血清抗氧化指标的影响
数据显示,在饲粮中添加有复合益生菌制剂的奶牛的血清中,过氧化氢酶、超氧化物歧化酶、谷胱甘肽过氧化物酶的含量均显著升高(P<0.05),丙二醛含量则显著降低(P<0.05)。同时,低剂量复合益生菌的使用,能够显著提升机体的抗氧化水平。复合益生菌对奶牛血清抗氧化指标的具体影响如表7所示。
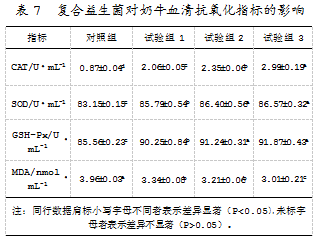
3讨论
在灌服复合益生菌模型组小鼠的血清中,UREA、MAD、SOD、GSH-Px、T-AOC等数值均介于免疫低下组和正常组小鼠的生理指标之间,且更接近正常小鼠的健康指标[28]。复合益生菌未能使免疫低下的小鼠完全恢复至正常组小鼠的健康状态,可能与益生菌灌服周期较短有关,也可能是因为模型组小鼠的健康方面存在不可逆损伤[29],无法完全恢复至正常组小鼠的生理健康水平。奶牛试验中,饲喂复合益生菌在显著提高奶牛血清总蛋白含量的同时,也能提升其胆固醇含量(P<0.05),可能是由于参与胆固醇稳态的关键酶和分子与骨形成具有密切关联[30-31],添加复合益生菌制剂可以满足奶牛在健康状态下快速生长时对胆固醇的需求。
肿瘤细胞因子在抗肿瘤、免疫防御和炎症反应等方面起着重要作用,而TNF-α在炎症、免疫系统发育、细胞凋亡和脂质代谢中发挥着核心作用[32],对某些非肿瘤细胞和大多数肿瘤细胞具有诱导凋亡的作用。复合益生菌饲喂的奶牛血清的TNF-α含量显著下降(P<0.05),可能是因为其对免疫细胞活化、促增殖和促分化等具有促进作用[9],有助于减轻机体的炎症反应,维持机体免疫平衡。
付晓政等[33]每日给对照组不饲喂益生菌,给低剂量和高剂量益生菌组分别一次性饲喂50、100 mL/(头·d)由酵母、乳酸菌和芽孢杆菌组成的复合益生菌溶液。实验结果表明,高剂量益生菌组奶牛血清MDA含量显著降低,CAT活性显著升高。虽与本试验构成复合益生菌制剂所用的微生物种类不同,但结论与本研究完全一致。臧长江等[20]报道,奶牛血清中超氧化物歧化酶的活性可以通过饲喂复合益生菌显著提高,而丙二醛含量降低,但谷胱甘肽过氧化物酶无显著变化。这一结果表明,随着益生菌添加量的增加,谷胱甘肽过氧化物酶和过氧化氢酶活性会升高,丙二醛含量会降低。奶牛和小鼠的试验证明,益生菌对动物机体抗氧化具有积极作用,这与臧长江[20]的研究结果基本一致。
4结论
与免疫低下组的小鼠相比,复合益生菌灌服小鼠血清的AST、ALT、CREA指标均显著下降(P<0.05),且与正常组小鼠生理指标无显著差异;复合益生菌灌服小鼠的UREA指标介于免疫低下组和正常组小鼠生理指标之间,且更接近正常小鼠的健康指标。与免疫低下组小鼠相比,复合益生菌灌服小鼠的免疫器官胸腺指数和脾脏指数均显著升高(P<0.05),且与正常组小鼠的生理指标无显著差异,可达到正常组小鼠的免疫器官指数;复合益生菌灌服小鼠血清中的MAD含量显著低于模型组(P<0.05),SOD、GSH-Px、T-AOC含量均显著高于模型组(P<0.05),同时其含量显著低于正常组小鼠指标(P<0.05),达到正常小鼠的生理指标。综上所述,利用复合益生菌灌服小鼠,有助于改善小鼠的血清生化指标,提高机体免疫力和抗氧化能力,但短期内并不能使免疫低下模型组的小鼠完全恢复到正常状态。
用复合益生菌制剂饲喂奶牛,其血清中甘油三脂指标不受影响,总蛋白含量显著高于对照组(P<0.05),且在合理范围内,复合益生菌添加剂量与机体各生理指标的变化情况成正比。在免疫性能方面,与对照组相比,饲喂复合益生菌的各试验组奶牛血清中的IgG、IgM、IgA含量均显著升高(P<0.05),而TNF-α作为促炎因子含量显著下降(P<0.05)。在抗氧化能力方面,奶牛血清中过氧化氢酶、谷胱甘肽过氧化物酶、超氧化物歧化酶的含量显著升高(P<0.05),丙二醛含量显著下降(P<0.05)。综上所述,复合益生菌作为饲料添加剂可显著改善奶牛的生理健康状况,提升奶牛机体各方面的健康指标。
参考文献
[1]崔玉革,李玉青.复合益生菌与黄芪多糖对断奶仔猪生长性能、免疫功能、血清生化指标及腹泻率的影响[J].饲料研究,2022,45(6):26-29.
[2]李政.复合益生菌对哺乳期犊牛生长性能和肠道健康的影响[D].广州:华南农业大学,2020.
[3]钟晓霞,黄健,刘志云,等.甘露寡糖和复合益生菌对断奶仔猪生长性能及肠道形态结构、挥发性脂肪酸含量和菌群结构的影响[J].动物营养学报,2020,32(7):3099-3108.
[4]王庆凤,米金秋,马秋刚,等.微生物群落定植规律及其对产蛋鸡内分泌和生殖健康的影响[J].动物营养学报,2023,35(7):4148-4158
[5]金旭,吴琼,李祯,等.益生菌与酸化剂联用对肉鸡生长性能、抗氧化能力和肠道健康的影响[J].动物营养学报,2023,35(12):7759-7773.
[6]赵德辉,张海华,王金铭,等.益生菌维护肠道健康及抗病毒作用研究进展[J].中国畜牧兽医,2022,49(11):4252-4260.
[7]伍婷.肠道菌群代谢产物SCFAs通过LAMTOR2调控巨噬细胞固有免疫介导杀菌作用及分子机制研究[D].合肥:安徽医科大学,2020.
[8]李修宇.日粮中添加益生菌对灵山土鸡生长性能、血液指标、肠道形态和盲肠菌群的影响[D].南宁:广西大学,2021.
[9]FU L L,XIE M H,WANG C,et al.Lactobacillus casei Zhang alleviates shrimp tropomyosin-induced food allergy by switching antibody isotypes through the NF-KB-dependent immune tolerance[J].Mol Nutr Food Res,2020,64(10):1900496.
[10]ANEE I J,ALAM S,BEGUM R A,et al.The role of probiotics on animal health and nutrition[J].The Journal of Basic and Applied Zoology,2021,82(1):1-16.
[11]DING S,YAN W,MA Y,et al.The impact of probiotics on gut health via alternation of immune status of monogastric animals[J].Animal Nutrition,2021,7(1):24-30.
[12]YANG W K,YUAN W J,PENG X H,et al.PPARγ/Nnat/NF-κB axis involved in promoting effects of adiponectin on preadipocyte differentiation[J].Mediators of Inflammation,2019,56:18023.
[13]陶利明,徐明芳,陈枫,等.乳与乳制品中抗生素残留危害及治理对策[J].现代农业科技,2011(11):362-363.
[14]王永芬,赵志军,席磊,等.单一菌种与复合菌种益生菌制剂对蛋鸡生产效果研究[J].中国畜牧兽医,2011,38(11):28-32.
[15]陈培炼.益生菌对肠道菌群的作用及其在畜禽生产中的应用[J].湖南饲料,2019(2):23-26.
[16]张春垒,蒙洪娇,吴黎,等.益生菌在畜禽养殖中的应用及其作用机制[J].饲料博览,2018(7):16-18,21.
[17]M A E,BAHAA F,M N M,et al.Growth performance,digestive function,thyroid activity,and immunity of growing rabbits fed olive cake with or without Saccharomyces Cerevisiae or citric acid.[J].Tropical Animal Health and Production,2023,55(6):376.
[18]GUO Q Y,HU R Y,LIU R S,et al.Effects of the oat hay feeding method and compound probiotic supplementation on the growth,antioxidant capacity,immunity,and rumen bacteria community of dairy calves[J].Antioxidants,2023,12(10).
[19]JIN L H,BAHN J H,EUM W S,et al.Transduction of human catalase mediated by an HIV-1TAT protein basic domain and arginine-rich peptides into mammalian cells[J].Free Radical Biol Med,2001,31(11):1509-1519.
[20]臧长江,王加启,卜登攀,等.复合微生物对奶牛生产性能及血液生化指标的影响[J].家畜生态学报,2009,30(2):45-50.
[21]檀新珠,吴晓晴,吕明其,等.太子参茎叶多糖对小鼠免疫器官指数和血清免疫球蛋白、补体含量的影响[J].福建农林大学学报(自然科学版),2017,46(5):590-594.
[22]李慧梅,许奎,刘瑞生,等.复合微生物制剂对肉羊生长性能、血清生化指标和免疫功能影响[J].现代畜牧兽医,2023(9):41-44.
[23]马旭东,刘显军,陈静,等.菌酶协同发酵绵马贯众对断奶仔猪生长性能、血清生化指标和抗氧化能力的影响[J].动物营养学报,2023,35(12):7691-7701.
[24]林苗,肖亚红,张谚鹏,等.复合酸对肉鸡生长性能、屠宰性能、血清免疫指标及盲肠菌群结构的影响[J].动物营养学报,2023,35(11):7024-7035.
[25]骆新,王忠,朱虎虎,等.桑葚多糖对环磷酰胺诱导小鼠免疫功能低下的调节作用[J].新疆医科大学学报,2018,41(1):75-78.
[26]SIMPSON MA,GOZZO J J.Spectrophotometric determination of lymphocyte mediated sheep red blood cell hemolysis in vitro[J].JImmunol Methods,1978,21:159.
[27]张娟,陈坚.益生菌功能开发及其应用性能强化[J].科学通报,2019,64(3):246-259.
[28]李玟玟,马微微,马青,等.复合益生菌对免疫低下模型小鼠的保护作用[J].中国食品学报,2023,23(8):124-131.
[29]杨杨,李根,马婧威,等.四种环磷酰胺诱导免疫抑制小鼠模型的对比研究[J].实验动物科学,2023,40(2):1-9.
[30]龙晓文,王秋举,汉雪梅,等.豆粕基础饲料中添加胆固醇促进鱼类生长机理的研究进展[J].安徽农业科学,2013,41(7):2954-2955.










