高中化学教学中建模思想的应用—以“化学反应原理”教学为例论文
2024-03-26 10:52:14 来源: 作者:heting
摘要:“化学反应原理”是高中化学的重要构成部分.教学实践中结合该部分内容特点,应用建模思想展开教学,将相关知识统一到模型之中,使学生对所学知识的理解提升到一个新的高度.
摘要:“化学反应原理”是高中化学的重要构成部分.教学实践中结合该部分内容特点,应用建模思想展开教学,将相关知识统一到模型之中,使学生对所学知识的理解提升到一个新的高度.
关键词:建模思想,应用,化学反应原理,高中化学
1原电池与电解池教学的实施
1.1原电池
环节一:回顾所学,激发兴趣.
学生已学习过原电池相关知识.为驱使其更加深度地理解与掌握原电池的工作原理,为原电池模型构建奠定基础.课堂上运用多媒体屏幕展示以下问题:铜锌原电池有哪几部分构成、写出电极反应式和电极总反应式.
学生通过回顾所学,得出铜锌电池装置主要有:锌片、铜片、硫酸溶液、导线构成.正负极对应的电极反应分别为:
2H++2e-==H2↑Zn-2e-==Zn2+总电极反应为Zn+2H+==2Zn2++H2↑
引导学生回顾所学,给学生带来似曾相识的感觉,激发起学习兴趣,增强学习自信心.
环节二:借助实验深化理解.实验1:将适量锌粉加入到盛放有30 mL 1 mol/L C uSO4溶液的烧杯中,使用温度计测量溶液温度,观察温度变化;实验2:向甲、乙两只烧杯中分别加入30 mL 1 mol/L ZnSO4溶液和30 mL 1 mol/L C uSO4溶液,使用导线将电流计、锌片、铜片连接在一起,分别插入到甲、乙两个烧杯中,并将盐桥两端分别插入两只烧杯的电解溶液中,观察现象,取出盐桥再观察现象.
课堂上进行上述两个实验的展示,给学生带来原电池的直观认识,增加课堂教学趣味性,促进学生透过现象看本质逐渐向构建原电池模型靠拢[1].

环节三:借助互动构建模型.
基于对上述实验现象的观察,课堂上围绕以下问题与学生积极互动,帮助其建立原电池模型.
(1)两个实验分别有什么现象?为什么会出现有关现象?(2)联系已学的原电池知识分析实验2中电极名称,写出对应电极的电极反应以及对应的反应类型.(3)实验2中的盐桥有什么作用?
课堂上学生通过思考讨论认识到了原电池是一种将化学能转化为电能的装置.实验2中锌片为负极,失去电子发生氧化反应,电极反应为Zn-2e-==Zn2+;铜片为正极,C u2+得到电子发生还原反应,电极反应为,C u2++2e-==C u.盐桥中的Cl-和K+分别移向ZnSO4溶液、C uSO4溶液,保持溶液电中性,使得反应能够持续进行.在此基础上要求学生构建原电池模型.学生结合从实验中获得的结论,构建图1所示的原电池模型.环节四:设计问题,夯实模型.
为夯实学生所学,提高其运用原电池模型解题的灵活性,课堂上创设以下问题,要求学生思考、作答:如图2为从含碘的物质中提取碘的两个装置,则以下说法正确的是().

A.两个装置中,石墨Ⅰ和石墨Ⅲ均为负极
B.石墨Ⅲ的电极反应为2H2 O-4 e-==O2↑+4H+
C.放电过程中MnO2电极质量不变
D.两个装置中生成等量的I2,导线上通过的电子数之比为5∶1
基于原电池模型可知两个装置中I-→I2,IO3-→I2,则石墨Ⅰ和石墨Ⅲ均为负极;石墨Ⅲ的电极反应为HSO3--2e-+H2 O==SO-+3H+;放电过程中MnO2为正极转化为Mn2+电极质量减轻;两个生成等量的I2,由电子转移数目可知,导线上通过的电子数之比应为1∶5.选择A项.
1.2电解池
首先,组织学生开展自主学习活动,要求学生学习课本中电解熔融态氯化钠相关知识,分析电子移动方向,写出对应的电极反应方程式.同时,为巩固学生所学,课堂上提问如下问题:(1)什么是电解,什么是电解池?(2)电解池中能量转化是怎样的?(3)电解池中与电池正、负极相连的电极名称分别是什么?发生什么样的反应类型?认真倾听学生回答,并给予指引,纠正学生的错误认识,进一步澄清其对电解池的认识,并指引学生构建如图3所示的电解池模型.

其次,为进一步深化学生对电解池模型理解,掌握离子的放电规则.课堂上为学生播放“电解氯化铜溶液”教学视频,使学生思考,在阴极为什么在C u2+、H+都存在的情况下Cu2+先放电,在阳极OH-、Cl-都存在的情况下Cl-先放电?显然同一电极存在多种可以放电的离子时放电顺序按照能力由强到弱依次进行.同时,给予学生指引,使其总结电解池电极反应顺序,补充、完善上述电解池模型.最后,为巩固学生所学,提高运用电解池模型解题的意识与能力,设计相关问题开展针对性的应用训练活动.答案选择A项.
2化学平衡移动教学的实施
2.1浓度变化引起的平衡移动
C r2 O-(橙色)+H2 O这一可逆反应,做如下两个实验:实验1,向试管先加入4 mL 0.1 mol/L的K2 C rO4溶液,在向其中滴加数滴1 mol/L的HNO3溶液.观察溶液颜色变化;实验2,将实验1中的溶液分成两份,向其中一份中加入1 mol/L的NaOH溶液,和另一份溶液做对比,观察溶液颜色变化.
提出以下问题要求学生思考:实验1中滴加HNO 3溶液中时溶液中H+浓度怎样变化?溶液颜色发生怎样的变化?反应怎样移动?实验2中加入NaOH溶液后溶液中H+浓度怎样变化?反应怎样移动?从上述两个实验中得出什么结论?
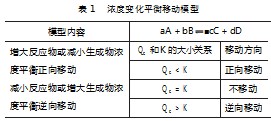
从实验现象来看,实验1溶液橙色加深,实验2黄色加深.表明加入对应溶液后平衡分别向正向与逆向移动.引起实验中现象的原因在于溶液中H+浓度的增加,以及H+和OH-反应后H+浓度减小.在此基础上要求学生阅读课本内容,结合浓度商和平衡常关系构建对应模型.最终构建表1所列的模型.
2.2压强变化引起的平衡移动
为使学生更好地理解压强变化给化学平衡带来的影响,建立对应的平衡移动模型.教学实践中,一方面,使用多媒体屏幕展示以下三个可逆反应:
①N2(g)+3H2(g)■2NH3(g)
②N2 O4(g)■2NO2(g)
③Fe O(s)+CO(g)■Fe(s)+CO2(g)
要求学生联系物质浓度与压强之间的关系,探究增大和减小压强,给化学平衡带来的影响[2].另一方面,播放课本中“利用色度传感器探究压强对化学平衡的影响”教学视频,要求学生分析教学视频中相关现象发生的内在原因.
对同一有气体参与的反应而言,增大压强等效于减小体积,而减小体积对应物质浓度的增大.但是化学反应前后气体分子数目不同,对相关物质浓度改变的大小是不同的,因此,分析化学平衡需将化学反应前后气体分子数目的变化考虑在内.气体分子数目增大的反应,增大压强平衡逆向移动;气体分子数目不变的反应增大压强平衡不移动;气体分子数目减小的反应,增大压强平衡正向移动.教学视频中的现象,很好地印证了上述结论.
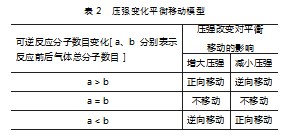
在学生搞清楚上述内容后,在课堂上与学生一起构建表2所列压强变化平衡移动模型.
2.3温度变化引起的平衡移动
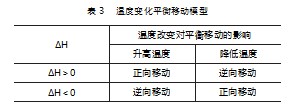
完成上述两个模型构建后,学生已积累相关平衡移动模型构建经验.教学活动中基于以下可逆反应:[Co(H2 O)6]2+(粉红色)+4Cl-■[Co Cl4]2+(蓝色)+6H2 O,ΔH>0.做如下实验:向一支试管中加入少量氯化钴晶体,而后逐滴加入浓盐酸溶解完全后,滴水至溶液呈紫色.而后将溶液分装到A、B、C三支试管中,将其分别置于热水、冰水和常温条件下,观察实验现象,分析实验结论.预留空白时间,要求学生基于对实验的认识与理解构建对应模型.同时,提问学生代表,了解其模型构建情况,并根据其构建模型情况给予指引与表扬,提升其学习体验,促使其进一步完善模型,最终构建出表3所列正确模型.
参考文献:
[1]岳沭宁.关于高中“化学反应原理”建模教学的实践[J].数理化解题研究,2022(15):122-124.
[2]袁琼玲.高中化学反应原理教学中问题推进教学的实践探析[J].高考,2021(29):61-62.










