白细胞介素6在腰椎间盘突出症中的研究论文
2025-01-23 13:55:35 来源: 作者:liziwei
摘要:白细胞介素6(interleukin 6,IL-6)是最常见的炎症因子,具有抗炎和促炎的双向性,在炎症反应中发挥着巨大的作用。故其在炎症反应性疾病中具有高表达的特性,腰椎间盘突出可导致局部的炎症反应,造成IL-6的高表达,而IL-6等炎性细胞因子的高表达可导致痛觉过敏,从而导致椎间盘源性腰痛和神经根疼痛的发生。目前已经有研究提示阻断IL-6/IL-6R轴可以有效的治疗炎症相关的自身免疫性疾病,希望通过干预IL-6的反应过程,阻断局部的炎症反应,有效治疗盘源性腰痛和神经根痛。本文综述了IL-6的炎症反应机制
[摘要]白细胞介素6(interleukin 6,IL-6)是最常见的炎症因子,具有抗炎和促炎的双向性,在炎症反应中发挥着巨大的作用。故其在炎症反应性疾病中具有高表达的特性,腰椎间盘突出可导致局部的炎症反应,造成IL-6的高表达,而IL-6等炎性细胞因子的高表达可导致痛觉过敏,从而导致椎间盘源性腰痛和神经根疼痛的发生。目前已经有研究提示阻断IL-6/IL-6R轴可以有效的治疗炎症相关的自身免疫性疾病,希望通过干预IL-6的反应过程,阻断局部的炎症反应,有效治疗盘源性腰痛和神经根痛。本文综述了IL-6的炎症反应机制以及对腰椎间盘突出的影响,期以提供腰椎间盘突出靶向药物治疗的部分依据。
[关键词]白细胞介素6;炎症反应;腰椎间盘突出;机制;靶向药物
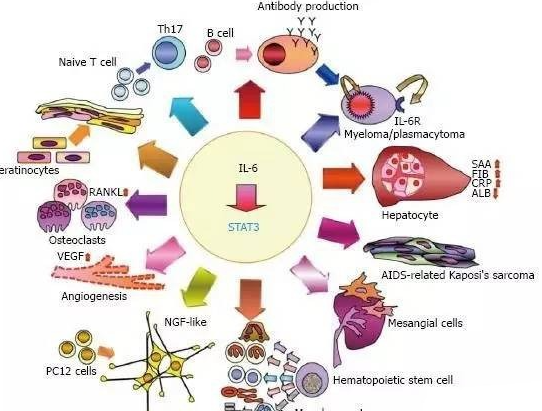
白细胞介素6(interleukin 6,IL-6)是一种主要由T细胞、B细胞、单核细胞等分泌的多效细胞因子,可以在免疫应答过程中起到关键调节作用,也是最常见的炎症因子之一。IL-6家族包括IL-6、白细胞介素11、制瘤素M、白血病抑制因子、心肌营养素1、睫状神经营养因子、心肌营养素样细胞因子1、白细胞介素27、白细胞介素35和白细胞介素39等。其具有相同的核心结构,并且在其受体复合物中共用相同的信号转导,只是在体内使用不同的受体、信号传导途径和表达模式来实现不同的生物化学功能。
1 IL-6在炎症反应中发挥着至关重要的作用
IL-6是目前公认的促炎因子,在免疫应答中起着关键作用。健康个体中,IL-6在血浆中的水平几乎可以忽略不计,而在大多数具有炎性组分的疾病中其水平显著提高,最普遍的是溃疡性结肠炎、骨关节炎、肺纤维化等慢性炎性疾病中。IL-6在炎性疾病中主要通过参与炎症与免疫应答反应而刺激机体,激活机体的免疫防御,对抗感染和组织损伤,但如果机体持续产生IL-6,则会造成或加重慢性炎症及自身免疫性疾病的发生或发展。
IL-6与血浆中的可溶性IL-6受体结合,其形成的复合物将与可溶性糖蛋白130结合,从而被中和。当IL-6水平超过IL-6受体和可溶性糖蛋白130的水平时,IL-6即产生急性炎症作用,如在脓毒症条件下所见。
经典的IL-6信号传导在炎症反应的急性阶段主要是促炎性的,但随后以保护性再生方式起作用,表现出抗炎活性。由此可见,IL-6在炎症反应的发生和进展过中起着重要的影响作用和调控作用。
2 IL-6在腰椎间盘退变或突出中的高表达
健康成年人椎间盘中IL-6水平较低,而在退变的椎间盘中IL-6的表达水平明显升高,并且其水平与患者腰痛程度相关。IL-6可聚集中性粒细胞而对腰椎软骨进行破坏,导致椎间盘软骨基质的蛋白多糖减少,进而导致成纤维细胞减少胶原合成,从而加速椎间盘的退化和增加腰椎间盘突出症的发病率。随着退行性变化进行,炎性细胞因子增加,加强了聚集蛋白聚糖和胶原的降解,改变了椎间盘细胞的特征,导致亲水性基质分子的减少而诱发结构变化和脊柱不稳,以及椎间盘周围组织水肿,这个情况可能是导致坐骨神经痛的主要根源。这些炎性细胞因子可明显的增加痛觉的敏感性,从而促进盘源性腰痛和神经根痛的发生。
椎间盘结构的退化与IL-6密切相关。有资料显示,突出的腰椎间盘中IL-6的表达明显高于正常腰椎间盘组织。而在椎间盘组织中不同位置的IL-6 mRNA水平有显著差异,从高到低依次是髓核、纤维环、软骨终板。此外病理分型不同其突出椎间盘组织中IL-6 mRNA的表达也有明显区别,游离型高于突出型高于膨出型。病理上,椎间盘突出分为3种类型,病情程度从轻到重分别是膨出型、突出型、游离脱出型。不同的类型的椎间盘突出所引发的坐骨神经痛的疼痛程度也不同,总体来说游离脱出型、突出型患者要比膨出型患者更加严重。因此,有学者认为盘源性腰痛或坐骨神经痛的发病机制可能是由椎间盘损伤引发。椎间盘纤维环的撕裂可能由多种原因引起,结果之一是髓核组织突出或者脱出,该过程刺激周边生化物质募集免疫细胞到椎间盘周围,使神经根发生更加明显的化学炎症反应,诱导炎症介质产生,从而刺激脊神经和神经根出现放射性神经根痛。髓核组织以及椎间盘退变刺激了炎性因子的产生,而炎性因子的产生又加剧了椎间盘的退变,二者相互促进,互为因果。
从B细胞和T细胞的生长分化到急性期蛋白诱导都包含在IL-6的作用过程中。在椎间盘中髓核、纤维环和软骨终板的细胞都分泌IL-6,并且IL-6还在突出的椎间盘中高表达。有研究发现IL-6可增强IL-1和肿瘤坏死因子α对椎间盘稳态的破坏作用,会增强髓核细胞的前列腺素E2和基质金属蛋白酶13的表达,减少蛋白多糖的合成。除此之外,IL-6还参与诱导背根神经节中的肿瘤坏死因子α表达,参与神经元细胞的凋亡过程,以上也可能是导致痛觉过敏和产生疼痛的机制之一。研究也发现,椎间盘病变患者的腰痛Oswestry功能障碍指数评分和视觉模拟评分也与椎间盘组织中IL-6的表达水平呈现正相关。由上可知,IL-6表达水平在椎间盘源性疼痛发病过程中扮演着重要角色。
众所周知,患侧直腿抬高试验阳性是腰椎间盘突出症的重要体征之一。有研究发现髓核组织中IL-6mRNA的表达越高,患者的直腿抬高试验的阳性率越高,两者呈正相关。通常,神经根受损程度与直腿抬高试验的阳性率呈正相关,但有研究表明,直腿抬高试验的阳性率并不受椎间盘突出大小的显著影响,而是与突出椎间盘中的炎性因子关系密切。手术过程中轻微刺激患者的神经根时,神经根周围炎症越明显的患者其下肢放射痛出现的可能性越大,这个现象表明在炎症形成和神经根受压的双重条件下才能形成明显的神经根痛。同时实验结果证明试验组IL-6 mRNA的表达明显高于正常对照组,提示椎间盘组织中IL-6 mRNA的表达水平与组织病变严重程度呈正相关。以上实验证据都证明了,在腰椎间盘突出症中IL-6不仅在椎间盘病变初期对病情发展起到了重要作用,而且在病变后期病情发展阶段,它始终保持一定高水平的表达,使得症状延续或者继续发展。
3 IL-6靶向药物临床研究
近几年靶向药物的优势和发展越来越显现。寻找疾病相应的治疗靶点成为药物研发的新热点。研究发现,特异性抑制IL-6经由sIL-6 R的反式信号传导途径,同时不损害IL-6通过经典信号传导表现的抗炎性质,可能是治疗炎性疾病的有研究价值的治疗方式。IL-6抑制剂已成为IL-6家族细胞因子致炎性疾病治疗方法中的重要靶点。研究发现抑制IL-6/IL-6R轴对治疗类风湿性关节炎、Castleman病和细胞因子释放综合征等自身免疫性疾病是高度有效的。Kang S等开发了人源抗IL-6 R抗体托珠单抗,其阻断IL-6与IL-6 R的结合,从而阻断IL-6 R信号传导级联,目前该药已广泛应用于急慢性炎性疾病。托珠单抗类药物对腰椎间盘突出的炎症反应是否有效,应用托珠单抗或者其他IL-6的靶向药物是否可有效的治疗腰椎间盘突出的炎症反应,也许是腰椎间盘突出药物治疗的新的方向。临床上可观察性研究IL-6的靶向药物对腰椎间盘突出的临床疗效,并深入探讨其相关的作用机制,为炎症反应在椎间盘源性神经痛中的机制研究提供临床和理论依据。
综上所述,IL-6作为临床常见的炎症反应指标,通过参与炎症与免疫应答反应激活机体免疫系统,对抗感染和组织损伤。其在腰椎间盘突出伴神经痛的整个过程中都发挥了重要作用,临床应用IL-6靶向药物来治疗腰椎间盘突出引发的神经痛是新的研究方向,希望能为更多的椎间盘源性患者提供更好的、更便捷的治疗方法。
[参考文献]:
[1]单晨,张超,张传宝.人白细胞介素-6重组蛋白的制备.中国医药生物技术[J].2024,19(3):240-245.4.
[2]王信光,薄存香,潘志峰.IL-6家族细胞因子在肺纤维化中的作用[J].中国工业医学杂志,2024,37(3):263-266.
[3]龚建萍,李倩,赵述芳,等.免疫因素在溃疡性结肠炎发病机制中的研究进展[J].现代消化及介入诊疗,2020,25(12):1676-1679.
[4]龚忠诚.白细胞介素家族促炎细胞因子在骨关节病中的研究进展[J].新疆医科大学学报,2019,42(7):852-855.
[5]Zhang Y,Li B,Ning B.Evaluating IL-6 and IL-10 as rapid diagnostic tools for Gram-negative bacteria and as disease severity predictors in pediatric sepsis patients in the intensive care unit[J].Front Immunol,2022,13:1043968.
[6]王铮华,吴亚斌,杜世杰.血清白细胞介素-6白细胞介素-17肿瘤坏死因子α与溃疡性结肠炎病情严重程度的关系及联合诊断价值[J].实用医技杂志,2023,30(9):636-638.
[7]房琦,李振英.Toll样受体7、白细胞介素-6与类风湿关节炎的相关性研究进展[J].中国现代医生,2024,62(11):133-136.
[8]高楠,李树民,梁健合.白细胞介素-6、C反应蛋白在特发性肺纤维化中的临床意义[J].黑龙江医药科学,2023,46(5):24-26.
[9]Hirano T,Matsuda T,Turner M,et al.Excessive produc⁃tion of interleukin 6/B cell stimulatory factor-2 in rheu⁃matoid arthritis[J].Eur J Immunol,1988,18:1797-1801.
[10]周思颖,顾国嵘,慕婉晴,等.细胞因子、经皮氧分压/吸入氧浓度联合危重评分对脓毒症患者进展为脓毒性休克及预后的预测价值[J].中国临床医学,2023,30(3):426-431.
[11]王昕,贺庆芝.白细胞介素在衣原体感染疾病中的研究进展.细胞与分子免疫学杂志[J].2021,37(1):84-89.
[12]杜志坡,张敬宾,李警,等.IL-1、IL-6在椎间盘源性腰痛患者椎间盘退变中的作用研究.颈腰痛杂志[J].2020,41(2):167-170.
[13]韩培江.中药内服外敷联合理筋正骨手法治疗腰椎间盘突出症的临床观察[J].中西医结合研究,2019,11(3):145-146.
[14]韩玺铭,朱兵兵,刘凤霞,等.腰椎间盘退变与血糖、血脂、白介素-6、降钙素原的相关性分析.医学信息,2022,35(2):90-93.
[15]侯桂红,李倩,谢燕.椎间盘组织中炎症因子水平、MMPs/TIMPs表达与腰椎间盘突出症的关系研究[J].中国实验诊断学,2018,22(5):791-794.
[16]韩建龙,常刚,吕晓业,等,NLRP3炎症小体通路在IL-6、TNF-α促进椎间盘髓核细胞神经营养因子和感觉神经肽P物质表达中的作用[J].老年医学研究,2023,4(4):16-19.
[17]陈金磊,王爽,王铭川,等.白细胞介素6与椎间盘退行性变关系的研究进展[J].中国医学科学院学报,2023,45(1):134-142.
[18]王宸,吴小涛,齐新生,等.白细胞介素6mRNA在突出腰椎间盘中的表达及临床意义[J].江苏医药,2004,30(2):95-96.
[19]海日罕.蒙医温针结合圆利针治疗腰椎间盘突出症的临床疗效观察[D].呼和浩特:内蒙古医科大学,2024.
[20]Ura K,Yamada K,Tsujimoto T,et al.Ultra-purified algi-nate gel implantation decreases inflammatory cyto⁃kine levels,prevents intervertebral disc degeneration,and reduces acute pain after discectomy[J].Sci Rep,2021,11(1):638.
[21]薛忠书,张小伟,陈宁杰.白细胞介素在椎间盘退变中的作用[J].中国矫形外科杂志.2023,31(4):341-345.
[22]左高骈,何育风,张龙,等.推拿治疗腰椎间盘突出症的机制研究[J].西部中医药,2024,37(4):97-100.
[23]Jing W,Liu W.HOXC13-AS induced extracellular ma⁃trix lossviatargeting miR-497-5p/ADAMTS5 in interver⁃tebral disc[J].Front Mol Biosci,2021,8:643997.
[24]彭丽娜,陶青云,张巧利.红外热成像评估联合经络取穴冲击波治疗腰椎间盘突出症的效果[J].广东医学,2024,45(6):723-727.
[25]刘庆.尪痹胶囊联合温针灸治疗腰椎间盘突出症临床观察[J].实用中医药杂志,2024,40(6):1059-1060.
[26]陈丹梓,蔡佳槐,林创坚,等.补肾蠲痹汤联合针刺治疗腰椎间盘突出症致坐骨神经痛临床研究[J].新中医,2024,56(7):112-115.
[27]Aripaka SS,Bech-Azeddine R,Jørgensen LM,et al.Low back pain scores correlate with the cytokine m R NA level in lumbar disc biopsies:a study of inflamma⁃tory markers in pa-tients undergoing lumbar spinal fu⁃sion[J].Eur Spine J,2021,30(10):2967-2974.
[28]Rose-John S.IL-6 trans-signaling via the soluble IL-6 receptor:importance for the pro-inflammatory activities of IL-6[J].Int J Biol Sci,2012,8:1237-1247.
[29]Kang S,Tanaka T,Narazaki M,et al.Targeting inter⁃leukin-6 signaling in clinic[J].Immunity,2019,50:1007-1023.










