坏死性急性胰腺炎三维重建模型的构建及临床意义论文
2024-11-18 14:25:35 来源: 作者:dingchenxi
摘要:目的基于坏死性急性胰腺炎患者的CT图像构建三维重建模型,研究其在病情评估与指导手术等方面的价值。方法将坏死性急性胰腺炎患者的CT图像导入医学处理软件MIMICS,通过图像分割、模型构建后建立三维重建模型。结果三维重建模型可以显示坏死组织体积,展示坏死组织与周围器官、血管、引流管的位置关系,评估是否存在血管并发症,评估穿刺引流治疗效果。
摘要:目的基于坏死性急性胰腺炎患者的CT图像构建三维重建模型,研究其在病情评估与指导手术等方面的价值。方法将坏死性急性胰腺炎患者的CT图像导入医学处理软件MIMICS,通过图像分割、模型构建后建立三维重建模型。结果三维重建模型可以显示坏死组织体积,展示坏死组织与周围器官、血管、引流管的位置关系,评估是否存在血管并发症,评估穿刺引流治疗效果。结论三维重建模型有利于更加准确便捷地评估胰腺坏死情况、是否存在血管受累,指导穿刺引流及手术治疗。
关键词:急性胰腺炎;坏死性急性胰腺炎;三维重建模型;经皮穿刺置管引流;血管并发症
0引言
急性胰腺炎(acute pancreatitis,AP)是临床上常见的急腹症,总死亡率约为5%[1]。根据其病理类型可分为间质水肿型AP和坏死型AP,后者伴有胰腺和(或)胰周组织坏死,若合并感染则可引起消化道瘘、感染性出血等并发症,病死率显著升高。我国最新的急性胰腺炎诊治指南推荐对无菌性坏死性AP实施保守治疗,若合并感染时则采用升阶(step-up)策略:即首选CT引导下的经皮穿刺置管引流术(percutaneous catheter drainage,PCD)或超声内镜引导下的穿刺支架引流(endoscopic transluminal drainage,ETD),当微创治疗失败时可考虑外科手术。但由于坏死性AP病情复杂多变,目前国内外学者对于外科干预的方式及最佳时机仍有争议[2],同时胰腺周围存在诸多重要器官和血管,且正常组织与坏死组织边界不清,给治疗带来极大难度,因此医生需要根据不同患者的病情严重程度、坏死组织分布范围等情况进行个体化的综合评估及治疗规划[3]。
然而在病情评估方面,目前临床常用的Marshall评分、改良CT严重指数(MCTSI)等诸多评分系统无法全面显示坏死组织分布范围及体积,无法显示与周围器官血管的关系,参考价值十分有限。因此无论在评估病情还是规划手术时,医生都需要结合CT图像进行判断。但二维CT图像十分抽象,缺乏清晰、立体、直观的形象,需要依靠医生的三维空间想象力进行判断。三维重建技术可以根据二维图像建立直观立体的器官组织模型,且已在胰腺疾病治疗方面得到了一定的应用,例如可用于胰腺及壶腹周围肿瘤的可切除性的评估[4]、肿瘤切除手术训练[5]。我国学者还于2017年发布了《胰头癌三维可视化精准诊治专家共识》[6],从术前评估、数据采集、模型构建等9个方面指导临床实践。若能对坏死性AP患者在术前建立三维重建模型,定量显示其坏死组织体积,清晰展示病灶的详细结构及坏死组织分布范围,则有助于医生全面评估病情、选择合适治疗方法及时机、提前规划操作路径,给治疗带来极大便利。
1资料与方法
1.1一般资料
选取2020年6月—2021年12月经诊断为坏死性急性胰腺炎的10例患者的腹部CT图像作为研究数据集。每位患者的CT图像均包含平扫图像以及在动脉期、胰腺期、门静脉期的增强图像,所有图像的层厚均精确控制在1.5mm。这些图像数据均来源于华中科技大学同济医学院附属协和医院放射科,并严格遵循医学伦理标准,所有参与研究的患者在检查前均已签署知情同意书,确保研究过程的合规性与伦理性。
1.2三维模型的构建
首先,从CT图像中分层采集腹部增强灰度图数据,创建空白蒙版,采用阈值分割法对每层胰腺、胰腺坏死组织、积液及其毗邻器官边界的增强灰度图数据进行提取处理,并得到不同阈值范围对应的器官组织的图像像素。采用区域增长法分别将与上述区域类型相似的图像像素进行增强处理,得到不同区域的热区图,由此确定每层胰腺、胰腺坏死组织、积液与其毗邻器官的边界。之后分别勾画上述区域并根据计算得到其三维数据信息,将预设正常组织器官的灰度值分别与计算后的灰度值进行比较,通过比较后的结果勾画出不同区域,根据三维数据信息重建三维模型并进行可视化显示。最后对重建的三维模型进行三角面片优化处理,去除表面的钉状物,得到优化后三维模型并导出保存。具体过程为:①使用比利时Materialise公司开发的医学处理软件MIMICS的新建功能,导入患者DICOM数据;②使用软件菜单栏中Image下Apply filter功能,对医学图像使用Median(或Binomial blur)功能算法,使图像及软组织灰度值轮廓更加清晰可见;③使用Segment中Newmask功能,获取整体阈值蒙版,根据此阈值蒙版,采用单层笔刷、多层笔刷、三维动态编辑等功能分别从阈值模板中单独分离出各组织器官模板(如胰腺、十二指肠、胃、骨骼、脏、脾、肾、胆囊等各个器官);④对分离的模板使用Calculate计算功能,得到三维立体数字模型,对模型使用平滑功能,以得到光滑的表面。
2结果
2.1胰腺坏死组织与胰周器官血管的三维重建
观察1例患者的重建后的三维模型(图1),可见图中灰色部分所代表的坏死组织外形极不规则,主要位于右上腹,少部分位于右下腹及左上腹,根据左下方标注可知此例患者坏死组织体积为475.90mL。国外研究[7]曾报道:胰腺外坏死组织体积与急性胰腺炎患者的预后高度相关,根据胰腺外坏死体积是否大于100mL可预测患者器官衰竭和感染的发生,通过此标准可以预测患者发生感染的可能性较大。
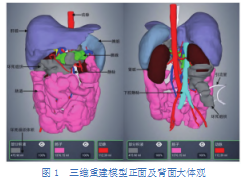
2.2胰周脏器的三维重建
胰腺周围主要组织器官为肝脏、脾、胆囊、胆管及肠道,手术操作过程中需要格外注意切勿损伤。当仅显示图1所示患者的胰腺、坏死组织和上述结构时,通过旋转不同角度可观察到坏死组织与它们的位置关系(图2):少部分坏死组织包绕于胰头、胰体前方,少部分位于胰尾与肝左叶脏面之间,其余大部分位于肝脏及胰腺下方器官及组织间隙,未累及胆囊和胆道,还可观察到此例患者的坏死组织大部分位于升结肠与横结肠后方,少部分位于胰腺与胰腺下方肠道之间。
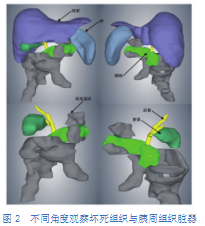
通过观察另一例患者的三维重建模型(图3),可发现此例患者坏死组织体积较大,接近1400mL,分布十分广泛,几乎占据整个上腹部,且有少部分渗至左下腹。从右向左观察,可见右上腹的坏死组织未累及胆囊和胆管,少部分位于十二指肠前方,其余部分广泛覆盖于十二指肠前下方,左上腹的坏死组织位于胃后方,覆盖整个胰腺前方且部分包绕胰尾,随后向左延伸至脾的前下方,并继续向下延伸至左下腹。由于此例患者的坏死组织体积大、分布广,治疗过程较为困难,在操作过程中应注意避开所覆盖的器官和血管,同时提示存在治疗后坏死组织清除不充分、需要多次引流甚至实施手术的可能。
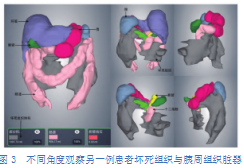
2.3胰周血管的三维重建
通过对图1所示患者的三维模型进行去除肝脏、将坏死组织不透明度设置为80%、旋转角度、显示相关血管等操作(图4),可观察到坏死组织与动脉、门静脉、下腔静脉的位置关系。在动脉相关血管中,部分坏死组织侵及胃左动脉、胃十二指肠动脉、中结肠动脉、右结肠动脉;在门静脉相关血管中,部分坏死组织位于肠系膜上静脉前方,少部分位于脾静脉与肠系膜下静脉之间;在下腔静脉中,坏死组织主要位于下腔静脉右侧,范围上至胰腺钩突后方,下至左、右髂总静脉汇合处。在规划穿刺或手术路径时,避开上述血管有助于保护血管、减少术中大出血等情况发生。
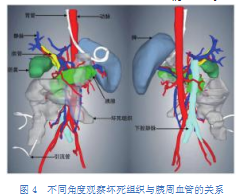
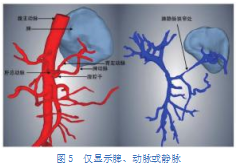
由于部分急性胰腺炎患者会出现假性动脉瘤、门静脉血栓、脾静脉血栓等并发症[8-9],因此术前了解患者的血管状况十分必要。仅显示脾及动脉时,图5可见此例患者胃左动脉起源于肝总动脉与脾动脉分支处,肝总动脉随后分出肝固有动脉和胃十二指肠动脉,前者继续分出胃右动脉和肝左、右动脉,后者分出胃网膜右动脉、胰十二指肠上动脉,各动脉管壁无明显膨大或狭窄,暂不考虑假性动脉瘤等并发症。仅显示脾及门静脉时,可见此例患者脾静脉起始段有一明显狭窄,怀疑并发脾静脉血栓,提示医生应结合其他检查确诊后采取相应治疗措施。
2.4引流管的三维重建
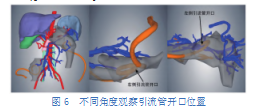
观察另一例患者接受穿刺引流治疗后的三维重建模型(图6),可见此例患者右下腹和左上腹各有1根引流管。仅显示坏死组织、门静脉及引流管并旋转角度后发现:右下腹引流管开口处位于坏死组织内较低位置,有利于坏死组织顺畅排出;左上腹引流管开口处位于坏死组织内较高位置,若后期坏死组织未完全排出则需要调整引流管位置或重新放置引流管,甚至手术清除坏死组织。
3讨论
3.1目前坏死性AP的治疗难点
目前,临床上对于坏死性AP的治疗存在着干预方式、时机不统一和病情评估困难两大难点。首先,外科干预方式和时机的选择上仍无统一定论,有研究表明在引流方式的选择上,ETD较PCD具有出血风险低、侵袭性低、预后好的优势[10];有研究表明外科清创较内镜清创对于治疗结肠后间隙和盆腔腹膜后感染更有优势[11]。其次,由于坏死组织周围存在许多重要脏器和血管,结构复杂,不同患者之间的病情也存在个体差异,因此客观评估坏死组织体积、分布范围、与周围器官血管的位置关系极为重要。二维CT图像十分抽象且受限于个人的空间想象力,医生在了解坏死组织分布时常需反复观察CT图像中的某一区域,待形成大致印象后再观察另一区域,这使得医生对病灶的大体印象不仅不够直观且较为耗时。临床上主要的两种影像学评分系统—Balthazar CT评级和改良CT严重指数一定程度上可以反映胰腺坏死组织的情况,但无法客观显示坏死组织体积以及与周围器官血管的关系。
3.2坏死性AP三维重建模型的构建要点
三维重建技术是一种能将传统二维CT或MRI等影像资料通过计算机软件转化为三维立体模型的技术,早在2008年我国研究者便已根据首个中国成年女性数据集建立了正常胰腺与肝、脾、胆囊等周围组织的三维重建模型[12],之后的绝大多数研究关注三维重建技术在胰腺肿瘤方面的应用,例如可将其用于手术训练[5]、指导手术方式选择[13]、引导碘-125粒子治疗[14]、研究胰腺导管腺癌的病理变化[15]。然而在急性胰腺炎方面相关研究极少,可能是由于部分患者坏死组织分布广泛、与其他组织不易分辨。同时,三维模型的构建对图像采集质量、分割细致程度、数据融合精度等方面要求较高,因此在一定程度上限制了其应用。
在对坏死性AP的三维模型进行构建时要点在于:一部分患者的坏死组织与周围组织在CT图像上灰度值较为接近,分割后的图像既包含坏死组织也包含其他组织,因此要求操作者具有一定解剖学基础,在构建模型时根据解剖学知识和CT图像的窗宽窗位将图像调整到合适的灰度值,运用半自动化和人工手动相结合的方式将其分离。
3.3三维重建模型的临床意义
通过对坏死性AP患者的CT图像进行三维模型重建,具有以下临床意义。
(1)更加准确便捷地评估胰腺坏死情况:通过观察三维模型及相关标注,医生可以方便地测量胰腺自身和坏死组织的真实体积。在图1中可知此例患者坏死组织体积为475.90mL,剩余胰腺体积为101.86mL,弥补了二维CT图像不够直观、缺乏定量数据的缺陷,在病情评估时不仅可与MCTSI等评分系统相互印证,而且可以根据胰腺外坏死物体积大于100mL简单预测患者的预后状况[7]。
(2)直观评估是否存在血管受累:AP的主要血管并发症包括假性动脉瘤、门静脉血栓、脾静脉血栓等,可继而导致门静脉高压、食管胃底静脉曲张、肝功能衰竭、脾和肠道坏死,因此早期发现上述血管异常具有十分重要的临床意义。重建后的三维模型能单独显示腹腔动脉、门静脉等血管,医生对血管外形、管径等方面进行观察后,能够直观评估患者是否发生上述血管并发症,有利于及时进行针对性检查及治疗。
(3)指导穿刺及手术:医生可以将三维重建模型任意放大缩小、自由旋转角度、自定义器官与组织的颜色和透明度、去除某个或多个器官,从而克服了二维图像不够直观的缺点,在指导穿刺和手术方面具有较高价值。在指导穿刺方面,医生可以在穿刺引流操作前了解坏死物积聚范围,在遵循“捷径、低位、通畅、安全、有效”的原则下合理规划穿刺路径[16]。当放置引流管后,临床上常出现的问题包括引流管开口不在平卧时坏死组织最低位、引流不通畅[17],通过观察三维模型可以评估引流管位置是否合适、引流效果是否良好,当放置位置不合适或引流效果不佳的时候需要对引流管进行调整。图6所示患者左上腹引流管处于平卧时坏死组织内较高位置,可能导致低位坏死组织不能全部排出,提示医生需要密切观察引流效果,若仍有坏死组织不能排出,则需根据病情变化调整引流管位置、重新穿刺甚至实施手术,以期完全清除坏死组织。在指导手术方面,三维模型可以辅助医生进行操作规划,包括选择合适的手术切口及手术部位、模拟术中操作、避开重要脏器和血管,其中辨清血管与坏死组织之间的位置关系尤为重要,可以预防术中可能出现的血管损伤及大出血。例如当图3所示坏死组织分布广泛的患者需要微创或开腹手术时,医生能够在术前详细观察坏死组织与周围器官、血管的位置关系,从而在术中避免损伤上述重要解剖结构,有效减少手术时间及并发症。
综上所述,在临床实践中,医生还能通过展示三维重建模型,让患者及家属能清晰直观地了解病情及手术流程,有助于医患之间更加高效地沟通。
参考文献
[1]中华医学会外科学分会胰腺外科学组.中国急性胰腺炎诊治指南(2021)[J].中华外科杂志,2021,59(7):578-587.
[2]张焕庆,吴伟顶,江俊杰,等.重症急性胰腺炎的外科干预研究进展[J].中华普通外科杂志,2021,36(3):235-237.
[3]孙备,李冠群.创伤递升式分阶段治疗感染性胰腺坏死再认识[J].中国实用外科杂志,2021,41(4):374-378.
[4]FANG C,ZHU W,WANG H,et al.A new approach for evaluating the resectability of pancreatic and periampullary neoplasms[J].Pancreatolo gy,2012,12(4):364-371.
[5]LIN C,GAO J,ZHENG H,et al.Three-Dimensional Visualization Technology Used in Pancreatic Surgery:a Valuable Tool for Surgical Trainees[J].Journal of Gastrointestinal Surgery,2020,24(4):866-873.
[6]中华医学会外科学分会胰腺外科学组,中国研究型医院学会胰腺疾病专业委员会,中华医学会数字医学分会,等.胰头癌三维可视化精准诊治专家共识[J].中华外科杂志,2017,55(12):881-886.
[7]MEYRIGNAC O,LAGARDE S,BOURNET B,et al.Acute Pancreatitis:Extrapancreatic Necrosis Volume as Early Predictor of Severity[J].Radiology,2015,276(1):119-128.
[8]VERDE F,FISHMAN E K,JOHNSON P T.Arterial pseudoaneurysms complicating pancreatitis:literature review[J].Journal of computer assisted tomography,2015,39(1):7-12.
[9]姚辉,郭晓钟,祁兴顺,等.胰腺炎并发胰周血管异常的临床分析[J].中华胰腺病杂志,2017,17(3):158-161.
[10]HE W,ZHU Y,ZHU Y,et al.The outcomes of initial endoscopic transluminal drainage are superior to percutaneous drainage for patients with infected pancreatic necrosis:a prospective cohort study[J].Surgical Endoscopy,2017,31(7):3004-3013.
[11]van BRUNSCHOT S,van GRINSVEN J,van SANTVOORT H C,et al.Endoscopic or surgical step-up approach for infected necrotising pancreatitis:a multicentre randomised trial[J].The Lancet,2018,391(10115):51-58.
[12]J IN Y,CHEN G,ZHANG S,et al.Three-dimensional reconstruction of the pancreas and its surrounding structures[J].Computerized Medical Imaging and Graphics,2008,32(4):277-283.
[13]ZHOU H T,PENG C B,HAN Y,et al.Quantitative analysis of three‐dimensional reconstruction data to guide the selection of methods for laparoscopic distal pancreatectomy[J].Journal of Hepato-Biliary-Pancreatic Sciences,2021,28(8):659-670.
[14]HU Y,QI E,LIU F,et al.The application of a three-dimensional visualized seed planning and navigation system in(125)I seed implantation for pancreatic cancer[J].Onco Targets Ther,2018,11:619-627.
[15]HONG S,JUNG D,KIEMEN A,et al.Three-dimensional visualization of cleared human pancreas cancer reveals that sustained epithelial-to-mesenchymal transition is not required for venous invasion[J].Modern Pathology,2020,33(4):639-647.
[16]孙备,程卓鑫,姜洪池.对重症急性胰腺炎引流治疗的几点认识[J].中国实用外科杂志,2009,29(11):907-909.
[17]朱维铭.腹部手术引流的正确置放和引流物判断[J].中国实用外科杂志,2011,31(1):66-68.










