边缘无形体MSP2的原核表达及间接ELISA抗体检测方法的建立论文
2024-05-06 10:11:43 来源:SCI论文网 作者:xuling
摘要:为建立可检测边缘无形体(Anaplasma marginale)的血清学检测方法,该研究根据GenBank收录的边缘无形体MSP2基因序列(登录号:EU526889),构建重组质粒pET28a-MSP2,原核表达获得pET28a-MSP2重组蛋白,将纯化后的蛋白作为抗原,建立间接ELISA检测方法。
摘要:为建立可检测边缘无形体(Anaplasma marginale)的血清学检测方法,该研究根据GenBank收录的边缘无形体MSP2基因序列(登录号:EU526889),构建重组质粒pET28a-MSP2,原核表达获得pET28a-MSP2重组蛋白,将纯化后的蛋白作为抗原,建立间接ELISA检测方法。结果显示,该研究建立的间接ELISA方法,抗原最佳包被浓度、血清最佳稀释度和酶标二抗最佳工作浓度分别为8μg/mL、1:400和1:2 000,特异性、灵敏性和重复性良好。本试验成功表达并纯化了边缘无形体的MSP2蛋白,并建立了边缘无形体抗体间接ELISA方法,为边缘无形体的监测和诊断提供参考。
关键词:边缘无形体,MSP2蛋白,原核表达,间接ELISA
Prokaryotic Expression of Anaplasma marginale MSP2 Protein and Development of Indirect ELISA for Antibody Detection
LUO Yuxin1,ZHAO Min1,CHEN Wanting1,ZOU Yu1,XIAN Chengjun1,WANG Dongying1,2,3,4*
(1.College of Animal Science and Technology,Guangxi University,Nanning Guangxi 530004,China;2.Guangxi Zhuang Autonomous Region Engineering Research Center of Veterinary Biologics,Nanning Guangxi 530004,China;3.Guangxi Key Laboratory of Animal Reproduction,Breeding and Disease Control,Nanning Guangxi 530004,China;4.Guangxi Colleges and Universities Key Laboratory of Prevention and Control for Animal Disease,Nanning Guangxi 530004,China)
Abstract:In order to establish a serological assay for Anaplasma marginale,this study was conducted based on the gene sequence of A.marginale MSP2 collected by GenBank(Accession number:EU526889),the recombinant plasmid pET28a-MSP2 was constructed,and the pET28a-MSP2 protein was obtained and purified by prokaryotic expression.The purified protein was used as antigen to establish an indirect ELISA method.The results showed that the indirect ELISA method established in this study showed that the optimal concentration of antigen coated was 8μg/mL,the optimal serum dilution was 1:400,and the optimal working concentration of the secondary antibody was 1:2 000,which showed good specificity,sensitivity and repeatability.In this study,the MSP2 protein of A.marginale was successfully expressed and purified,and an indirect ELISA method for A.marginale antibody was established,which provided certain reference value for the monitoring,diagnosis for A.marginale.
Keywords:Anaplasma marginale,MSP2 protein,prokaryotic expression,indirect ELISA
0引言
边缘无形体是高等脊椎动物红细胞中的专性细胞内寄生菌,是牛感染无形体病的主要病原。边缘无形体可引起贫血、高热、黄疸、消瘦、嗜睡等临床症状,导致动物肉、奶产量下降,给养殖业造成严重的经济损失。边缘无形体病在世界范围广泛分布,主要经蜱传播。蜱吸食带无形体的血液后可以储存在蜱的消化道和中肠,经过红细胞裂解释放侵袭中肠组织,并由无性繁殖期的网状型发育成具有感染性的浓密型,储存在蜱的唾液腺,通过叮咬再一次进行生物传播[1]。在我国,广州、湖南、四川、河南、吉林、新疆等均检测到边缘无形体[2],其中南海地区的黄牛边缘无形体感染率达5.7%[3],西藏微小牛蜱边缘无形体阳性率37%[4],云南山羊爆发边缘无形体病,病死率达到84.5%[5]。
间接ELISA最大的优点是灵敏性高和特异性强[6],MSP2蛋白为免疫显性蛋白[7]。边缘无形体先是黏附在红细胞上然后再侵入红细胞的,MSP2与病原和红细胞的黏附有密切关系,对生物体十分重要,此外,MSP2蛋白能诱导哺乳动物保护性免疫反应,为其成为诊断抗原提供了理论基础。
1材料与方法
1.1材料
1.1.1菌株与质粒
pET-28a(+)载体,Takara公司产品;DH5α感受态细胞、BL21(DE3)感受态细胞,南京诺唯赞生物科技股份有限公司产品。
1.1.2血清样品
山羊全血及血清采自广西壮族自治区河池市。边缘无形体阳性血清、羊嗜血支原体阳性血清及阴性血清,边缘无形体DNA模板,由广西大学寄生虫实验室保存。
1.1.3主要试剂
Dream Taq Green PCR预混液(2×)、基因组DNA纯化试剂盒,Thermo Fisher Scientific公司产品;质粒提取试剂盒、DNA胶回收试剂盒,天根生化科技(北京)有限公司产品;无缝克隆试剂盒,碧云天生物技术有限公司产品;辣根过氧化物酶标记的兔抗山羊IgG、BCA蛋白浓度定量试剂盒、TMB单组分显色液、明胶,北京索莱宝科技有限公司产品。
1.2方法
1.2.1引物设计
通过边缘无形体MSP2基因序列(Gen Bank登录号为EU526889)设计同源臂引物。引物序列:(F)5’-GAATTCGAGCTCCGTCGACAAGCCCCTGCAG CTGGTGCTGG-3’;(R)5’-TTAGCAGCCGGAT CTCAGTGGACCCCACTTCTTAGCCTCAC-3’;设计pET-28a(+)载体反向扩增引物,引物序列:(F)5’-CCACTGAGATCCGGCTGCTAA-3’;(R)5’-TTGTCGACGGAGCTCGAATTC-3’。
1.2.2目的基因的扩增及pET-28a(+)载体的线性化
以pET-28a(+)载体、羊嗜血支原体基因组为模板,PCR反应体系(25μL):Dream Taq Green PCR预混液12.5μL,DNA模板2μL,上下游引物各10μmol,剩余用水补足。PCR反应条件:95℃预变性5 min;95℃变性30 s,65℃退火30 s,72℃延伸5 min,循环32次;72℃延伸8 min。产物用1.5%琼脂糖凝胶电泳检测。
1.2.3重组表达载体的构建
胶回收获得目的基因及线性化的pET-28a(+)载体,参考碧云天无缝克隆试剂盒说明书构建重组质粒,转至DH5α感受态细胞后振荡培养,提取阳性质粒,琼脂糖凝胶电泳检测后送生工生物工程股份有限公司测序。阳性重组质粒命名为pET28a-MSP2。
1.2.4重组蛋白的诱导表达
将成功构建的重组质粒pET28a-MSP2转入BL21(DE3)感受态细胞振荡培养,37℃、200 r/min振荡培养8 h,加入终浓度0.1 mmol/L的IPTG,37℃、200 r/min诱导表达8 h进行超声破碎,分别收集上清和沉淀进行SDS-PAGE鉴定。
1.2.5重组蛋白最佳IPTG诱导浓度的优化
方法同1.2.4,加入终浓度为0.1、0.2、0.4、0.6 mmol/L的IPTG,37℃、200 r/min诱导表达8 h进行超声破碎。
1.2.6重组蛋白的纯化
按照最佳的条件对重组蛋白诱导表达,采用镍柱法纯化pET28a-MSP2重组蛋白。
1.2.7最佳反应条件的优化
PBS将纯化后的pET28a-MSP2重组蛋白分别稀释至12、10、9、8μg/mL,每孔100μL加入酶标板,4℃包被过夜;每孔加入150μL浓度为1%的明胶,37℃封闭2 h;山羊感染边缘无形体阴、阳性血清稀释度分别为1∶100、1∶200、1∶400,每孔加入100μL,设3个重复孔,空白对照每孔加入100μL PBS,设2个重复孔,封口后于37℃孵育1 h;兔抗山羊IgG-HRP用PBST分别以1∶1 000、1∶2 000、1∶3 000的比例稀释,每孔加入100μL,封口后于37℃孵育1 h;每孔加入100μL TMB显色液,封口后于37℃孵育10 min;每孔加入50μL 2 mol/L H2SO4终止显色,酶标仪测定OD450 nm值,计算P/N值。
1.2.8最佳封闭条件的确定
将1%、5%明胶、2.5脱脂奶粉和5%脱脂奶粉作为封闭液,按前期优化好的反应条件,酶标仪测定OD450值,计算P/N值。
1.2.9临界值的确定
按前期优化好的反应条件检测9份边缘无形体阴性血清与9份边缘无形体体阳性血清,读取OD450 nm值,计算平均值和标准方差SD,按照OD450 nm=+3SD作为临床边缘无形体血清检测判断阳性的临界值。
1.2.10特异性试验
分别检测边缘无形体阳性血清、羊嗜血支原体阳性血清,读取OD450 nm值。
1.2.11灵敏性试验
将边缘无形体阴、阳性血清分别按照1:100、1:200、1:400、1:800、1:1 600、和1:3 200的比例稀释,读取OD450 nm值。
1.2.12重复性试验
用同批次和不同批次包被的酶标板,分别检测5份不同的边缘无形体阳性血清,每份血清做3个重复。
2结果
2.1重组质粒的构建及鉴定
提取阳性质粒后凝胶电泳分析结果与已知大小相符。测序结果经比对后本研究所得到的边缘无形体MSP2序列与已报道的序列一致。
2.2重组蛋白表达形式的鉴定
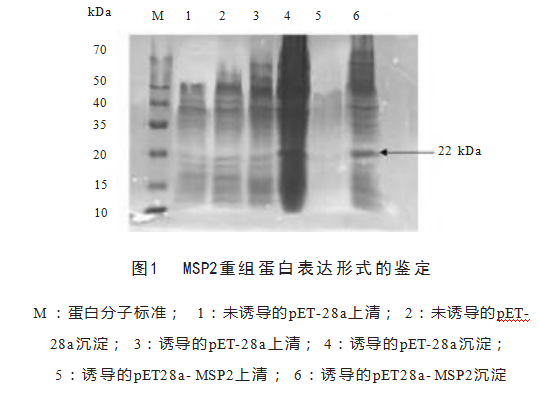
重组蛋白经诱导表达之后,沉淀在22 kDa处有明显条带,与预期蛋白分子量相同,表明重组蛋白pET28a-MSP2以包涵体形式存在,见图1。
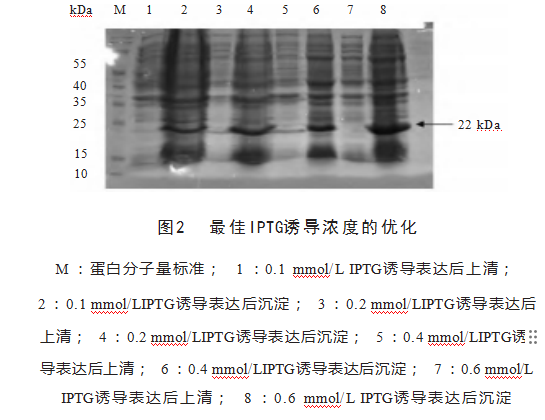
2.3重组蛋白最佳IPTG诱导浓度的优化
重组蛋白pET28a-MSP2在0.6 mmol/L的IPTG诱导下条带最明显,最佳IPTG诱导浓度为0.6 mmol/L,见图2。
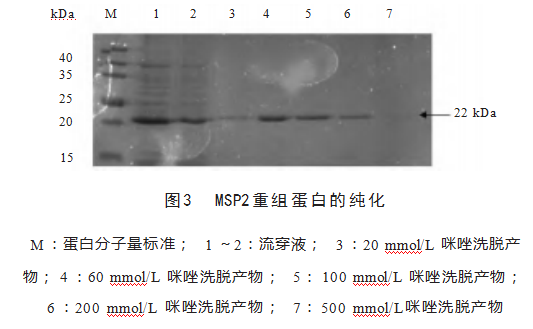
2.4重组蛋白的纯化
重组蛋白pET28a-MSP2在60 mmol/L咪唑洗脱产物的22 kDa处有明显且单一的条带,表明重组蛋白pET28a-MSP2纯化成功,见图3。
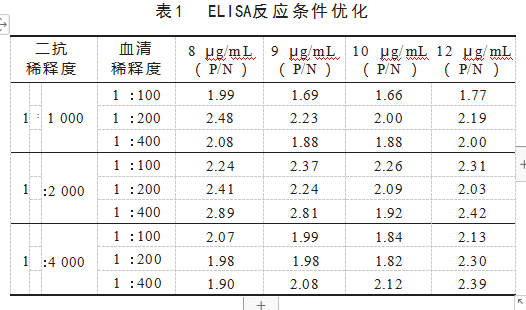
2.5最佳反应条件的优化
重组蛋白pET28a-MSP2作为诊断抗原的间接ELISA法最佳血清稀释度为1:400,最佳抗原包被浓度为8μg/mL,最佳二抗稀释度为1:2 000,见表1。
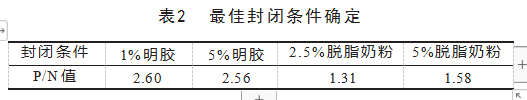
2.6最佳封闭条件的确定
重组蛋白pET28a-MSP2作为诊断抗原的间接ELISA法用1%明胶封闭时,P/N值最大,为2.60,见表2。
2.7阴阳临界值的确定
用建立的间接ELISA检测方法检测9份阴性血清的OD450 nm值分别为0.294、0.231、0.264、0.271、0.143、0.276、0.264、0.160、0.286,+3SD=0.399,+2SD=0.347。当待检血清样品OD450 nm值≥0.399时,可判定为阳性;OD450 nm值≤0.347时,判定为阴性;0.347<OD450 nm值<0.399判定为可疑,复检后仍为可疑可判断为阳性。
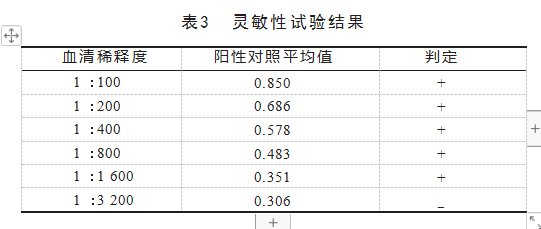
2.8灵敏性试验
重组蛋白pET28a-MSP2作为诊断抗原的间接ELISA法,最低血清稀释度检测界限为1:1 600,见表3。
2.9特异性试验
用所建立的间接ELISA检测方法对羊嗜血支原体阳性进行检测,以边缘无形体阳性血清为对照,平均值分别为0.329和0.578,结果为阴性。
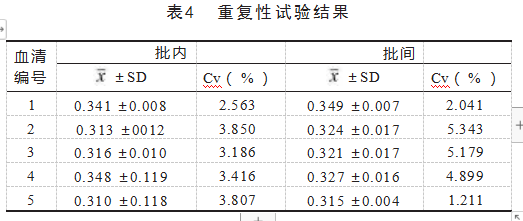
2.10重复性试验
用所建立的间接ELISA检测方法对5份边缘无形体阳性血清样本进行批内和批间重复性试验,结果显示批内变异系数(Cv)小于5%。批间Cv小于10%,见表4,重复性良好。
3讨论
边缘无形体高等脊椎动物红细胞中的专性细胞内寄生菌,是牛感染无形体病的主要病原[8]。近年Abid K等[9]以及沈雪鹰等[10]报道羊感染边缘无形体病。感染了边缘无形体的动物表现出发热、贫血、消瘦等非特异症状,急性感染爆发会导致高死亡率[11],该病的检出对其防控具有重要的意义。
MSP2蛋白是具有表面暴露区的外膜蛋白[7]。Junsiri W等[12]证明MSP2蛋白功能与入侵宿主红细胞有关。本研究利用原核表达制备pET28a-MSP2重组蛋白,并将纯化过的pET28a-MSP2重组蛋白作为包被抗原,建立了可检测边缘无形体的间接ELISA检测法。结果表明,当阳性血清进行1:1 600稀释后仍能检出阳性,用所建立的方法对羊嗜血支原体阳性血清进行检测,结果为阴性,说明该方法有良好的敏感性和特异性。用所建立的方法进行批内和批间的重复性试验,结果显示批内变异系数(Cv)小于5%,批间变异系数小于10%,证明该方法具有良好的重复性。
关于边缘无形体MSP2在羊无形体感染血清学诊断中的评价的文献很少,本研究建立的检测方法所需成本不高、操作简便,适合规模检测。本研究成功建立了一种可检测边缘无形体的间接ELISA诊断法,特异性、敏感性、重复性良好,适用边缘无形体的快速鉴别诊断与监测。
参考文献
[1]Kocan K M,de la Fuente J,Guglielmone A A,et al.Antigens and Alternatives for Control of Anaplasma marginale Infection in Cattle[J].Clinical Microbiology Reviews,2003,16(4):698-712.
[2]比尔来西肯·赛都力,王一明,王传峰,等.伊犁地区牛边缘无浆体病流行病学调查分析[J].黑龙江畜牧兽医,2015(18):125-126,238.
[3]黄良圆,周飒,廖慧钰,等.海南部分地区黄牛无浆体分子流行病学调查及遗传多样性分析[J].热带农业工程,2021,45(6):9-15.
[4]蹇锐,温博海,张有植,等.从西藏微小牛蜱检出类查菲埃立克体和边缘无形体16S rDNA[J].中国人兽共患病杂志,2002(3):39-41,85.
[5]刘佳升,余桃樱,刘宁,等.规模养羊户山羊暴发边缘无浆体病的确诊[J].上海畜牧兽医通讯,2017(1):2-7.
[6]李晨露,吴发兴,徐海玲,等.基于N蛋白的牛冠状病毒抗体间接ELISA检测方法的建立与应用[J].动物医学进展,2022,43(5):1-5.
[7]倪宏波,姜海芳,钱爱东.牛边缘无浆体膜表面蛋白的研究进展[J].黑龙江畜牧兽医,2010(3):27-28.
[8]Salazar A,Ochoa-Corona F M,Talley J L,et al.Recombinase polymerase amplification(RPA)with lateralflow detection for three Anaplasma species of importance to livestock health[J].Scientific Reports,2021,11(1):15 962.
[9]Abid K,Bukhari S,Asif M,et al.Molecular detection and prevalence of Theileria ovis and Anaplasma marginale in sheep blood samples collected from Layyah district in Punjab,Pakistan[J].Tropical Animal Health and Production,2021,53(4):439.
[10]沈雪鹰,蒋宝贵,何志海,等.云南省腾冲市牛、羊中无形体感染的分子流行病学调查[J].中国预防兽医学报,2020,42(10):1 068-1 072.
[11]Guarnizo T R M,Alvarez D O,Díaz-Sánchez A A,et al.Epidemiology and genetic diversity of Anaplasma marginale in Zamora-Chinchipe,Ecuador[J].Ticks and Tick-borne Diseases,2020,11(3):101 380.
[12]Junsiri W,Watthanadirek A,Poolsawat N,et al.Anaplasma marginale:Molecular discrimination,recombinant expression and characterization of major surface protein 2[J].Research in Veterinary Science,2022,152:372-386.










