1种用于分离猪肠道CD3+T细胞方法的建立论文
2024-05-06 09:49:20 来源:SCI论文网 作者:xuling
摘要:CD3+T细胞是猪肠道免疫系统的重要组成部分,对肠道病毒感染研究具有重要价值。该研究开发了一种采用磁珠富集手段从猪小肠组织中分离原代CD3+T细胞的方法。该方法将为研究猪肠道免疫系统功能提供合适的细胞模型,还可加速抗病毒药物和疫苗研发。
摘要:CD3+T细胞是猪肠道免疫系统的重要组成部分,对肠道病毒感染研究具有重要价值。该研究开发了一种采用磁珠富集手段从猪小肠组织中分离原代CD3+T细胞的方法。该方法将为研究猪肠道免疫系统功能提供合适的细胞模型,还可加速抗病毒药物和疫苗研发。
关键词:CD3+T细胞,猪流行性腹泻病毒,磁珠分离
The Establishment of a Method for the Separation of CD3+T Cells from Porcine Intestines
CHEN Zhongliang,HUANG Zhen*
(Nanjing University,Nanjing Jiangsu 210023,China)
Abstract:CD3+T cells are a crucial component of the porcine intestinal immune system and hold significant value in the study of intestinal viral infections.This study has developed a method for isolating primary CD3+T cells from porcine small intestine tissue using magnetic bead enrichment.This method will provide an appropriate animal model for studying the porcine intestinal immune system and can also accelerate the development of antiviral drugs and vaccines.
Keywords:CD3+T cell,porcine epidemic diarrhea virus,magnetic beads separation
0引言
猪流行性腹泻病毒(PEDV)是一种传染性肠道病毒,可引起哺乳仔猪严重腹泻、呕吐和脱水[1]。据报道,感染PEDV的哺乳仔猪的发病率和死亡率接近100%,对许多国家的养猪业都产生了破坏性影响[2]。PEDV是尼多病毒目冠状病毒科甲冠状病毒属的成员,2010年末在中国暴发了由变异PEDV引起的猪流行性腹泻[3-4]。有研究表明,初乳中的CD3+T细胞是PEDV垂直传播的重要途径。感染PEDV的母猪肠道上皮细胞中定植的PEDV可以将病毒转移到肠道中的CD3+T细胞,携带PEDV的CD3+T细胞表达整合素α4β7和趋化因子受体CCR10,通过血液循环到达乳腺,最终被分泌到初乳中导致哺乳仔猪感染[5-6]。CD3+T细胞在PEDV致病和传播过程中起着重要作用,但对CD3+T细胞的研究有待深入,其中关键受制因素为难以获取高质量的CD3+T细胞。为更进一步的研究PEDV是如何转移到肠道CD3+T细胞,亟待开发一种高效的CD3+T细胞纯化方法,通过获取纯度高活性好的肠道CD3+T细胞,将其作为细胞模型用于研究肠道CD3+T细胞和PEDV间相互作用模式,开发全新的阻断病毒传播途径的治疗策略,达到提升养殖户的猪群健康状态及生产效益的目的。
1材料与方法
1.1材料
1.1.1试剂
新鲜的猪小肠组织,R-PE IMag Particles-DM E31-1459磁珠,BD IMaGTU缓冲液,佛波酯(PMA),HiScript III RT SuperMix for qPCR(+gDNA wiper)逆转录试剂盒,ChamQ SYBR qPCR Master Mix(High ROX Premixed)高灵敏性染料法定量PCR检测试剂盒,牛血清白蛋白(BSA),Hank's平衡盐溶液(HBSS),磷酸盐缓冲液(PBS),Percoll分离液,二硫苏糖醇(DTT),乙二胺四乙酸(EDTA),Trizol,RPMI-1640培养基,胎牛血清,DEPC水等。
1.1.2仪器与耗材
ABI 7500荧光实时定量PCR仪,流式细胞仪,超微量核酸/蛋白浓度测定仪,微孔滤膜,金属筛,无菌超净台等。
1.2方法
1.2.1上皮内淋巴细胞的分离
①组织准备:采集新鲜的猪小肠组织盛于预冷的HBSS溶液中,冲洗内容物。②在无菌超净台中将小肠切成大小适宜的片段(2 mm×2 mm)后转移至HBSS-DTT溶液中,置于37℃摇床孵育5 min。③振荡混匀,金属筛过滤,剩余组织中加入HBSS-EDTA溶液后置于37℃摇床孵育45 min。④金属筛过滤组织,滤液转移至无菌离心管中。⑤重复步骤④直到滤液不再浑浊。⑥收集所有的滤液4℃,600×g,离心10 min后使用25%的Percoll溶液重悬沉淀。⑦4℃,600×g,离心30 min后再次使用25%的Percoll溶液重悬沉淀。⑧将⑦中的溶液加入到等体积的44%的Per coll溶液上层,向44%的Percoll溶液下层加入等体积的66%的Percoll溶液。⑨4℃,600×g,离心30 min后收集44%~66%溶液层之间的细胞即为上皮内淋巴细胞。
1.2.2 CD3+T细胞的分离
①使用含1%BSA的PBS重悬提取的上皮内淋巴细胞并计数,加入猪CD3抗体(LS-C21558,LSbio),避光条件下0℃孵育30 min。②使用含1%BSA的PBS重悬细胞后离心,条件为4℃,600×g,5 min,离心完成后弃掉上清液。③按照制造商使用说明将适量R-PE IMag Particles-DM E31-1459磁珠与细胞均匀混合,在避光的条件下,于0℃孵育30 min。④使用1×BD IMaGTU缓冲液调整细胞浓度至约5×107个/mL,然后将细胞溶液转移至新的流式管中,置于磁力架上8 min。⑤将上清移至新管,加入等量1×BD IMaGTU缓冲液,移液器吹打混匀,放回磁力架上,静置4 min。⑥将上清与⑤步上清合并,其中的细胞为CD3-细胞。⑦流式管中加入1×BD IMaGTU缓冲液,移液器吹打混匀,该细胞为CD3+T细胞。⑧细胞培养采用RPMI-1640培养基(含10%胎牛血清),培养条件为37℃,5%CO2。
1.2.3细胞纯度和活性检测
7-AAD是一种核酸染料,可用于在流式细胞术中鉴定死细胞。对提取的细胞进行7-AAD染色,避光条件下孵育10 min,流式细胞仪检测其活性(7AAD-)和纯度(CD3+)。
1.2.4 CD3+T细胞佛波酯刺激试验
向提取的CD3+T细胞中加入终浓度为150 nmol/L的佛波酯,诱导24 h后提取细胞RNA用于后续检测。
1.2.5细胞RNA的提取
①在细胞中加入1 mL Trizol,移液枪吹打混匀后静置10 min。②每管加250μL氯仿,混匀后室温下静置3 min后离心,离心条件为4℃,12 000 r/min,5 min。 ③吸取上层水相600μL至新的离心管,加入600μL异丙醇,吹打混匀,-20℃静置8 h。④取出离心,离心条件为4℃,12 000 r/min,30 min,吸弃上清液。⑤75%乙醇重悬沉淀后离心,离心条件为4℃,12 000 r/min,5 min,吸弃上清液。⑥室温静置约5 min待残余的乙醇完全挥发。⑦加入适量DEPC水溶解RNA,轻轻吹打混匀,测定样品的RNA浓度和纯度,置于-80℃贮存。
1.2.6 qRT-PCR
提取的RNA使用HiScript III RT SuperMix for qPCR(+gDNA wiper)逆转录试剂盒按制造商的使用说明逆转成cDNA后用于实时荧光定量PCR。反应条件设置:预变性(95℃×3 min);扩增45个循环(95℃×15 s,60℃×30 s,72℃×30 s)。针对GeneBank中GAPDH、CD3、IFN-γ和GZMB的序列设计引物,引物由生工生物工程(上海)股份有限公司合成。引物序列见表1。

1.2.7数据统计和分析
本研究中试验数据均以“平均值±标准差”的方式表示,其中N表示每组的样本数,统一使用Graphpad Prism 9科学统计软件进行分析。双样本组间显著性差异采用two-tailed unpaired t test,P<0.05即表示差异有统计学意义。其中,***代表P<0.001,****代表P<0.0001。
2结果
2.1提取的CD3+T细胞活性和纯度
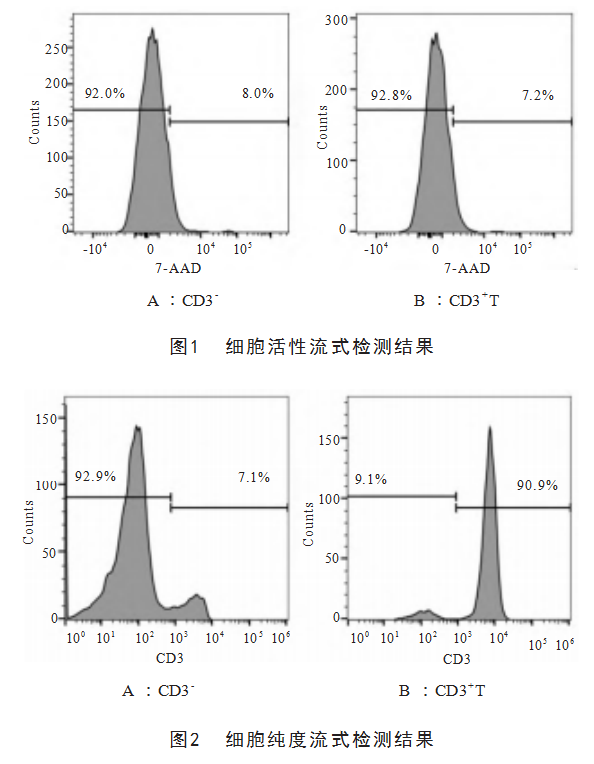
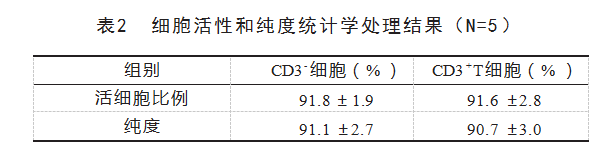
图1是2种细胞7-AAD染色的活性流式检测结果。提取的CD3-细胞和CD3+T细胞中活细胞的比例分别为91.8%±1.9%和91.6%±2.8%。图2是这2种细胞的CD3染色纯度流式检测结果。根据CD3的阳性率,CD3+T细胞的纯度达到90.7%±3.0%。表2为提取的CD3-细胞和CD3+T细胞的细胞活性和纯度统计学处理结果,该结果表明提取的2种细胞具有较高活性和纯度。
2.2提取的细胞CD3 mRNA表达量
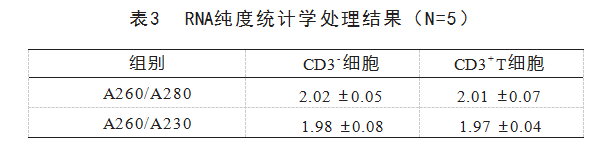
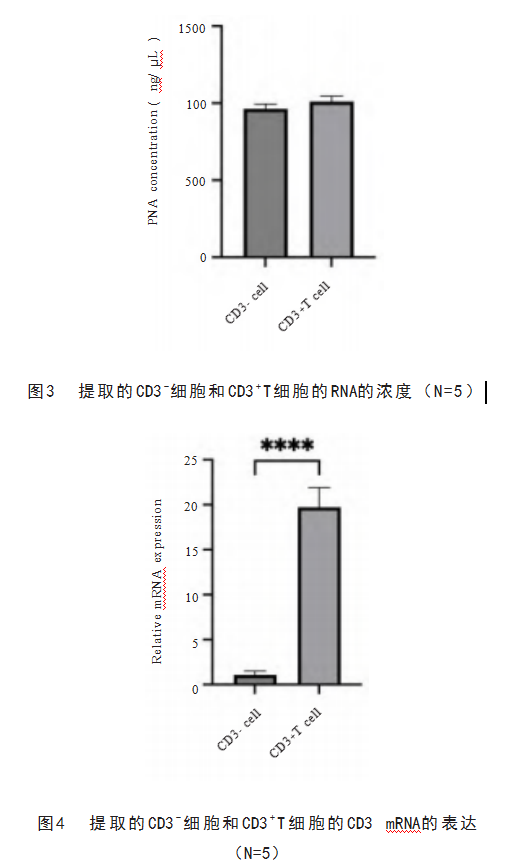
接下来对提取的细胞RNA纯度和浓度进行测定。见表3,CD3-细胞和CD3+T细胞的A260/280比值分别为2.02±0.05和2.01±0.07,A260/A230比值分别为1.98±0.08和1.97±0.04,所提取的RNA的纯度较高。此外,RNA的浓度也均高于900 ng/μL,见图3。这些结果表明在提取和分离过程中RNA未受到严重破坏。之后检测了2种细胞的CD3基因的mRNA水平。从图4中可以看出CD3+T细胞的CD3表达水平远高于CD3-细胞,同样表明该提取方法分离和纯化CD3+T细胞的效果较好。
2.3 CD3+T细胞佛波酯刺激试验
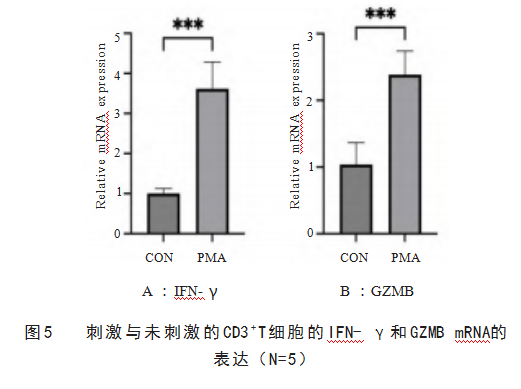
CD3+T细胞在佛波酯刺激后提取RNA以分析细胞因子IFN-γ和GZMB的表达情况。从图5可以看出,在诱导刺激24 h后,与未刺激组(CON)相比,PMA刺激组IFN-γ和GZMB mRNA的表达明显升高。这些结果表明提取的CD3+T细胞具有较高的活性,可用于后续病毒感染实验的研究。
3讨论
CD3+T细胞是PEDV从肠道部位转移至乳腺的关键环节,通过分离CD3+T细胞,可以为进一步研究PEDV的致病和传播机制提供重要细胞模型。本文采用免疫磁珠法分离CD3+T细胞。PE偶联的CD3抗体可与细胞表面特有的CD3受体结合,随后再与加入的PE磁珠结合,在外加磁场中,通过抗体与磁珠相连的细胞被滞留得以分离。免疫磁珠法可以分离出纯度较高的细胞群体,确保可以获得较高产率的CD3+T细胞,保障了后续试验的可重复性。
CD3+T细胞的活性是判断纯化方法是否需要进一步优化的重要指标。在细胞纯化过程中,机械力、酶和溶剂等因素都会影响最后得到的细胞的活性。流式细胞术和qRT-PCR可分别用于判断细胞表面CD3受体水平和mRNA稳定性。良好的活性能够有效保障试验结果的可靠性。
CD3+T细胞是否保持与生理条件下一致的生理特性是决定后续能否用于研究PEDV与CD3+T细胞互作的重要因素。通过佛波酯刺激,随后对标志性基因的表达变化进行检测是一种有效的判断细胞特性的方法。总之,CD3+T细胞的纯化对PEDV的研究是不可或缺的,这有助于解释PEDV感染和传播的具体机制,还可用于筛选抗PEDV药物,有望为猪病防治策略提供依据。
参考文献
[1]Jung K,Saif L J,Wang Q.Porcine epidemic diarrhea virus(pedv):An update on etiology,transmission,pathogenesis,and prevention and control[J].Virus Res,2020,286:198 045.
[2]Shamsi T N,Yin J,James M E,et al.Porcine epidemic diarrhea:Causative agent,epidemiology,clinical characteristics,and treatment strategy targeting main protease[J].Protein Pept Lett,2022,29(5):392-407.
[3]Lin F,Zhang H,Li L,et al.Pedv:Insights and advances into types,function,structure,and receptor recognition[J].Viruses,2022,14(8):1 744.
[4]Li W,Li H,Liu Y,et al.New variants of porcine epidemic diarrhea virus,China,2011[J].Emerg Infect Dis,2012,18(8):1 350-1 353.
[5]Yuan C,Zhang P,Liu P,et al.A novel pathway for porcine epidemic diarrhea virus transmission from sows to neonatal piglets mediated by colostrum[J].J Virol,2022,96(14):e0 047 722.
[6]Sun R Q,Cai R J,Chen Y Q,et al.Outbreak of porcine epidemic diarrhea in suckling piglets,China[J].Emerg Infect Dis,2012,18(1):161-163.










