梅花鹿源大肠杆菌论文
2024-04-29 11:03:16 来源: 作者:zhoudanni
摘要:梅花鹿养殖具有非常高的经济效益[1] 。近年,随着 人们健康养生观念逐渐提高,对梅花鹿产品的需求逐渐 增加,梅花鹿养殖业迅猛发展。从梅花鹿身上得到的鹿 茸、鹿肉、鹿胎、鹿骨和鹿鞭具有独特的营养价值和经济价值[2] 。大肠杆菌作为耐药基因的主要储存库,在耐药基因的传播中发挥着重要作用, 一旦产生耐药性极有 可能水平传递给体内其他细菌,因此大肠杆菌常被作为 耐药菌流行病学调查的重要指示菌[3] 。
摘要:为分析黑龙江省梅花鹿源产超广谱β-内酰胺类酶(ESBLs)大肠杆菌耐药基因的分布情况,为临床抗微生物药的合 理使用提出指导意见。从黑龙江省4个养殖场中分离出130株梅花源大肠杆菌,采用K-B纸片法,结果显示对诺氟沙星、环 丙沙星、氧氟沙星的耐药率达到10%以上。采用PCR技术对ESBLs基因进行检测。结果显示,耐药基因OXA、TEM的检出 率分别为13.85%( 18/130 )、76.15%( 99/130 ),CTX-M和SHV均未检出。 4个养殖场的ESBLs基因以TEM为主。
关键词: 梅花鹿,ESBLs,大肠杆菌,耐药表型
0 引言
梅花鹿养殖具有非常高的经济效益[1] 。近年,随着 人们健康养生观念逐渐提高,对梅花鹿产品的需求逐渐 增加,梅花鹿养殖业迅猛发展。从梅花鹿身上得到的鹿 茸、鹿肉、鹿胎、鹿骨和鹿鞭具有独特的营养价值和经 济价值[2] 。大肠杆菌作为耐药基因的主要储存库,在耐 药基因的传播中发挥着重要作用, 一旦产生耐药性极有 可能水平传递给体内其他细菌,因此大肠杆菌常被作为 耐药菌流行病学调查的重要指示菌[3] 。所以对梅花鹿大 肠杆菌多重耐药菌株的药敏试验分析可以为养鹿场临床 用药提供指导意见。在本次试验中,采集黑龙江的4个 养殖场健康梅花鹿的新鲜粪便,从中都分离鉴定出 130 株大肠杆菌,进一步对耐药株进行产ESBLs大肠杆菌的耐药基因分析,为临床用药提供理论依据。
1 材料
1.1 菌株
从黑龙江省4个梅花鹿养殖场采集新鲜粪便样本, 运回实验室后进行细菌的分离培养和鉴定,最终获得 130株大肠杆菌。
1.2 试剂和仪器
10 ×Buffer 、dNTP 、rTaq 、DNA Maker等均购于宝 生物有限公司; PCR检测仪,德国Biometra公司产品; 凝胶成相分析系统,美国Alpha Imager2200公司产品。
2 方法
2.1 PCR扩增模板的制备
将130株梅花鹿大肠杆菌接种于LB琼脂液体配培养基构成混合样本,置于37 ℃摇床180 r/min培养3 h,然 后在37 ℃恒温箱中培养12 h获得一定浓度的菌液。
2.1.1 PCR反应体系
25 μ L 反应体系配置:去离子水加入 18 μ L , 10×Buffer加入2.5 μL , dNTP加入2.0 μL,上游、下 游2条引物各加入0.5 μL ,rTaq加入0.25 μL,样本模板 DNA加入2 μL。130株样本均进行体系配置后, 将其摇匀后放入 PCR仪器中进行扩增。
2.1.2 耐药基因的检测
对PCR扩增产物采用琼脂糖凝胶电泳法观察结果。
2.2 药物敏感性试验
参照美国临床实验室标准化协会(CLSI)规定的试 验步骤和标准[4] ,采用Kirby-Bauer纸片扩散法,统计130 株梅花鹿源大肠杆菌对12种抗生素的敏感率、中介率、 耐药率。
试验材料包括 12种药敏纸片:β-内酰胺类的氨苄西 林( AMP )、头孢他啶( CAZ )、氨曲南(ATM ), 氨基糖苷类的庆大霉素(CN)、卡那霉素(K)、阿米 卡星(AK),喹诺酮类的诺氟沙星(NOR)、环丙沙 星(CIP)、氧氟沙星(OFX),四环素(TE),氯霉 素(C)和磺胺类的复方新诺明( SXT )。
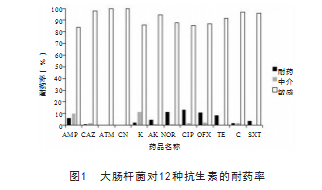
3 结果
3.1 鹿源大肠杆菌耐药表型检测结果
当质控菌株的抑菌环处于CLSI规定的标准范围之内 时,结果才有效,见图1 。 130株大肠杆菌中,对所有的 药物的敏感率都达到了80%以上,对于AMP 、K的中介 率达到10%,耐药率方面,对NOR 、CIP 、OFX的耐药 率达到了10%以上,其余药类的比率都在10%以下。
3.2 耐药基因检测结果
以梅花鹿源大肠杆菌的 DNA 为模板 PCR 扩增 CTM-X、SHV、OXA和TEM的基因片段,经琼脂糖凝 胶电泳, CTM-X、SHV均为无, OXA和TEM分别得到 198 、717 bp的条带,同预期相符,结果见图2、图3 。 检测到产ESBLs菌株的OXA型和TEM型,检出率分别为 13.85% 、76.15%。
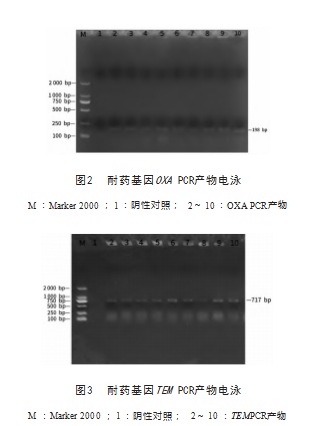
4 讨论
作为条件性致病菌的大肠杆菌当动物处于气候条件 突变,饮食健康改变等情况下容易引发动物出现多种炎 症疾病[5] 。抗生素药物已然成为全球范围内治疗临床疾 病和保持动物健康和生产能力的宝贵工具[6] 。细菌耐药 性的增强、耐菌谱的增宽与抗生素的滥用有着直接的 关系,这就导致对多重高度耐药菌的抑制与杀灭变得更 困难。
产超广谱β-内酰胺酶(ESBLs)大肠杆菌是一种在 β-内酰胺类药物的持续作用压力下变异而能够产生β - 内酰胺酶的肠杆菌科细菌,它的出现是引起大肠杆菌耐 药的主要原因之一,因为产ESBLs菌株可携带氨基糖苷 类、氟喹诺酮类等多种耐药基因。 TEM型的ESBLs产生 的酶保持着能够水解第3代头孢菌素的能力[7-8] , 并可 在人与动物间迅速传播 [9-10] ,危害人畜共同的公共卫生安全。
在本次试验中,选取的基因包括TEM和OXA ,其 中携带率最高的为TEM型,共有99株,占76.15%;携 带OXA型的检出率有13.85%( 18/130 )。TEM型相较于 OXA型检出率高得多,说明TEM型为黑龙江地区梅花鹿 源产ESBLs大肠杆菌的主要流行基因型。王杰等[11] 的河 南省奶牛产ESBLs大肠杆菌的流行和耐药性分析报道中 表明, CTX-M型基因的检出率为100%,仅在1个农场的 2个分离株中含有TEM型。 Zhang Y L等[12]在川渝地区肉 牛检出的109株产ESBLs大肠杆菌中, TEM型占39.4%,OXA型占29.4%,但是菌株依旧以单CTX-M型为主, 占 比55%。杨守深等[13]在福建猪源ESBLs的TEM和OXA基 因型检出率分别为12.1% 、7.5%。说明在近五年全国范 围内, TEM型和OXA型在各种养殖动物中几乎广泛存 在,近年在国外野生鹿中有不同情况的检出结果。德国 东北部野生动物的产ESBLs的大肠杆菌调查显示所有分 离株均存在CTX-M型, 而没有检出TEM或OXA型, 野 生动物的耐药性普遍低于农场动物[14] 。在波兰的野生马 鹿中分离出TEM型,但在小鹿中尚未鉴定出引起ESBLs 耐药的基因[15]。
梅花鹿源大肠杆菌对12种抗生素的耐药率普遍偏 低,都在20%以下;其中,耐药率较高的抗菌药物为氨 基糖苷类药物和喹诺酮类药物,对于诺氟沙星、环丙沙 星、氧氟沙星,分别为11% 、 14% 、 10%,与产ESBLs 大肠杆菌特性相符。氨苄西林、头孢他啶、氨曲南、庆 大霉素、卡那霉素、阿米卡星、四环素、氯霉素、复方 新诺明的耐药率均在10%以下。其中,氨曲南、庆大霉 素的耐药率为0.说明黑龙江省梅花鹿源产ESBLs大肠 杆菌对这几类药物均处于低耐药水平。综合来看,建议 养鹿场通过药敏试验筛选敏感药物治疗患病梅花鹿,而 不是随便使用抗菌药物,导致耐药,造成更大损失[16]。
梅花鹿人工养殖效益十分可观,现状呈整体良好趋 势。对黑龙江地区梅花鹿源的大肠杆菌进行耐药情况检 测,掌握其多重耐药趋势,据此来制定合理的药物使 用方式对临床治疗工作进行指导,才能对耐药菌进行更 好的预防与控制[17] 。从业人员掌握科学而规范的养殖技 术,根据养殖场地面积的大小,选择合适的养殖密度, 提高环境卫生水平,是确保梅花鹿健康、安全生长,保 障养殖收益的关键。
参考文献
[1] 王茵,徐楠,王彦雨,等. 2023梅花鹿产业高质量发展大会 在我市召开[N]. 辽源日报, 2023-09-08( 001 ).
[2] 刘书杰,张娜,李宁. 梅花鹿养殖技术与发展前景[J]. 中国 畜禽种业, 2022 , 18( 6 ): 129-131 .
[3] Angulo F J ,Heuer O E ,Hammerum A M , et al. Human Health Hazard from Antimicrobial-Resistant Enterococci in Animals and Food[J]. Clinical Infectious Diseases ,2006 ,43( 7 ):911-916 .
[4] 王永亮. 吉林省部分地区动物源大肠杆菌耐药性及多重耐药 株全基因组序列分析[D]. 长春:吉林农业大学, 2023 .
[5] Yang H C , Chen S ,White D G , et al. Characterization of multiple-antimicrobial-resistant Escherichia coli isolates from diseased chickens and swine in China[J]. Journal of clinical microbiology ,2004 ,42( 8 ):3 483-3 489 .
[6] Zhao L ,Dong H Y ,Wang H. Residues of veterinary antibiotics in manures from feedlot livestock in eight provinces of China[J] .Science of the Total Environment ,2010 ,408( 5 ): 1 069- 1 075 .
[7] Lago A ,Fuentefria R S , Fuentefria B D. Enterobactérias produtoras de ESBL em Passo Fundo ,estado do Rio Grande do Sul ,Brasil ESBL-producing enterobacteria in Passo Fundo , state of Rio Grande do Sul ,Brazil[J]. Revista da Sociedade Brasileira de Medicina Tropical ,2010 ,43( 4 ):430-434 .
[8] Paterson D L , Bonomo R A. Extended-spectrum beta - lactamases: a clinical update[J]. Clinical Microbiology Reviews ,2005 , 18( 4 ): 657-659 .
[9] 孙红洋,姜子楠,沈昕,等. 2018年中国兽用抗菌药物使用 情况报告[C]//中国畜牧兽医学会兽医药理毒理学分会第十五 次学术讨论会论文集, 2019 .
[10] Li S ,Qu Y ,Hu D ,et al. Comparison of extended spectrum β-lactamases-producing Escherichia coli with non-ESBLs- producing E. coli :rt drug-resistance and virulence[J]. World J Emerg Med ,2012 ,3( 3 ):208-212 .
[11] Wang J ,Zhu X J ,Zhao Y X ,et al. Prevalence and antimicrobial resistance of Salmonella and ESBL E. coli isolated from dairy cattle in Henan Province , China[J]. Preventive veterinary medicine ,2023 ,21( 3 ):213-215 .
[12] Zhang Y L ,Huang F Y ,Gan L L ,et al. High prevalence of blaCTX-M and blaSHV among ESBL producing E. coli isolates from beef cattle in China's Sichuan-Chongqing Circle[J] .Scientific Reports ,2021 , 11( 1 ): 137-140 .
[13] Yang S S , Fan X , Jiang Y , et al. Prevalence of the oqxABdrug resistance gene in Escherichia coli of pig origin in Fujian[J]. Chinese Journal of Zoonoses ,2023 ,39( 2 ): 185- 191 .
[14] Homeier-Bachmann T , Schütz A , Sylvia D ,et al. Genomic Analysis of ESBL-Producing E. coli in Wildlife from North- Eastern Germany[J]. Antibiotics ,2022 , 11( 2 ): 123-126 .
[15] Dariusz W , Magdalena Z ,Anna L , et al. Antimicrobial Resistance in Escherichia coli Isolated from Wild Animals in Poland[J]. Microbial drug resistance( Larchmont ,N. Y. ), 2017 ,24( 6 ): 812-816 .
[16] 于莹,陈立志,王红梅,等. 鹿源大肠杆菌的分离鉴定及生 物学特性[J]. 中国兽医学报, 2020 ,40( 3 ): 530-534 .
[17] 王宏. 牛源大肠杆菌耐药性及耐药机制研究[D]. 哈尔滨:东 北农业大学, 2012 .










