不同染色剂对猪精子形态呈现效果的比较分析论文
2024-04-28 09:44:46 来源: 作者:zhoudanni
摘要:精子形态学是反应公畜繁殖能力的一项重要指标, 研究结果表明,精子的形态与精子的功能密切相关,精 子形态发生异常性变化,就会影响精子的正常受精能力。精子形态所表现出的生物学特性均与受精有着密切的关系。
摘要:该试验旨在探究不同染色剂对猪精子形态呈现效果的对比分析,试验选取3种染色剂(姬姆萨染色法、伊红苯胺黑染 色法、精子蓝染色剂染色法)对长白猪精液开展精子染色。结果显示,精子蓝染色剂染色剂法猪精子头部和精子尾部染色 效果最佳,精子头部轮廓和顶体清晰,精子形态呈现效果优于姬姆萨染色法和伊红苯胺黑染色法。综上可知,猪精子形态 的呈现效果与染色液的染色效果有一定关系,精子蓝染色剂染色在猪精子形态的呈现上效果最佳, 为检测人员更好的了解 精子形态,更好的判断区分正常精子和畸形精子打下坚实基础,为质检人员在未来精子染色剂的选择上提供理论借鉴。
关键词: 长白猪,不同染色法,精子形态,比较分析
0 引言
精子形态学是反应公畜繁殖能力的一项重要指标, 研究结果表明,精子的形态与精子的功能密切相关,精 子形态发生异常性变化,就会影响精子的正常受精能 力。精子形态所表现出的生物学特性均与受精有着密切 的关系。近年,人们越来越注意到对种用公畜精子形态 变化的监测和评价。公畜的精子呈蝌蚪状,由头部、颈部和尾部3个主要部分构成[1] ,头部和尾部较长,是 精子的主要部分,颈部短小。精子头部一般呈扁圆形, 在头部细胞核的前面,有一个类似帽子状的双层结构, 成为顶体。精子头部主要由细胞核构成,内含遗传物质 DNA ;精子的颈部位于精子头部的基部,其前端凸起的 帽状部分与头部下方呈螺母状的凹部互相契合,将精子 的头部和尾部连接在一起;尾部是精子的运动器官。
家畜精液中精子所具有的生物学特性与母畜受精 有密切的关系[2] ,其中精子形态是评价精液质量必不可 少的一项技术参数[3] 。公畜精子形态的类型没有统一标 准,按照常规习惯分为正常精子和异常(畸形)精子。 对精子形态的判断需要对精子结构了解,通过对精子染 色然后在显微镜下观察来判断精子是正常精子还是畸形 精子,是否畸形和顶体是否完整。通过多年在精液质量 检测的研究发现,不同染色剂对精子形态的判断有很大 影响,根据精子的染色情况借助显微镜观察判断精子顶 体的完整情况、整体形态情况,可将精子分为正常精子 和畸形精子,由此可见染色法的选择对于精子形态的判 断尤为重要。本文通过不同染色剂的对精子的染色效果 开展对比研究,将染色后精子形态呈现的效果进行对比 分析,观察精子头部的顶体形态、精子尾部形态,选择 出一种方便简洁、客观评价实用性高、经济实惠的猪精 子染色法,为今后科研、质检人员对猪精子染色液的选 择提供理论依据,为更好更精准的判断精子形态客观反 应精液质量和受精能力奠定基础,染色方法的确定对精 液质量的评估有着重要意义。
1 材料与方法
1.1 试验动物
试验动物来自贵州省内种公猪站养殖的成年种公 猪,试验选取长白猪为研究对象,采集精液2份,公猪 精液满足鲜精精子活力≥70%、精子畸形率≤20%、公 猪利用率≥88% ,对精液抹片染色显微镜下观察其形态。
1.2 仪器设备与试剂
精子质量分析系统( Mini tube) 、正置显微镜 ( Olympus )、电子秤(天津精诚)、载玻片、移液 枪( Eppendorf )、姬姆萨( Giemsa )、伊红苯胺黑 ( eosin-nigrosin)、精子蓝染色剂(spermbluer)。
1.3 试验方法
1.3.1 姬姆萨染色法
( 1 )精子涂片的制备。采取拉片法,准备干净的 载玻片,取鲜精或者稀释后的精液样品5 μL滴于载玻片 的一端,另一个载玻片与精液样品呈35°夹角接触,使 精液样品均匀地接触载玻片然后轻轻拖拽,平放抹片使 其自然风干,每个样品制作2张涂片。涂片制作见图1.
(2)精子涂片的固定。在风干的抹片上滴1.0 ~2.0 mL 中性福尔马林固定液,固定15 min后用清水缓冲去固定 液,放置自然风干。
( 3 )精子涂片的染色。将固定好的抹片反扣在带 有平槽的有机容器内,把姬姆萨染料滴于槽和抹片之 间,让其充满整个平槽使抹片充分和染液接触,染色1.5 h后用清水缓冲去染液,自然风干待观察。
(4)精子形态观察。调试显微镜在400倍下,放置染片观察精子形态,每个抹片观察若干个视野,移动抹 片(分左、中、右3个区),累计观察200个精子,区分 正常精子和畸形精子。对视野中的精子观察按照从左上 开始→右,再向下层左→右,如此重复,不会有遗漏, 如果精子某个部分超出视野,无法判断时,不计入观察 数, 一边观察一边计数。 一般先观察精子头部,先观察 精子头部是否正常,后续在继续观察精子其他部位(颈 部、中段、主段、终段和原生质滴等)。
1.3.2 伊红苯胺黑染色法
( 1 )精液样品的前处理。将新鲜精液样本置于 37 ℃恒温箱或水浴锅中30 min使精子充分液化,清 摇混匀。
( 2 )精子染色。取1.5 mL离心管,滴加新鲜精液1 滴( 5 ~ 10 μL)和等量的伊红染色液,混匀放置15 s , 滴加苯胺黑染色液2滴( 10 ~ 20 μL ),混匀,放置 15 ~ 30 s。
( 3 )涂片制备。滴加混匀的精液伊红苯胺黑样品 1 滴( 5 ~ 10 μL)于载玻片上,制成涂片,晾干。
(4)精子形态观察同姬姆萨染色法。
1.3.3 精子蓝染色剂(spermbluer)染料法
( 1 )精子涂片的制备同姬姆萨染色法。
( 2 )精子涂片的染色。采用精子蓝染色剂染料。 将固定好的抹片反扣在带有平槽的有机容器内,将精子 蓝染色剂染料滴入槽和抹片之间,让其充满整个平槽使 抹片充分和染液接触,染色40 min后用清水浸泡片刻后 取出自然风干待观察。
( 3 )精子形态观察同姬姆萨染色法。
2 结果
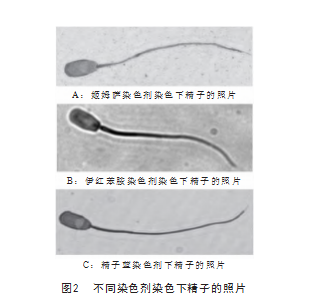
由图2可知,采用3种染色剂对长白猪分别进行染 色,观察精子形态效果。精子头部形态结构轮廓呈现效 果,精子蓝染色剂染色优于姬姆萨染色和伊红苯胺黑染 色。精子头部顶体轮廓清晰度,精子蓝染色剂染色优于 姬姆萨染色和伊红苯胺黑染色,精子尾部染色效果精子 蓝染色剂染色优于姬姆萨和伊红苯胺黑。
3 讨论
3.1 姬姆萨染色法
精子形态在精子竞争和精子进化中具有重要地位[4] , 精子形状是影响精子运动和授精能力的重要因素[5] 。精 子形态的呈现其中精液染色方法起到关键的作用,因此 染色方法的选择至关重要,有研究人员报道指出,有的 染色方法对一个物种很有效,但不适用于另一个物种。 染色技术应尽可能少地干扰精子的结构,同时尽可能详 细地揭示其形态,因此在确定最佳染色方法及其参考值 之前确定未染色精子头部的自然尺寸至关重要[6] 。肖婉 芬等[7]研究姬姆萨染色法与巴氏染色法对精子形态染色 效果的对比,结果表明,姬姆萨染色法是一种简单有效 的精子形态染色方法。国内对于种畜精子形态的检验方 法,在种猪常温精液GB23238—2021[8] 、牛冷冻精液GB 4143—2022[9] 、山羊冷冻精液GB20557—2006[10]等标准 中都有应用姬姆萨染色法。
3.2 伊红苯胺黑染色法
伊红苯胺黑染色法曾是作为常规检测精子存活力的 方法,通过染料拒染法来鉴别细胞膜完整性的精子,从 而得出活精子的百分率。其原理是利用活精子对特定 染料不着色的特点来区死、活精子,显微镜下活精子不 着色(无色),死精子呈粉红色,苯胺黑为背景衬托, 以此作为目测评定精子活力的校正参考。在新的种猪常 温精液GB23238—2021标准中提出以伊红苯胺黑染色法 为快速染色方法,在400倍显微镜下观察精子形态和轮 廓,但对于精细胞膜的变化,特别是头部、顶体部和尾 部细胞膜的损伤和缺陷,与姬姆萨染色法比较,难以清 晰显示[3] ,这一结论与本试验一致。
3.3 精子蓝染色法
国外研究学者研究发现,染色方法显著影响公猪精 子头部的尺寸,精子蓝染色剂染色的精子具有与未染色精子最接近的形态测量精子参数[6] 。精子形态判断染色 方法的选择,应优先考虑操作简单、染色效果最佳的方 法,保证精子形态的准确性。在染色过程中,应注意对 精子的保护,避免染色液中的成分、环境温度、 pH值、 渗透压等物理因素对精子形态造成损伤。本研究通过3 种不同染色剂对公猪精子进行染色,观察形态呈现效果 并对比分析,结果表明精子蓝染色剂染色效果最佳,精子形态轮廓清晰,本研究结果与国外研究学者结果一致。
4 结论
通过3种染色方法对比分析,从精子染色效果精子 形态呈现上发现精子蓝染色剂染色效果最佳,姬姆萨染 液染色效果次之,伊红苯胺黑染色效果较差;但从经济 成本上看精子蓝染色剂价格较高,高于姬姆萨染液和伊 红苯胺黑染液;从简便操作和时间上看伊红苯胺黑要好 于精子蓝染色剂和姬姆萨染液。 3种染色液各有优势, 具体的选择可以根据实际情况进行选择。本研究的结果 可为后续开展公猪精子形态的测量奠定基础,为检测人 员更好的了解精子形态、更好的区分正常精子和畸形精 子打下坚实基础,为质检人员在未来精子染色剂的选择 上提供理论借鉴。
参考文献
[1] 陆汉希 .染色法评定精液品质的研究[J] . 广东畜牧兽医科 技, 1993(4 ):22-23 .
[2] 秦和春,金穗华.牛精液质量与受精率的关系[J] .畜牧与兽 医, 2007(4 ):29-30 .
[3] 杨文祥,孙政国,金穗华.家畜精(子) 细胞染色方法的比 较与评价[J] . 中国牛业科学, 2017 ,43( 3 ):24-26 .
[4] 程明阳,张勘, 梁福轩, 等.不同取样方式下大凉螈精子形 态变化[J] .动物学杂志, 2023(4 ):554-562 .
[5] 高广雄,赵云翔,朱琳, 等.不同品系杜洛克公猪精子品质 和形态学比较研究[J] . 国外畜牧学(猪与禽), 2019 ,39
( 6 ):71-74 .
[6] Magdalena C ,Katarzyna A ,Dorota B ,et al .The effect of the staining technique on morphological and morphometric parameters of boar sperm[J] .PLoS One ,2019 ,14( 3 ):e0 214 243 .
[7] 肖婉芬,谢文燕,李志凌,等 . 瑞氏-姬姆萨与巴氏染色 法对精子形态染色效果比较[J] .华中医学杂志, 2007 ,31( 6 ):436-438 .
[8] 种猪常温精液GB 23238—2021[S] .北京:中华人民共和国标 准化委员会.
[9] 牛冷冻精液GB 4143—2022[S] .北京:中华人民共和国标准 化委员会.
[10] 山羊冷冻精液GB 20557—2006[S] .北京:中华人民共和国标准化委员会.










