广西百色市2024年度羊Q热流行病学调查分析论文
2025-09-04 16:32:13 来源: 作者:xuling
摘要:为进一步了解目前百色羊Q热的流行情况,采用酶联免疫吸附试验和荧光定量PCR方法分别对采集自百色市12个县市区的410份羊血清、470份羊阴道棉拭子和50份的粪便样品进行Q热血清抗体和抗原检测。
摘要:为进一步了解目前百色羊Q热的流行情况,采用酶联免疫吸附试验和荧光定量PCR方法分别对采集自百色市12个县市区的410份羊血清、470份羊阴道棉拭子和50份的粪便样品进行Q热血清抗体和抗原检测。结果显示,12个县市区410份羊血清的总体Q热抗体阳性率为27.8%;470份阴道棉拭子的总体Q热病原核酸阳性率为9.79%,50份粪便总体Q热病原核酸阳性率为0。研究说明,百色市12个县市区存在不同程度的Q热感染,相关部门应加强重视,并采取有效措施,构建完善的人兽共患病防控体系。
关键词:Q热;流行病学;分析0引言
Q热(Query fever)是由贝氏柯克斯体引起的一种广泛分布全球的人畜共患病,家畜主要发生于山羊、绵羊和牛,常以隐性感染和亚临床感染为主。最早报道于1935年澳大利亚昆士兰,1950年我国首次发现,随后在我国很多地区都有报道。当人类感染Q热症后会出现畏寒、发热、剧烈头痛等一系列问题。随着病情进展,还会导致慢性肝炎、心内膜炎或是骨髓炎等[1]。家畜感染Q热后,症状通常不明显[2]。然而,感染可能导致孕畜出现流产、产下死胎或弱胎,以及不育等繁殖障碍问题。此外,感染后家畜可能长期携带病原体,而自身并不表现出明显症状[3]。1950年我国首次发现Q热,随后国内多个省市都对Q热的流行进行报道,1989年,广西地区羊Q热抗体检测阳性率高达16.6%[4]。2017—2018年,这一比例上升至18.62%。2020年,广西4个地市的羊Q热抗体阳性率进一步增至20.14%[5]。为对百色市羊Q热的传播情况深入探析,本研究对全市12个县市区羊的血清和组织样本进行了Q热血清抗体及抗原的检测。
1材料与方法
1.1检验样品
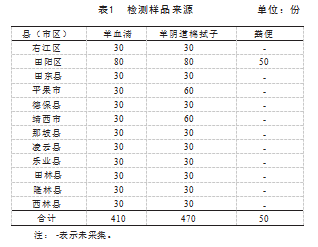
在百色市下属12市县区取样(采样羊并未接受过免疫Q热疫苗)。样品1:410份羊血清;样品2:470份羊阴道棉拭子;样品3:50份粪便,具体结果见表1。
1.2检验试剂
试剂盒1:Q热立克次氏体ELISA抗体检测试剂盒(多物种),艾迪威(青岛)生物科技有限公司(批号N4505)提供;试剂盒2:荧光定量PCR试剂盒,宝生物工程(上海)有限公司(批号CJAX213)提供。
1.3主要仪器设备
仪器1:LabServ K3型酶标仪,飞世尔实验器材(上海)有限公司提供;仪器2:LightCycler 96型实时荧光定量PCR仪,罗氏诊断产品(上海)有限公司提供。
1.4血清Q热抗体检测
根据Q热立克次氏体ELISA抗体检测试剂盒说明书,采用间接酶联免疫吸附试验进行血清Q热抗体检测。试验成立条件:阳性样本的平均光密度(OD值)>0.350,阳性样本的平均OD值/阴性样本平均OD值>3。
S/P=(OD样本-ODNC)/(ODPC-ODNC)×100%
试验结果判定:阴性:样品S/P值≤40%;可疑(需要复检):40%<样品S/P值在≤50%;阳性:50%<样品S/P值≤80%;强阳性:样品S/P值>80%。
1.5病原学检测
病原检测:采用的荧光定量PCR技术[6],由OIE陆生动物诊断与疫苗手册推荐。针对Q热/S1111的特异性靶基因,设计并合成引物和探针(表2),由北京擎科生物科技股份有限公司提供试剂。操作步骤严格按照按照试剂盒说明书进行。

荧光定量PCR反应体系配置:12.5μL的2×One step RT-PCR Buffer,0.5μL的上、下游引物,0.25μL的探针,以及8.25μL的无菌蒸馏水。
荧光定量PCR反应流程:初始温度50℃,反应2min;调整温度至95℃,反应10 min;进入循环阶段:95℃下10 s,60℃下1 min,共进行45个循环;最后在72℃条件下延伸45 s。
试验成立条件:若阴性对照孔出现阳性反应,或者阳性对照孔未检测到相应的CT值,则该试验结果无效,需重新进行检测。阳性对照CT值需≤30且出现特异性扩增曲线。
试验结果判定:CT值≤38的判为阳性,CT值>38的判为阴性。
2结果与分析
2.1羊血清Q热抗体检测结果
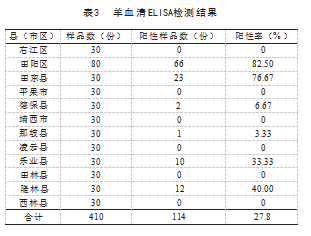
ELISA结果显示,12个县市区间的Q热的发生情况差异较大,羊Q热抗体阳性率范围分别从0~82.5%,12个县市区以田阳区的抗体阳性率最高,达到82.5%,410份羊血清的总体Q热抗体阳性率为27.8%,见表3。
2.2荧光定量PCR检测结果
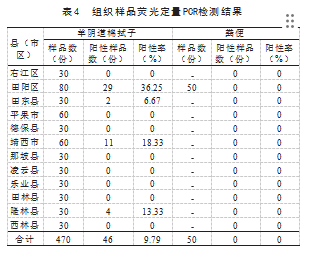
来自田阳区、田东县、靖西市及隆林县的阴道棉拭子的Q热病原核酸阳性率分别为36.25%、6.67%、18.33%及13.33%,田阳区的Q热病原核酸阳性率最高达36.25%。470份阴道棉拭子的总体Q热病原核酸阳性率为9.79%,50份粪便总体Q热病原核酸阳性率为0,见表4。
3讨论
3.1 Q热流行特征的区域差异
本研究显示,百色市12个县市区羊Q热血清抗体阳性率存在显著差异(0~82.5%),其中田阳区、田东县和隆林县抗体阳性率较高(分别为82.5%、76.67%和40.0%),而右江区、平果市、靖西市等地未检出阳性样本。这种空间分布异质性可能与以下因素相关。
养殖模式与环境条件:田阳区、田东县为百色市传统养殖密集区,高密度放牧增加病原传播风险。此外,Q热立克次体可通过气溶胶传播,潮湿、通风不良的圈舍环境会促进病原扩散。
媒介生物分布:蜱类等节肢动物是Q热的重要传播媒介,田阳区等地的气候条件(亚热带季风气候)更适宜蜱类滋生,加剧病原传播。
动物流动与防疫措施:田阳区作为区域内活畜交易枢纽,频繁的动物流动会引入外源性感染。而抗体阴性区域(如右江区)受益于更严格的生物安全措施或自然屏障阻隔。
3.2血清抗体与病原检出的关联性
尽管田阳区血清抗体阳性率最高(82.5%),其病原核酸阳性率(36.25%)也显著高于其他地区,提示该地区存在活跃的Q热感染循环。值得注意的是,田东县抗体阳性率高达76.67%,但病原核酸阳性率仅为6.67%,可能反映以下情况。
感染阶段差异:高抗体阳性率表明既往感染普遍,而低病原检出率提示急性感染已进入消退期,或宿主免疫系统有效控制了病原复制。
检测灵敏度差异:ELISA抗体检测可反映中长期免疫应答,而荧光定量PCR仅能检测急性感染期的病原核酸,二者时间窗口不同导致结果差异。
3.3阴道棉拭子与粪便样本的病原学意义
470份阴道棉拭子中,9.79%检出Q热病原核酸,而50份粪便样本均为阴性。这一结果与Q热立克次体的生物学特性相符。
主要传播途径:病原体可通过胎盘、羊水及阴道分泌物在分娩过程中大量释放,而粪便并非其主要排出途径。
环境耐受性:Q热立克次体在干燥环境中可形成芽孢样结构,阴道分泌物中的病原体可通过气溶胶长期污染环境,增加人畜共患风险。
3.4防控启示与建议
重点区域监测:对田阳区、田东县等高发区实施动态监测,尤其在繁殖季节加强羊群健康评估及环境消毒。
免疫策略优化:建议在抗体阳性率>40%的区域(如田阳区、隆林县)推广Q热疫苗免疫,降低流产率及病原扩散风险。
人员防护教育:针对养殖户、兽医等高风险人群开展Q热防控培训,强调个人防护(如佩戴口罩、手套)及生物安全管理。
4结论
本研究首次系统揭示了百色市羊Q热的流行现状,证实田阳区为区域性流行热点。血清学与病原学结果的综合表明,Q热在该地区呈现“高隐性感染率与局部活跃传播”并存的特征。未来需结合分子流行病学与生态学研究,深入解析传播动力学,为制定精准防控策略提供依据。
参考文献
[1]Kampschreur L M,Hoornenborg E,Renders N H M,et al.Delayed diagnosis of chronic Q fever and cardiac valve surgery[J].Emerging Infectious Diseases,2013,19(5):768-770.
[2]孙翔翔,朱琳,陈伟.Q热诊断技术研究进展[J].中国动物检疫,2019,36(5):57-60.
[3]崔君兆.广西人、畜Q热血清流行病学首次调查报告[J].中国人兽共患病杂志,1989(4):56.
[4]李军,吴翠兰,陶飞,等.广西部分地区牛羊三种人兽共患病的血清学调查与分析[J].黑龙江畜牧兽医,2020(4):66-70.
[5]冯淑萍,张培培,李春英,等.广西四个地市2020年牛、羊Q热流行病学调查与分析[J].上海畜牧兽医通讯,2021(3):42-44.
[6]Klee S R,Tyczka J,Ellerbrok H,et al.Highly sensitive real-time PCR for specific detection and quantification of Coxiella burnetii[J].BMC Microbiology,2006,6(1):2.










