含有抗凝剂的羊血液样品对酶联免疫吸附试验结果的影响论文
2025-03-26 11:51:34 来源: 作者:xujingjing
摘要:为了解肝素钠、柠檬酸钠、乙二胺四乙酸二钾(EDTA-K2)对酶联免疫吸附试验(ELISA)测定羊口蹄疫,小反刍兽疫,布鲁氏菌病病抗体结果的影响,笔者在辖区范围内12个乡(镇)的26个羊场,随机采集480份样本,离心分离得到相关血清、血浆样品,用液相阻断ELISA方法测定FMDO、FMDA抗体,阻断ELISA方法测定小反刍兽疫抗体,竞争ELISA方法测定布鲁氏菌病抗体。结果发现,3种抗凝剂对酶联免疫吸附试验测定羊O型口蹄疫、A型口蹄疫、羊小反刍兽疫、羊布鲁氏菌病均存在一定的影响,不能用含这3种抗凝剂的血液样
摘要:为了解肝素钠、柠檬酸钠、乙二胺四乙酸二钾(EDTA-K2)对酶联免疫吸附试验(ELISA)测定羊口蹄疫,小反刍兽疫,布鲁氏菌病病抗体结果的影响,笔者在辖区范围内12个乡(镇)的26个羊场,随机采集480份样本,离心分离得到相关血清、血浆样品,用液相阻断ELISA方法测定FMDO、FMDA抗体,阻断ELISA方法测定小反刍兽疫抗体,竞争ELISA方法测定布鲁氏菌病抗体。结果发现,3种抗凝剂对酶联免疫吸附试验测定羊O型口蹄疫、A型口蹄疫、羊小反刍兽疫、羊布鲁氏菌病均存在一定的影响,不能用含这3种抗凝剂的血液样本来评估以上3种疾病免疫效果。
关键词:抗凝剂;血浆;酶联免疫吸附试验
0引言
酶联免疫吸附试验由于敏感性高、特异性强、重复性好等特点,是目前政府评价动物抗体免疫效果的首选实验室方法。在动物疫病监测工作中,通常是血清学监测和病原学监测同时进行的,由于动物血清内病毒含量较少,病原学监测所用的血液样品都是抗凝全血,如果可以用抗凝全血分离所得血浆来代替血清评估羊病免疫抗体,就可节省采样时间和降低羊应激。肝素通过与抗凝血酶III结合产生抗凝效应,EDTA盐能结合血液中的钙离子形成稳定的螯合物,柠檬酸钠盐与血中钙离子形成可溶性螯合物[1],本文就肝素钠、柠檬酸钠、乙二胺四乙酸二钾对ELISA试验测定羊口蹄疫、羊小反刍兽疫、羊布鲁氏菌病病抗体结果影响开展试验。
1材料与方法
1.1材料
江苏康捷医疗器械有限公司生产的2 mL肝素钠静脉血样采集容器、1.8 mL添加1:9的3.2%的柠檬酸钠静脉血样采集容器、2 mL添加乙二胺四乙酸二钾(EDTA-K2)的静脉血样采集容器;1.5 mL防爆离心管;96孔U型底酶标稀释板;200μL移液吸头;10μL移液吸头等。
1.2试剂
口蹄疫O、A型抗体液相阻断ELISA检测试剂盒,兰州兽研生物科技有限公司生产;小反刍兽疫阻断ELISA检测试剂盒,青岛立见生物科技有限公司;布鲁氏菌病竞争ELISA抗体检测试剂盒,青岛立见生物科技有限公司生产。
1.3仪器设备
台式离心机,全自动*孔板洗板机,酶标仪,定温恒温干燥箱,200、100、10μL单道*量移液器,100μL多道*量移液器。
1.4样品的制备
在12个乡/镇的26个羊场随机采集480只羊颈静脉血液,分别注入普通管、肝素钠抗凝管、柠檬酸钠抗凝管、EDTA-K2抗凝管各2~3 mL,采集抗凝血时要采集边颠倒混匀7~8次,让抗凝管内抗凝剂和血液充分混匀。采集完毕后将所有样品于4℃冰箱静置24 h,用移液器轻轻吸取上清液至1.5 mL的防爆离心管内,于转速为2 000 r/min下离心5 min,分别吸取上清至新的离心管内,分别得到对照组(血清组)、试验组1(肝素钠组)、试验组2(柠檬酸钠组)、试验组3(EDTA-K2组)样品各480份。
1.5检测方法
用口蹄疫O、A型抗体液相阻断ELISA检测试剂盒,小反刍兽疫阻断ELISA检测试剂盒,布鲁氏菌病竞争ELISA抗体检测试剂盒,检测各组样品,并按照各试剂盒说明书步骤进行操作和判定结果。
2结果
2.1抗凝剂对液相阻断ELISA测定羊O、A型口蹄疫抗体的影响
按照口蹄疫0型抗体液相阻断ELISA试剂操作步骤、判定方法完成对照组、试验组样品检测,各组羊O型口蹄疫抗体合格率由高至低依次为:试验组1 98.**%,对照组97.5%,试验组3 95.21%,试验组2 94.38%。抗体效价为1:180时,各组占比从高至低依次为:试验组1 5.4 2%,试验组2 4.3 8%,对照组3.3 3%,试验组3 2.92%;抗体效价大于等于1:256时,各组占比从高至低依次为:对照组94.17%,试验组1 93.33%,试验组3 92.29%,试验组2 90%,见表1。
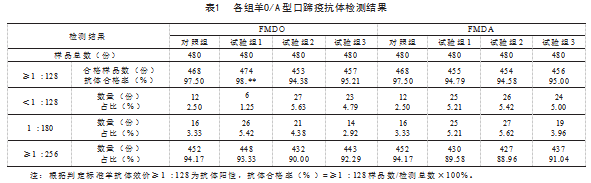
按照口蹄疫A型抗体液相阻断ELISA试剂操作步骤、判定方法完成对照组、试验组样品检测,各组羊A型口蹄疫抗体合格率由高至低依次为:对照组97.5%,试验组3 95%,试验组1 94.79%,试验组2 94.58%;抗体效价为1:180时,各组占比从高至低依次为:试验组2 5.62%,试验组1 5.21%,试验组3 3.96%,对照组3.33%;抗体效价大于等于1:256时,各组占比从高至低依次为:对照组94.17%,试验组3 91.04%,试验组1 89.58%,试验组2 88.96%,见表1。
2.2抗凝剂对阻断ELISA试验测定小反刍兽疫抗体的影响
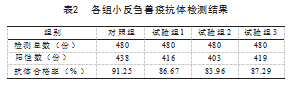
按照小反刍兽疫阻断ELISA监测试剂操作步骤、判定方法完成对照组、试验组样品检测,各组小反刍抗体合格率由高至低依次为:对照组91.25%,试验组3 87.29%,试验组1 86.67%,试验组2 83.96%,见表2。
2.3抗凝剂对竞争ELISA试验测定羊布鲁氏菌病综合征抗体的影响
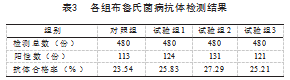
按照布鲁氏菌病竞争ELISA试剂操作步骤、判定方法完成对照组、试验组样品检测,各组布鲁氏菌病抗体合格率由高至低依次为:试验组2 27.29%,试验组1 25.83%,试验组3 25.21%,对照组2 3.54%,见表3。
3讨论
由表1可知,3个试验组测定羊O型口蹄疫抗体合格率(≥1:128),除试验组1测定比对照组高外,试验组2和试验组3均比对照组低,分别比对照组高1.25%、低3.12%、低2.29%,说明肝素钠抗凝剂对液相阻断ELISA测定羊O型抗体阳性率影响呈正向,而柠檬酸钠和EDTA-K2对其影响呈逆向。在抗体效价等于1:180时,试验组1和试验组2占比均比对照组大,而试验组3比对照组小。效价大于等于1:256时,3个试验组占比均比对照组小,说明在不同效价范围,抗凝剂对羊O型口蹄疫检测结果影响不同。
由表1可得出,3个试验组测定的羊A型抗体阳性率均比对照组小,分别比对照组低2.71%、2.92%、2.5%,说明肝素钠、柠檬酸钠、EDTA-K2抗凝剂对抗凝剂对液相阻断ELISA测定羊A型抗体阳性率影响呈逆向。效价等于1:180时,出3个试验组占比均比对照组高,分别比对照组高1.88%、2.29%、0.63%。效价大于等于1:256时,3个试验组均比对照组占比小,分别比对照组低4.59%、5.21%、3.13%,说明在不同效价范围,抗凝剂对羊A型口蹄疫检测结果影响亦不同。
由表2可看出,3个试验组测定小反刍兽疫抗体阳性率均比对照组低,由低至高依次为:试验组2 83.96%,试验组1 86.67%,试验组3 87.29%,分别比对照组低7.29%、4.58%、3.96%。说明这3种抗凝剂对阻断ELISA试验测定小反刍兽疫抗体阳性率的影响呈逆向,这3种抗凝剂对小反刍兽疫抗体结果的逆向影响力从高至低依次为柠檬酸钠、肝素钠、EDTA-K2。
由表3可以看出,3个试验组测定羊布鲁氏菌病抗体阳性率均比对照组高,由低至高依次为:试验组3 25.21%,试验组1 25.83,试验组2 27.29%,依次比对照组高1.67%、2.29%、3.**%。说明抗凝剂对竞争ELISA试验测定布鲁氏菌抗体阳性率的影响呈正向,3种抗凝剂对布鲁氏菌病抗体结果的正向影响力从高至低依次为柠檬酸钠、肝素钠、EDTA-K2。
表3中各组布氏菌病抗体整体阳性率在23.54%~27.29%,出现整体阳性率出现偏低的情况,结合免疫情况中,有4个养殖场抽样数为136份为免疫的,占整体抽样数的28.33%,和实际情况是相符合的。
由表1~表3可看得出,肝素钠抗凝剂提高了液相阻断ELISA试验测定羊O型口蹄疫和竞争ELISA测定布鲁氏菌病的抗体合格率,降低了液相阻断ELISA试验测定羊A型口蹄疫和阻断ELISA测定小反刍兽疫的抗体合格率;柠檬酸钠和EDTA-K2抗凝剂提高了竞争ELISA测定布鲁氏菌病的抗体合格率,降低了液相阻断ELISA试验测定羊O、A型口蹄疫和阻断ELISA测定小反刍兽疫的抗体合格率;有可能是其抑制HRP活性,造成假阴性结果[2]。
4结论
肝素钠、柠檬酸钠、EDTA-K2 3种抗凝剂对液相阻断ELISA试验测定羊O、A型口蹄疫抗体、阻断ELISA法测定小反刍兽疫抗体、竞争ELISA测定猪呼吸综合繁殖征抗体的结果准确性均存在一定的影响[3]。不同抗凝剂对相同ELISA试验影响不同,同种抗凝剂对不同ELISA试验影响也不相同;在液相阻断ELISA试验中的不同效价阶段,同种抗凝剂对其结果影响也不相同。因此,抗凝剂对实验室检查结果有影响[4],为保障结果的准确性、稳定性[5],在用液相阻断ELISA、阻断ELISA、竞争ELISA方法评价羊口蹄疫、小反刍兽疫、布鲁氏菌病免疫抗体时,不能用含以上3种抗凝剂的血浆样品来代替血清样品。
[1]罗学志,喻志祥.浅谈抗凝剂在实验室的应用[J].社区医学杂志,2006(15):61-62.
[2]徐新蓉,龚国富,马萍.ELISA检测过程中影响因素及防控措施分析[J].国际检验医学杂志,2013,34(1):112-113.
[3]孙俊艳,何成涛,刘海波,等.分析前因素对血液乙肝表面抗原检测的影响[J].临床检验杂志,2021(6):470-471,480.
[4]李霞莲,苗晋华.抗凝剂对实验室检查结果的影响[J].实用医技杂志,2015,22(6):620-621.
[5]马红,张珊珊,何美香,等.抗凝与非抗凝血液标本对4项传染性指标酶联免疫吸附试验影响的研究[J].中国医药科学,2022,12(9):146-148,179.










