猪链球菌肽链内切酶O(PepOSS)引起细胞免疫反应的研究论文
2025-03-06 13:46:49 来源: 作者:xujingjing
摘要:猪链球菌是一种高致病性的人兽共患病原,可引发败血症、关节炎和脑膜炎等[1]。据调查,越南、中国、法国和泰国养猪场成年猪的猪链球菌总感染率分别为41.0%、40.4%、72.0%和37.0%,给全球养猪业带来了巨大的经济损失[2]。了解猪链球菌的致病机制对于控制其在动物群体中的传播至关重要。
0引言
猪链球菌是一种高致病性的人兽共患病原,可引发败血症、关节炎和脑膜炎等[1]。据调查,越南、中国、法国和泰国养猪场成年猪的猪链球菌总感染率分别为41.0%、40.4%、72.0%和37.0%,给全球养猪业带来了巨大的经济损失[2]。了解猪链球菌的致病机制对于控制其在动物群体中的传播至关重要。
猪链球菌的致病性和毒力因子之间存在密切关联。除目前已确定的毒力因子外,猪链球菌潜在的新型毒力因子也是当前研究的重点。PepO是一种金属肽链内切酶,属于M13肽酶家族[3]。研究报道,PepO在肺炎链球菌中与细菌致病性相关,它可以通过逃避宿主的天然免疫系统侵入体内,并帮助细菌躲避补体系统的攻击,增强其对细胞的黏附能力[4-6]。本研究在猪链球菌中也发现了类似的蛋白质,并命名为PepOSS,通过研究PepOSS蛋白对细胞天然免疫的影响,旨在为猪链球菌致病机制的研究奠定理论基础。
1材料与方法
1.1试验材料
猪链球菌2型ZY05719菌株、缺失株△vraSRSS、互补株C△vraSRSS和质粒pET-28a由河南农业大学动物病原与生物安全教育部重点实验室制备保存;DH5α、BL21(DE3)感受态细胞均购于自宝生物工程(大连)公司;镍层析柱购自康为世纪公司;DNA凝胶回收试剂盒、质粒小量提取试剂盒购自Omega公司;6His单克隆抗体,羊抗兔抗体购自武汉三鹰生物技术有限公司;ECL化学发光试剂盒购于美国Thermo Fisher公司;胎牛血清购自Invitrogen公司等。
1.2引物的设计与合成
根据GenBank上发布的猪链球菌2型ZY05719的基因组序列(登录号:GCA_000993745.1),利用Primer Premier 5.0软件设计了pepOSS(ZY05719_RS09815)基因特异性引物和细胞因子检测相关引物,见表1。

1.3蛋白的表达和纯化
以菌株ZY05719(NCBI Reference Sequence:NZ_ CP007497.1)的DNA为模板扩增目的基因。将PCR产物与pET-28a载体进行同源重组。鉴定出阳性菌株送尚亚生物测序。将pET-28a-pepOss重组质粒转化到大肠杆菌BL21(DE3)感受态细胞中进行培养。当菌液生长至对数生长期后,加入IPTG(终浓度为0.7 mmol/L),低温诱导蛋白表达12 h。收集细菌沉淀,超声破碎。将含蛋白的上清液置于镍柱中,在室温下用3D混合装置混合2 h,使混合物向下流动并收集。采用20、50、100、200、500 mmol/L的咪唑洗涤过滤柱,通过SDS-PAGE筛选出最佳咪唑洗脱浓度。然后将洗脱液在PB溶液中透析过夜,第2天蔗糖浓缩。纯化的PepOss蛋白经Western blot鉴定。
1.4多克隆抗体的制备
将纯化的PepOSS蛋白与Montanide ISA-201佐剂按等体积比混合,确保充分乳化。然后在每只新西兰白兔的背部多次注射0.5 mg蛋白进行免疫接种。初次免疫后,分别在第2周进行第2次、第4周第3次和第6周第4次加强免疫。第4次免疫1周后采血,采集的血液先在37℃下放置1 h,然后在4℃下放置过夜。分离血清,3 000 r/min离心5 min,-40℃保存。利用间接ELISA测定抗体血清效价检测。
1.5 Western blot试验
PepOSS蛋白样品经SDS-PAGE分离电泳后,将目标蛋白条带转移到NC膜上进行半干转录(24 V,200 mA,30 min)。然后用5%脱脂奶粉37℃阻断非特异性结合位点1 h,4℃条件下用稀释比例为1:2 000的一抗(多克隆抗体阳性血清)孵育过夜。PBST缓冲液洗涤5次,每次5 min后,与稀释比例为1:3 000的二抗(羊抗兔)在室温下孵育2 h。PBST缓冲液洗涤5次,每次洗涤5 min,随后显色并观察结果。
1.6荧光定量PCR
使用TRIzol法提取样品RNA,将提取的RNA按照HiScript II 1st Strand cDNA Synthesis Kit说明书方法反转录为cDNA。对所获得的的cDNA样本进行荧光定量PCR分析。其中以β-actin/parC作为内参照基因,检测相应基因转录水平,每个样品进行3次生物学重复,并使用2-ΔΔCT法计算转录差异。
1.7巨噬细胞吞噬试验
将3D4/21细胞吹成单细胞悬液,接种于24孔细胞培养板中。细胞培养至形成单层。将ZY05719菌株接种到THB液体培养基中,进行培养直至细菌进入对数生长期。在4℃条件下以5 000 r/min的速度离心5 min,使用PBS洗涤3次,并用DMEM重新悬浮细菌。将菌液加入细胞培养板中(MOI=20:1)。在室温下800 r/min离心10 min,在含5%CO2的37℃培养箱中孵育1.5 h。随后,将细胞培养板上清弃去,用PBS清洗3次。然后加入500μL含有庆大霉素(100μg/mL)和青霉素(5μg/mL)的DMEM培养基,37℃孵育1.5 h。孵育后,弃上层液体,再用PBS洗3次。在培养板中加入1 mL ddH2O,室温裂解细胞10 min,反复吹吸促进细胞裂解。接着对裂解液进行一系列的梯度稀释,并将其涂抹在THB平板上,在37℃的培养箱中孵育过夜。第2天,计数THB平板上的细菌数量,计算细菌的抗吞噬率。在整个试验过程中,每个样品设置了3次平行测量,并进行了3次生物重复,以确保数据的准确性。
1.8统计分析
利用GraphPad Prism 5软件进行数据分析和部分图形绘制。使用双尾不成对Student's t-test进行2组数据间的差异分析。结果以P<0.05为差异显著。
2结果
2.1猪链球菌PepOSS蛋白结构分析
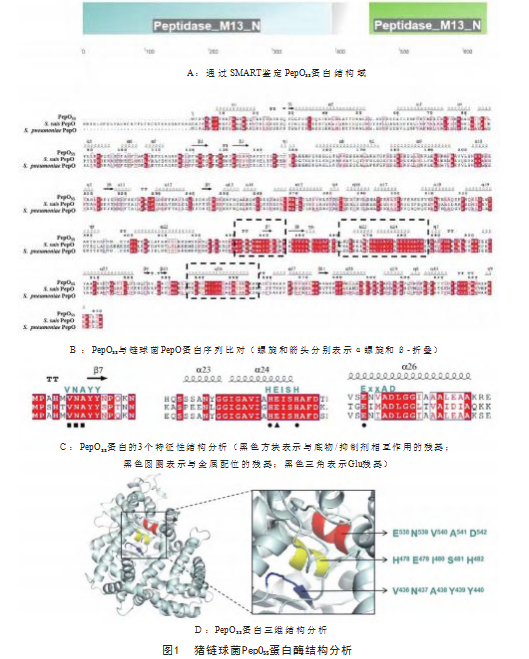
在猪链球菌中发现一个新的金属肽链内切酶基因(ZY05719_RS09815),将其命名为PepO SS,可编码660个氨基酸,大小约71 kDa。SMART软件分析PepO SS属于肽酶M13家族(图1A)。序列比对结果表明,PepO SS与已鉴定的猪链球菌肽链内切酶PepO蛋白(ZY05719_RS00900编码)相似性为29%(图1B),PepOSS在猪链球菌中发挥什么样的生物学功能有待进一步研究。与其他链球菌的M13家族蛋白一样,PepOSS具有参与底物/抑制剂相互作用(VNAYY)和金属配位(HEISH和ENVAD)的特征性元件(图1C、图1D)。
2.2猪链球菌PepOSS蛋白原核表达
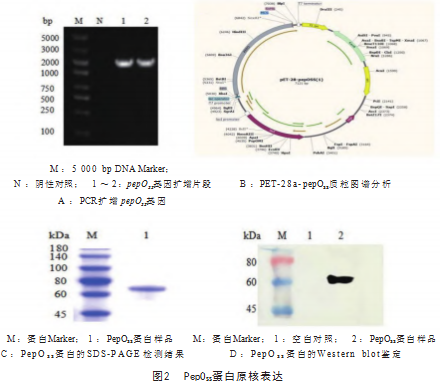
以菌株ZY05719的基因组DNA为模板,通过PCR扩增目的片段,并通过琼脂糖凝胶电泳对扩增产物进行检测。结果显示在大约1 893 bp处有目的条带出现(图2A)。将目的基因与原核表达载体pET-28a进行同源重组(图2B),并将构建好的重组质粒转化到大肠杆菌BL21(DE3)中。随后,在16℃的条件下,使用终浓度为0.7 mmol/L的IPTG诱导蛋白表达12 h。将得到的纯化PepOSS蛋白经SDS-PAGE电泳验证,如图2C所示,在大约72 kDa处存在1条明显条带,且此泳道无其他杂蛋白条带,表明得到的蛋白较纯。随后又进行了Western blot检测,结果显示表达的PepOSS蛋白可与His单克隆抗体发生反应(图2D)。
2.3 PepOSS蛋白多克隆抗体的制备
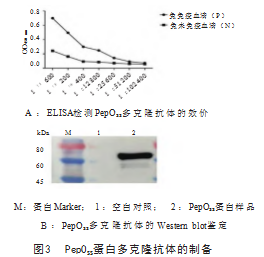
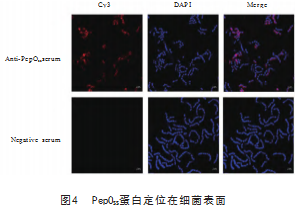
用PepO SS蛋白免疫新西兰大白兔4次后,收集血清,用间接ELISA检测抗体效价。如图3A所示,在血清稀释12 800倍后,吸光度(A)值大于对照组的2.1倍(P/N>2.1),说明多克隆抗体的效价为1:12 800。通过Western blot试验,将PepOSS蛋白与制备的多克隆抗体血清进行孵育,结果显示在大约72 kDa处有明显条带(图3B),表明制备的抗体与PepOSS蛋白有很好的反应原性。随后利用激光共聚焦技术对PepOSS蛋白进行定位。如图4所示,用阳性血清可在细菌表面检测到PepOSS蛋白,阴性血清未检测到。
2.4 PepOSS蛋白引起3D4/21细胞天然免疫应答反应
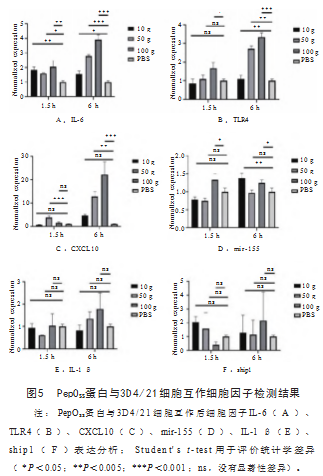
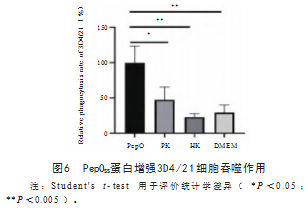
有研究报道,肺炎链球菌PepO蛋白可激活宿主的免疫应答,从而影响肺炎链球菌的致病性[6]。本研究将PepO S S蛋白与猪肺泡巨噬细胞3D4/21共同孵育后,使用荧光定量技术对3D4/21的IL-6、TLR4、mir-155、IL-1β、ship1等细胞因子的表达量进行分析。结果如图5所示,经过PepO SS蛋白刺激后,3D4/21细胞中的IL-6、TLR4、CXCL10细胞因子的mRNA表达量显著增加,与PBS相比以剂量依赖的方式显著升高。用PepOSS蛋白处理3D4/21细胞6 h后,与PK和HK蛋白相比可显著增强细胞的吞噬作用(图6)。上述研究表明PepO SS蛋白在3D4/21细胞的免疫反应中发挥了激活的作用。
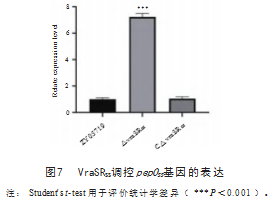
2.5二元信号转导系统VraSRSS调控pepOSS基因的表达
猪链球菌二元信号转导系统VraSRSS是细菌重要的多级信号传导系统,在转录水平调控细菌基因表达,参与细菌的耐药与致病作用。前期转录组数据发现,VraSRSS系统的缺失导致pepOSS基因的上调表达[7]。本次利用荧光定量方法证实,将VraSRSS缺失后pepOSS基因表达水平上升约7倍,而互补株C△vraSRSS中pepOSS基因表达水平与野生株一致(图7)。上述研究表明,pepOSS基因的表达受二元信号转导系统VraSRSS调控。
3讨论
猪链球菌在猪群中的流行情况十分复杂,常引起急性发热、脑膜炎、关节炎和败血症等症状,严重影响了养猪业的经济效益[8]。猪链球菌能够有效侵入宿主的多种微环境并在其中生存,这表明猪链球菌采用了高效的策略以规避宿主免疫防御机制。深入研究猪链球菌与宿主免疫应答的机制,对于制定更加有效的防控策略具有重要意义。
金属肽链内切酶在细菌中广泛存在,参与多种生理过程,如蛋白质降解、信号传导、免疫反应等[9]。化脓性链球菌PepO通过结合C1q参与补体逃避,可有效帮助细菌抵抗宿主免疫应答[10]。在对肺炎链球菌PepO蛋白研究中发现,它可通过TLR2和TLR4介导的信号通路,参与激活宿主的免疫应答,从而影响肺炎链球菌的致病性[6]。本研究在猪链球菌中鉴定了一个新的金属肽链内切酶PepOSS,对其进行原核表达,并探究了其对天然免疫的影响。与肺炎链球菌PepO蛋白作用相似,猪链球菌PepOSS蛋白与3D4/21细胞互作后,IL-6、TLR4、CXCL10等细胞因子的mRNA表达量显著增加。细胞因子的过度分泌会引起机体产生炎症风暴,对宿主细胞产生严重损伤。证实PepOSS能作为一种效应因子参与宿主天然免疫反应的激活。上述试验为后续PepOSS相关信号通路研究奠定了理论基础,也为猪链球菌致病机制的研究提供了依据。
二元信号转导系统一般包含2个蛋白,传感器激酶(HK)和反应调节因子(RR),可在转录水平调控靶标基因,影响RNA聚合酶结合启动子[11-12]。前期研究已证实,二元信号转导系统VraSRSS参与多个基因的调控,在猪链球菌致病性方面发挥作用[7]。试验表明,将VraSRSS缺失后pepOSS基因表达水平显著上调,提示pepOSS基因的表达受二元信号转导系统VraSRSS调控。
4结论
本研究证实猪链球菌PepOss蛋白可有效激活细胞的免疫反应,并且pepOSS基因的表达可受二元信号转导系统VraSRSS调控。上述结果可为猪链球菌致病机制的研究提供理论基础。
[1]高志霞.养殖场猪链球菌病的诊断与治疗[J].中国畜牧业,2024(9):109-110.
[2]许圣松.猪链球菌病的流行特点及防治措施[J].畜禽业,2021,32(10):113-114.
[3]Agarwal V,Kuchipudi A,Fulde M,et al.Streptococcus pneumoniae endopeptidase O(PepO)is a multifunctional plasminogen-and fibronectin-binding protein,facilitating evasion of innate immunity and invasion of host cells[J].J Biol Chem,2013,288(10):6 849-6 863.
[4]Agarwal V,Srok a M,Fulde M,et al.Binding of Streptococcus pneumoniae endopeptid a se O(PepO)to complement component C1q modulates the complement attack and promotes host cell adherence[J].J Biol Chem,2014,289(22):15 833-15 844.
[5]Yao H,Zhang H,Lan K,et al.Purified Streptococcus pneumoniae Endopeptida se O(PepO)Enhances Particle Uptake by Macrophages in a Toll-Like Receptor 2-and miR-155-Dependent Manner[J].Infect Immun,2017,85(4):e01012-16.
[6]Zhang H,Kang L,Yao H,et al.Streptococcus pneumoniae Endopeptidase O(PepO)Elicits a Strong Innate Immune Response in Mice via TLR2 and TLR4 Signaling Pathways[J].Front Cell Infect Microbiol,2016,6:23.
[7]Zhong X,Zhang Y,Zhu Y,et al.The Two-Component Signaling System VraSRSS is Critical for Multidrug Resistance and Full Virulence in Streptococcus suisSerotype 2[J].Infect Immun,2018,86(7):e00096-18.
[8]Haas B,Grenier D.Understanding the virulence of Streptococcus suis:A veterinary,medical,and economic challenge[J].Med Mal Infect,2018,48(3):159-166.
[9]Bland N D,Pinney J W,Thomas J E,et al.Bioinformatic analysis of the neprilysin(M13)family of peptidases reveals complex evolutionary and functional relationships[J].BMC Evol Biol,2008,8:16.
[10]Wilkening R V,Chang J C,Federle M J.PepO,a CovRS-controlled endopeptidase,disrupts Streptococcus pyogenes quorum sensing[J].Mol Microbiol,2016,99(1):71-87.
[11]West A H,Stock A M.Histidine kinases and response regulator proteins in two-component signaling systems[J].Trends Biochem Sci,2001,26(6):369-376.
[12]Nguyen C T,Park S S,Rhee D K.Stress responses in Streptococcus species and their effects on the host[J].J Microbiol,2015,53(11):741-749.










