茶树油提取物对小鼠Lewis细胞增殖、凋亡、周期的影响研究论文
2025-01-16 12:00:56 来源: 作者:liziwei
摘要:不同浓度(0.1%、0.05%、0.01%)不同成分的6种茶树油提取物处理小鼠Lewis细胞,MTT法检测细胞增殖,流式细胞术检测细胞凋亡及周期。与对照组相比,不同浓度的6种茶树油提取物对小鼠Lewis细胞增殖均有显著抑制作用(P<0.05或P<0.01),6种茶树油提取物对肺癌细胞抑制能力由大到小为提取物2、5、6、4、1、3;与对照组相比,不同浓度茶树油提取物2均明显提高小鼠Lewis细胞的凋亡率(P<0.05或P<0.01),且G2/M期细胞比例升高(P<0.01)。茶树油提取物可抑制小鼠Lewis
摘要:不同浓度(0.1%、0.05%、0.01%)不同成分的6种茶树油提取物处理小鼠Lewis细胞,MTT法检测细胞增殖,流式细胞术检测细胞凋亡及周期。与对照组相比,不同浓度的6种茶树油提取物对小鼠Lewis细胞增殖均有显著抑制作用(P<0.05或P<0.01),6种茶树油提取物对肺癌细胞抑制能力由大到小为提取物2、5、6、4、1、3;与对照组相比,不同浓度茶树油提取物2均明显提高小鼠Lewis细胞的凋亡率(P<0.05或P<0.01),且G2/M期细胞比例升高(P<0.01)。茶树油提取物可抑制小鼠Lewis细胞的增殖,促进细胞凋亡,阻滞细胞周期,且其作用随浓度升高而明显增强,具有抑制肺癌细胞生长的潜力。
关键词:茶树油;小鼠Lewis细胞;增殖;细胞凋亡;细胞周期
0引言
茶树油是从澳大利亚本土植物互叶白千层中提取出来的植物精油,在畜牧生产中已逐渐使用茶树油添加剂,并得到有效认可。马慧敏等研究发现在饲料中添加茶树油可对育肥猪的血清免疫及机体抗氧化有一定调节作用,张玥等研究发现,茶树油能提高肉仔鸡生长性能和免疫性能。综上所述,茶树油在饲料中具有促生长作用。茶树油的主要成分含有萜烯烃,主要是单萜、蓓半萜及其伴生醇,有文献报道单萜和倍半萜对肿瘤细胞有抑制作用。茶树油增强免疫功能,抗肿瘤,提高饲料转化率,是否与肺组织结构改善,已有报道未涉及。本课题组已利用Lewis肺癌细胞体内培养移植瘤模型,证实对其有抑制作用,本试验将茶树油提取物作用于小鼠Lewis肺癌细胞,探讨其对肺癌细胞生长情况及生长状态的影响,为其在猪、牛、羊等动物饲料中的应用提供基础研究。
1材料与方法
1.1受试物
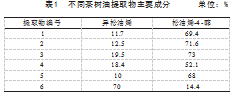
6种茶树油提取物,由江苏无锡某生物科技有限公司提供,用DMSO溶解,0.22μm微孔滤膜过滤除菌,4℃保存备用,主要成分见表1。
1.2主要试剂及仪器
高糖DMEM培养基、胎牛血清(FB S)(美国Hyclone公司);0.25%胰蛋白酶、100×青霉素链霉素溶液(上海碧云天生物技术有限公司);噻唑蓝溴化四唑MTT(索莱宝生物科技有限公司);多孔细胞培养板(美国corning公司);细胞凋亡试剂盒、细胞周期试剂盒(美国BD公司)。
1.3细胞培养
将小鼠Lewis细胞置于含10%FBS、100 U/mL青霉素、100 U/mL链霉素和2 mmol/L谷氨酰胺的DMEM完全培养基中,37℃、5%CO2培养箱中培养,以1:3比例传代培养后进行后续试验。
1.4 MTT法检测细胞增殖
将每孔200μL,细胞浓度为1×104/mL的小鼠Lewis细胞悬液接种于96孔培养板中,在37℃、5%CO2的培养箱中过夜。待细胞完全贴壁后,弃去孔内溶液。加入茶树油提取物1~6,浓度分别为0.01%、0.05%和0.1%,作为药物处理组,同时设置0.1%的DMSO及DMEM完全培养基作为溶剂对照和正常对照,每个剂量8个重复。培养24 h后,每孔加MTT溶液20μL后继续培养4 h。弃去上清后加入DMSO 150μL,室温振荡10 min后在490 nm波长下测定吸光度并计算细胞存活率。
根据MTT试验结果,从6个提取物中筛选出1个对小鼠Lewis细胞活力抑制作用最好的提取物,用于后续细胞凋亡和细胞周期试验。
1.5细胞凋亡检测
取对数生长期中的小鼠Lewis细胞,将浓度调整为1×105/mL,接种于6孔板上,每孔2 mL,培养24 h之后,吸去培养液,加入完全培养基DMEM作为空白对照,将完全培养基稀释后的茶树油提取物溶液终浓度为0.01%、0.05%和0.1%,每组设4个复孔,每孔2 mL,给药处理24 h后,按细胞凋亡检测试剂盒说明书步骤操作,最后使用流式细胞仪检测并计算细胞凋亡率。
1.6细胞周期检测
取对数生长期的小鼠Lewis细胞,调整浓度为1×105/mL,接种于6孔板,培养24 h,吸去培养液,加入完全培养液作为空白对照,将含茶树油提取物终浓度为0.01%、0.05%和0.1%的溶液作为用药组,加至对应孔,每孔2 mL,每个剂量4个复孔,培养24 h,收集细胞,胰蛋白酶消化,1 000 r/min离心5 min,使用冰PBS洗涤2次,70%冷乙醇固定,4℃过夜保存,细胞再次离心,冰PBS洗涤,室温下用RNase A孵育1 h,黑暗条件下PI染色30 min,流失细胞仪评估细胞周期各细胞百分比。
1.7统计学分析
采用SPSS17.0软件对试验数据进行统计分析,采用t检验(Student's t-test)分析进行差异显著性检验。
2结果与分析
2.1不同茶树油提取物对小鼠Lewis细胞增殖的影响
MTT试验中,0.1%的DMSO溶剂组OD平均值为1.098±0.019,与正常对照组的OD平均值1.088±0.038没有显著性差异,表明用于药物稀释的DMSO对小鼠Lewis细胞无明显毒性。以下数据中不再设立溶剂对照。表2中数据以各剂量组OD平均值与空白对照组平均值的比值表示。
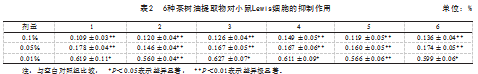
由表2可知,相对于空白对照组,6种茶树油提取物在浓度为0.1%和0.05%时均表现出对细胞活性的抑制作用;在0.01%浓度水平时,提取物1、3、4和6显著抑制了细胞活性,而提取物2和5极显著抑制细胞活性。6种提取物的0.01%处理组中,提取物2和5的平均值均小于其余提取物。
将提取物2和5与其余4个提取物的OD值比进行差异显著性分析,结果见表3。提取物2和5的数据没有显著性差异;提取物2和提取物3、4、6的数据差异性显著(P<0.05),与提取物1的数据差异极显著(P<0.01);提取物5与6数据差异性显著(P<0.05),与提取物4的数据差异极显著(P<0.01)。
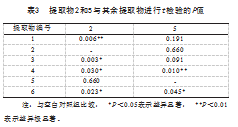
以上结果表明,茶树油提取物对细胞活性抑制作用由大到小依次为提取物2、5、6、4、1、3。以下试验,仅以提取物2作为受试样品。
2.2茶树油提取物对小鼠Lewis细胞凋亡的影响
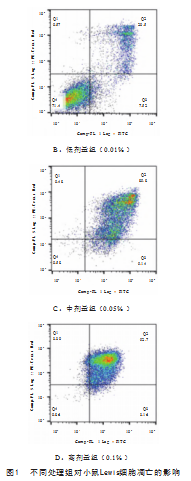
由图1和表4可见,相较于空白对照组,0.1%、0.05%和0.01%处理组均能显著促进小鼠Lewis细胞凋亡(P<0.01)。随茶树油提取物浓度增加,细胞晚期凋亡率增大,活细胞比率下降,提示茶树油提取物对细胞凋亡的影响与浓度呈正相关。
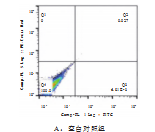
图1中Q1为(AnnexinV-FITC)-/PI+,此区域的细胞为坏死细胞,少数的晚期凋亡细胞也有可能在其中,甚至机械损伤的细胞也包含在其中;Q2为(AnnexinV+FITC)+/PI+,此区域的细胞为晚期凋亡细胞;Q3为(AnnexinV-FITC)+/PI-,此区域的细胞为早期凋亡细胞;Q4为(AnnexinV-FITC)-/PI-,此区域的细胞为活细胞。
2.3茶树油提取物对细胞周期的影响
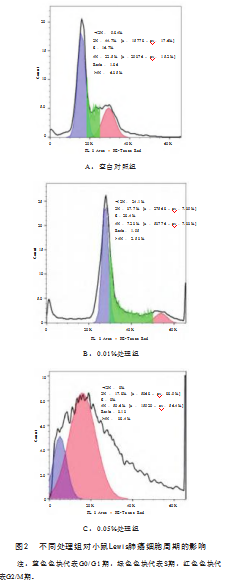
图2和表5中显示,与空白对照组相比,随着剂量的增加,处于G0/G1期和S期的细胞比例显著减少(P<0.01或P<0.05),而G2/M期细胞极显著增加(P<0.01),提示茶树油提取物具有细胞周期阻滞作用。
3讨论
茶树油作为天然提取物,可作为抗生素替代品,毒副作用小,不易产生耐药性,显著改善畜禽的生产性能,增强畜禽机体的免疫功能,带来巨大经济效益的同时,也带给人类健康。茶树油的生物活性归因于亲脂性单萜,a-蒎烯、松油烯-4-醇、异松油烯、芳樟醇和a-萜品醇,这会破坏细胞完整性,导致细胞死亡。在以往的研究中,由于茶树油提取物中活性成分的不同,茶树油的抗菌作用机制较为复杂,松油烯-4-醇处理的细胞显示介体的形成和细胞质内容物的损失,并且对耐药细胞系更有效,可以通过与质膜的相互作用以及随后的膜脂重组介导,诱导人类M14黑色素瘤细胞的caspase依赖性凋亡。1,8-桉叶素导致耐盐性显著丧失,而a-萜品醇具有破坏或渗透脂质结构的能力。异松油烯可以与MAPK1靶点结合,抑制p38丝裂原活化蛋白激酶(p38MAPK)、c-Jun氨基末端激酶(JNK)和ERK表达,继而抑制炎性因子,调节免疫能力。
茶树油在体外抗癌活性中发挥重要作用,考虑到不同癌细胞在用细胞毒性药物治疗反应后的高度变异性和茶树油不同活性成分配比对细胞差异性影响,因此有必要对多种细胞系的潜在抗癌药物进行进一步研究,而茶树油对小鼠肺癌细胞增殖、凋亡和细胞周期的影响鲜有报道。
细胞增殖是细胞分裂最常见的生命活动,包括了一系列的DNA、RNA和蛋白质的合成,而这些过程都严格的受到了各种酶的活性或数量的调节,故调控影响细胞内各种特异性的酶的功能就可以改变细胞的增殖能力。常见的介导细胞增殖的信号通路主要有MAPK三级激酶激活通路、JAK-STAT信号通路等。细胞周期调控紊乱与细胞恶性转化和肿瘤细胞失控性增殖相关。有研究表明松油烯-4-醇不是P-糖蛋白的底物,而P-糖蛋白过度表达是引起多药耐药的常见原因。松油烯-4-醇也可诱导2种侵袭性小鼠肿瘤细胞系AE17间皮瘤和B16黑色素瘤坏死性细胞死亡以及低水平的细胞凋亡,并通过引起G1期细胞周期停滞来诱导其抑制作用。在此基础之上,本研究设立不同成分的茶树油配方,观察对小鼠肺癌细胞的抑制作用,结果发现,松油烯-4-醇占比越高对癌细胞抑制效果越好;茶树油提取物各浓度组细胞凋亡率明显增高,与浓度呈正相关;茶树油干预后,小鼠Lewis细胞被阻滞在G2/M期。
茶树油提取物各处方治疗后显著的抗增殖作用表明,松油烯-4-醇有显著的抗增殖活性,尽管它可能不是茶树油抗增殖活性的唯一原因,但它却是很重要的因素。这为后续茶树油抑制肺癌提供了一定的理论支持,但还需要对茶树油提取物在肺癌细胞中的分子机制作进一步的研究。
参考文献:
[1]马慧敏,封飞飞,霍永久,等.茶树油对育肥猪血清免疫及抗氧化指标的影响[J].饲料工业,2023,44(3):35-38.
[2]张玥,石青青,顾秋丽,等.茶树油饲料添加剂对肉仔鸡生长性能、血清生化及免疫性能的影响[J].饲料博览,2022(4):1-7,31.
[3]Ren Z,Gould M N.Modulation of small G protein isoprenylation by anticancer monoterpenes in in situ mammary gland epithelial cells[J].Carcinogenesis,1998,19(5):827-832.
[4]None.Antitumor activity of balsam fir oil:production of reactive oxygen species induced by alpha-humulene as possible mechanism of action[J].Planta Medica,2003,69(5):402-407.
[5]Wiseman D A,Werner S R,Crowell P L.Cell Cycle Arrest by the Isoprenoids Perillyl Alcohol,Geraniol,and Farnesol Is Mediated by p21Cip1 and p27Kip1 in Human Pancreatic Adenocarcinoma Cells[J].Journal of Pharmacology and Experimental Therapeutics,2007,320(3):1 163-1 170.
[6]封飞飞,方伟,王淑楠,等.茶树油对育肥猪生长性能、器官指数、胴体性状和肉品质的影响[J].动物营养学报,2017(10):3 620-3 626.
[7]Carson C F,Riley T V.Antimicrobial activity of the major components of the essential oil of Melaleuca alternifolia[J].Journal of Applied Microbiology,1995,78(3):264-269.
[8]Hammer K A,Carson C F,Riley T V.Antifungal activity of the components of Melaleuca alternifolia(tea tree)oil[J].Journal of Applied Microbiology,2003,95(4):853-860.
[9]Hart P H,Brand C,Carson C F,et al.Terpinen-4-ol,the main component of the essential oil of Melaleuca alternifolia(tea tree oil),suppresses inflammatory mediator production by activated human monocytes[J].Inflammation Research,2000,49(11):619-626.
[10]Eltai N O,Salisbury V,Greenman J.Efficacy of oregano oil as a biocide agent against pathogens in vitro,using lux reporter gene technology[J].Academic Journals,2015,10(2):7 646.
[11]汪莹,赵焰焰,闫凯莉,等.GC-MS结合网络药理学与分子对接探讨乳香挥发油镇痛的活性成分及作用机制[J].世界科学技术—中医药现代化,2021,23(11):4 180-4 191.
[12]Greay S J,Ireland D J,Kissick H T,et al.Induction of necrosis and cell cycle arrest in murine cancer cell lines by Melaleuca alternifolia(tea tree)oil and terpinen-4-ol[J].Cancer Chemotherapy and Pharmacology,2010,65(5):877-888.










