猪流行性腹泻治疗药物及疫苗研究进展论文
2025-01-07 11:47:02 来源: 作者:dingchenxi
摘要:猪流行性腹泻病毒(PEDV)是危害养猪业发展的重要病原微生物之一,PEDV可在猪群中快速传播,使猪群大面积的感染并且爆发猪流行性腹泻(PED)。感染猪群随年龄的不同呈现不同程度的临床症状,其中新生仔猪的症状尤为明显。
摘要:猪流行性腹泻病毒(PEDV)是危害养猪业发展的重要病原微生物之一,PEDV可在猪群中快速传播,使猪群大面积的感染并且爆发猪流行性腹泻(PED)。感染猪群随年龄的不同呈现不同程度的临床症状,其中新生仔猪的症状尤为明显。PEDV可破坏感染仔猪的消化系统,造成其食欲不振,呕吐、腹泻、脱水等临床症状,且患有PED在仔猪死亡率极高,仔猪的大量死亡对生猪养殖产业造成极其严重的经济损失。目前预防该病的主要手段为生物安全防控及疫苗免疫注射,对PEDV产生抑制作用的药物还在积极的研发中。就目前药物对PEDV的抑制多数是在细胞感染病毒之前,如番茄碱、Griffithsin(GRFT)。该文对目前在实验中对PEDV产生一定的抑制作用的药物进行阐述,并对PED疫苗的研究进展进行简要总结。
关键词:猪流行性腹泻;灭活疫苗;弱毒疫苗;亚单位疫苗;核酸疫苗
0引言
1978年的英国中央研究所通过腹泻小猪的肠道提取到一种病毒颗粒[1],这种病毒颗粒被确认为是一种新的冠状病毒,其中从比利时分离的名为CV777的冠状病毒成为了欧洲PEDV的原型毒株[2]。我国于20世纪80年代首次发现猪流行性腹泻病毒,随后快速在我国传播,2010年前,PEDV在我国的流行趋势为多地散发,使用典型毒株CV777研发的灭活疫苗及就弱毒疫苗就可对其进行较好的防控。2010年10月,PEDV变异毒株在中国被发现,在中国南方引起了大流行并迅速扩散至全国范围,对中国的生猪业造成巨大的经济损失。
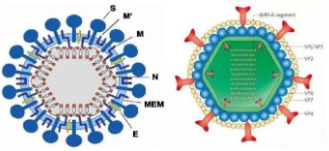
猪流行性腹泻是具有包膜的正链RNA病毒,为冠状病毒科甲冠状病毒属的成员,其症状与猪的传染性胃肠炎相似,可引起新生仔猪急性腹泻、呕吐、脱水以及可造成高死亡率。各年龄段的猪群都可感染PEDV且表现出不同程度的症状,其中初生仔猪的症状尤为明显,且伴随着高腹泻高死亡率。目前主要是通过采用生物安全措施以及疫苗免疫对猪PED进行防控。本文介绍3种对于PEDV具有克制作用的药物,其中包括番茄碱、GRFT、单乳酸甘油,并简要概括目前PEDV在疫苗方面的研究进展。
1对PEDV具有抑制作用的药物
1.1番茄碱
番茄碱是一种从西红柿皮和叶中提取的甾体生物碱,番茄碱对基孔肯雅病毒具有抗病毒能力[3],在猪病病原方面,Wang P等[4]验证番茄碱对于冠状病毒TGEV,动脉病毒PRRSV均有抑制其复制的效果。为验证其对PEDV是否存在抑制作用,Wang P及其团队[4]使用番茄碱对细胞进行预处理,发现预处理后的细胞相较于未进行预处理的细胞感染数量明显下降,推测番茄碱可能是在PEDV还未进入细胞时便对其产生某种抑制。在后续的验证试验中,研究者发现,番茄碱可通过抑制PEDV的3CLpro蛋白抑制PEDV的复制,从而使体外细胞具有抗病毒能力。但番茄碱对于抑制PEDV的复制能力呈现浓度梯度依赖,即在一定范围内,番茄碱的浓度越高,其对PEDV的抑制作用越明显。
到目前为止,番茄碱在小鼠体内一定剂量时是安全的,但在FDA膳食计量补充中,对于番茄碱在猪体内的药动学及安全性没有详细的信息评估,番茄碱想要应用于猪病的预防及治疗仍需大量的研究及试验。总之,这项研究结果表明,番茄碱在一定程度上可为预防PEDV筛选药物提供一个新的思路。
1.2 Griffiths in(GRFT)
GRFT是一种来自红藻Griffithsia sp.的高甘露糖特异性凝集素[5],其抗病毒谱广[6]。该凝集素可与病毒囊膜蛋白上的糖链结合[6],影响病毒的黏,从而使病毒失活,因此对于膜病毒GRFT的作用明显。如用GRFT治疗SARS-CoV感染的小鼠,发现小鼠体重并未减轻,且存活率为100%[7]。将对未感染病毒的细胞中加入GRFT进行预处理,细胞添加PEDV后其感染率较未加GRFT的细胞感染率下降明显,且在研究其对PEDV产生抑制效果的具体时间时,发现GRFT在未感染病毒前使用效果有着明显的差异,较感染PEDV后使用GRFT,在未感染前就使用GRFT细胞感染PEDV的几率大幅度下降,说明GRFT在PEDV进入细胞前就对PEDV产生抑制效果[8]。在崔康乐[9]的研究中,重组表达的GRFT对于PEDV依旧表现出了抑制效果,且重组GRFT具有良好的耐热性、耐酸性以及一定的胃蛋白酶耐受性。将来作为可批量生产的抗病毒药物,GRFT无疑有很大的潜力成为抑制PEDV的有效药物。
1.3 Mono laurin(ML)
ML是一种天然化合物,主要存在于椰子油和人母乳中[10]。目前,它已列入FDA公认的安全(GRAS)物质清单,可作为各种产品的营养补充剂。在Hierholzer J C等[11]的研究中,ML可降低包膜病毒的感染能力。而在詹尼佛及向金华等[12]的体外研究中,ML对于包膜病毒表现出抗病毒活性,同一研究中的无包膜病毒则完全不表现出抗病毒活性。这一研究表明ML可能对同样具有包膜的PEDV具有抗病毒活性,此推论在张倩等[13]的研究中得到了证实。
PEDV作为一种肠道病毒,主要感染小肠并造成严重的肠道损伤,ML被证明可以促进肠道受损绒毛修复,从而改善PEDV感染后肠道损伤症状。ML同样对PEDV表现出了抑制其复制的作用,并且ML可以降低PEDV感染诱导的IL-6和IL-8的表达而具有抗PEDV和抗炎作用。在蛋白质组学分析的结果表明,ML可以通过调节干扰素途径促进体内平衡的恢复[14]。
1.4其他药物
Wang X等[14]发现,三乙酰白藜芦醇(TCRV)可激活半胱天冬酶途径触发了PEDV感染细胞的早期凋亡,从而抑制了PEDV感染。作为传统药物的甘草甜素(GSY)可也通过HMGB1/TLR4-丝裂原活化蛋白激酶(MAPK)p38途径抑制PEDV感染[15]。而在近期,作为抗真菌抗生素两性霉素B(AmpB)在赵普等[16]的研究中被发现其可明显抑制PEDV感染Vero细胞。无论是番茄碱、GRFT在感染前预处理后可有效的降低感染率,还是ML在感染后对小肠绒毛的修复,或者是TCRV、GSY及AmpB等其他途径对PEDV的抑制,都为研发抗PEDV药物奠定了基础,为后续更有效的研发抗PEDV药物提供了新的思路。
2猪流行性腹泻(PED)疫苗类型
2.1灭活疫苗
由于灭活疫苗的安全性能好、运输方便等优点,在疫苗制备方式选择时备受研究机构的青睐。灭活疫苗分为组织灭活疫苗和细胞灭活疫苗,组织灭活疫苗使用猪流行性腹泻疫病流行区域的强毒株制备,免疫接种母猪后可获得较好的免疫。王明等[17]利用上海的流行毒株对仔猪进行攻毒并收取肠内容物制备组织灭活疫苗,接种妊娠母猪及仔猪后获得较强的免疫能力,免疫期限长达6个月。但组织疫苗制作成本高,制作过程存在一定的生物安全风险,不适用于大量生产。相较之下,细胞灭活苗在现如今的技术下可大量生产,更符合市场需求。
2010年以前,韩国使用细胞致弱毒株制备灭活疫苗并对母猪进行免疫,发现母猪可高水平的抗体,其仔猪症状减轻,排毒量下降,死亡率也有所下降[18]。近年,科研人员向灭活疫苗中加入趋化因子或采用新型材料制备高效佐剂可显著提高疫苗免疫效果。Zhou C J等[19]使用胞壁酰二肽化合物佐剂CVC1303与PEDV灭活疫苗同时注入小鼠体内,接种小鼠小肠与肺内的特异性抗体滴度IgA显著增强。Hsueh F C等[20]构建3种CCL蛋白趋化因子与灭活疫苗共同肌肉注射给药,与对照仔猪相比,CCL趋化因子作为佐剂的肌肉注射给药可以诱导优越的全身抗原特异性IgG,粘膜抗原特异性IgA,并在实验猪的注射部位募集CCR9+和/或CCR10+炎症细胞,使灭活疫苗获得了较好的免疫效果。
2.2弱毒疫苗
病毒致弱的办法包括:使用野生的弱毒株;将病毒接种于异种动物或者细胞致弱;将病毒株通过物理或者化学的方法致弱;将病毒通过基因工程进行基因重组致弱。Wu Y等[21]利用Vero细胞传代培养PEDV CT毒株,传多代后毒力有明显降低的同时依然可刺激机体产生高滴度的抗体。传代致弱是较为传统的做法,传代的次数与免疫原性之间的平衡也较难掌握。如童昆周等[22]验证了PEDV-G1第83代作为弱毒疫苗毒株具有较好的免疫原性。而Kweon等[23]分离到的毒株KPEDV-9是在vero细胞上传至93代、陶晓珊等[24]对分离株SD10A1是在传至16代、张许科等[25]将HN1301是在传至46代出现了稳定病变。通过筛选稳定且适合制作疫苗的弱毒株具有较大的偶然性,同时,需要系统的对筛选毒株进行是否存在返强、散毒等风险进行评估验证。
为了克服弱毒疫苗的弱点,临床上有人尝试将弱毒疫苗与灭活疫苗进行共同免疫,即首次免疫采用口服弱毒疫苗,之后通过肌肉注射灭活疫苗进行二次免疫加强免疫效果。胡兴义等[26]通过在母猪分娩前40 d接种猪流行性腹泻三联弱毒疫苗,产前20 d接种猪流行性腹泻二联灭活疫苗,让母猪分娩后的初乳中抗体滴度升高,并且优于单一接种这2种疫苗。
目前,通过基因敲除技术将PEDV的毒力基因敲减或者敲除使毒株降低毒力也在临床研究当中。虽然致弱后的毒株在接种后对其亲本无法产生足够的抵抗能力,但通过逆转系统来修改病毒毒力基因,在有效的降低PEDV流行毒株的毒力的同时还能产生较高的免疫原性。如Hou Y等[27]在研究中发现PEDV S蛋白CT处的YxxΦ和KVHVQ基序对于PEDV复制是可有可无的。然而,这2个基序的缺失降低体内病毒的毒力,却不会导致免疫活性降低。
2.3亚单位疫苗
亚单位疫苗与使用全病毒的疫苗相比,亚单位疫苗的安全系数更高。Makadiya N等[28]对PEDV S蛋白的S1部分进行表达,纯化后进行免疫发现,母猪血液和母乳中有特异性IgG以及中和抗体,并对所产仔猪进行攻毒,其临床症状有所减轻,死亡率减低。Li Q等[29]使用PEDV抗原核心表位建出rSF-COE-3D亚单位疫苗并在后海穴进行注射发现,仔猪血清特异性抗体的水平显著提高。
近年,病毒样颗粒也是亚单位疫苗研究热点,利用乙肝病毒核心衣壳蛋白(HBcAg)形成的VLP为载体,成功表达PEDV B细胞抗原表位,以此VLP疫苗免疫怀孕母猪,所产仔猪攻毒后存活率较对照高,症状减轻,恢复时间缩短[30]。但就目前来说,亚单位疫苗仅能提供仔猪部分保护,其免疫功效还需进一步的加强。
2.4核酸疫苗
核酸疫苗与其他新型疫苗在近年来备受关注,与其他疫苗相比,其具有安全性高和免疫的效应时间长的优势。20世纪90年代初,WolffJ A等[31]将外源质粒注射进小鼠的肌肉,19个月后仍能检测到相当数量的质粒在稳定的表达。但由于核酸疫苗的免疫原性较低、存在安全风险等问题,截至2020年,世界范围仅有7种兽用核酸疫苗销售。COVID-19疫情的暴发,促进了核酸疫苗的研发进程,核酸疫苗由此进入了高速发展期[32]。
2020年后,核酸疫苗的研发力度大幅度增加,mRNA疫苗从启动到上市仅耗时1年,极大缩短了疫苗研发上市的周期,这对于具有高变异基因组的PEDV来说,无疑是为未来防控PED带来了新的发展希望。
2.4.1 DNA疫苗
PEDV的DNA疫苗在免疫时将目的基因或者带有目的基因的载体投入到目标组织使其产生特异性抗体。Yin Y等[33]使构建了表达PEDV S蛋白的重组质粒,并对小鼠进行免疫发现小鼠产生了特异性抗体。Zhang Y等[34]构建出PEDVS蛋白的DNA疫苗,该疫苗可明显缓解PEDV感染后的症状的同时能诱导机体产生高水平的IFN-γ和IL-4。虽然DNA疫苗制备工艺简单,疫苗形式稳定,然而目的基因的表达需要复制、转录,再翻译成蛋白质才能够作为免疫原,目的基因表达效率不高成为限制DNA疫苗进一步发展的主要原因。
2.4.2 RNA疫苗
RNA疫苗主要包括mRNA的LNP和包含RNA复制子的复制缺陷型病毒颗粒等[35]。LNP疫苗主要是讲脂质体包装mRNA形成类似病毒的纳米颗粒;复制缺陷型病毒颗粒则是将体外转录的RNA复制子与协助载体共同转染细胞,在该细胞内辅助载体表达的病毒膜蛋白将RNA复制子包装起来。其中复制缺陷型病毒颗粒作为疫苗,只能免疫1次,不能连续免疫,因此具有较高安全性[36]。
相较于DNA疫苗,mRNA疫苗发展具有更大的应用前景,2013年,美国紧急批准了一批PEDV RNA疫苗的使用,其载体pVEK是在委内瑞拉马脑炎病毒基础上开发,其iPEDV-plus疫苗已美国注册。随后,利用其SirraVaxSM技术生产PEDV mRNA疫苗,这一平台技术在美国获得了许可[37]。
3总结
目前,猪群接种弱毒疫苗和灭活疫苗仍然是预防PEDV的主要手段。改善灭活疫苗的制备工艺,增加疫苗中有效的抗原含量,尤其的是使其能诱导机体产生更高的中和抗体十分重要。弱毒疫苗无论是通过细胞传代致弱,还是敲减或敲除毒力基因而达到致弱都需要进行安全性和有效性间平衡。为提高亚单位疫苗抗原的免疫活性,可通过将纳米颗粒和病毒样颗粒技术与亚单位疫苗技术结合[38-39]。PED的核酸疫苗目前亟待解决的问题是保护率不全,提高疫苗的保护率是未来研究的重点。
每种疫苗均有其目前加强猪场内的生物安全防控及注射当地流行株适用疫苗各自的优势与劣势,未来疫苗研发将朝着更加高效、安全等方向发展。
参考文献
[1]Chasey D,Cartwright S F.Virus-like particles associated with porcine epidemic diarrhoea[J].Res Vet Sci,1978,25(2):255-256.
[2]Debouck P,Pensaert M.Experimental infection of pigs with a new porcine enteric coronavirus,CV 777[J].Am J Vet Res,1980,41(2):219-223.
[3]Troost B,Mulder L M,Diosa-toro M,et al.Tomatidine,a natural steroidal alkaloid shows antiviral activity towards chikungunya virus in vitro[J].Sci Rep,2020,10(1):6 364.
[4]Wang P,Bai J,Liu X,et al.Tomatidine inhibits porcine epidemic diarrhea virus replication by targeting 3CL protease[J].Vet Res,2020,51(1):136.
[5]Mori T,O'keefe B R,Sowder Rcnd,et al.Isolation and characterization of griffithsin,a novel HIV-inactivating protein,from the red alga Griffithsia sp[J].J Biol Chem,2005,280
(10):9 345-9 353.
[6]Lusvarghi S,bewley C A.Griffithsin:An Antiviral Lectinwith Outstanding Therapeutic Potential[J].Viruses,2016,8(10):296-303.
[7]O'keefe B R,Giomarelli B,Barnard D L,et al.Broad-spectrum in vitro activity and in vivo efficacy of the antiviral protein griffithsin against emerging viruses of the family Coronaviridae[J].J Virol,2010,84(5):2 511-2 521.
[8]Li L,Yu X,Zhang H,et al.In vitro antiviral activity of Griffithsin against porcine epidemic diarrhea virus[J].Virus Genes,2019,55(2):174-181.
[9]崔康乐.重组Griffithsin蛋白的表达及抗猪流行性腹泻病毒的活性研究[D].杭州:浙江理工大学,2018.
[10]Barker L A,Bakkum B W,Chapman C.The Clinical Use of Monolaurin as a Dietary Supplement:A Review of the Literature[J].J Chiropr Med,2019,18(4):305-310.
[11]Hierholzer J C,Kabara J J.In Vitro Effects of Monolaurin Compounds on Enveloped RNA and DNA Viruses[J].J Food Saf,1982,4(1):1-12.
[12]Welch JL,Xiang J,Oke oma CM,et al.Glycerol Monolaurate,an Analogue to a Factor Secreted by Lactobacillus,Is Virucidal against Enveloped Viruses,Including HIV-1[J].mBio,2020,11(3):e686-692.
[13]Zhang Q,Yi D,Ji C,et al.Monolaurin Confers a Protective Effect Against Porcine Epidemic Diarrhea Virus Infection in Piglets by Regulating the Interferon Pathway[J].Front Immunol,2021,12:797476.
[14]Wang X,Liu Y,Li K,et al.Triacetyl Resveratrol Inhibits PEDV by Inducing the Early Apoptosis In Vitro[J].Int J Mol Sci,2022,23(23):14 499-14 505.
[15]Gao R,Zhang Y,Kang Y,et al.Glycyrrhizin Inhibits PEDV Infection and Proinflammatory Cytokine Secretion via the HMGB1/TLR4-MAPK p38 Pathway[J].Int J Mol Sci,2020,21(8):2 961-2 968.
[16]赵普,陈欢,张财盛,等.两性霉素B对猪流行性腹泻病毒入胞的抑制作用研究[J].畜牧与兽医,2023,55(2):73-79.
[17]王明,马思奇,周金法,等.猪流行性腹泻灭活疫苗的研究[J].中国畜禽传染病,1993(5):17-19.
[18]Park J E,Kang K J,Ryu J H,et al.Porcine epidemic diarrhea vaccine evaluation using a newly isolated strain from Korea[J].Vet Microbiol,2018,221:19-26.
[19]Zhou C J,Chen J,Hou J B,et al.The Immunological Functions of Muramyl Dipeptide Compound Adjuvant on Humoral,Cellular-mediated and Mucosal Immune Responses to PEDV Inactivated Vaccine in Mice[J].Protein Pept Lett,2018,25(10):908-913.
[20]Hsueh F C,Chang Y C,Kao C F,et al.Intramuscular Immunization with Chemokine-Adjuvanted Inactive Porcine Epidemic Diarrhea Virus Induces Substantial Protection in Pigs[J].Vaccines(Basel),2020,8(1):102-108.
[21]Wu Y,Li W,Zhou Q,et al.Characterization and pathogenicity of Vero cell-attenuated porcine epidemic diarrhea virus CT strain[J].Virol J,2019,16(1):121.
[22]童昆周,李力复,林志雄,等.猪流行性腹泻弱毒疫苗的研究[J].中国兽医科技,1996(1):3-4.
[23]Kweon C H,Kwon B J,Lee J G,et al.Derivation of attenuated porcine epidemic diarrhea virus(PEDV)as vaccine candidate[J].Vaccine,1999,17(20-21):2 546-2 553.
[24]陶晓珊,刘蕾,申洪银,等.一种猪流行性腹泻活疫苗[P].山东:CN201410082924.0,2015-12-02.
[25]张许科,孙进忠,田克恭.一种猪流行性腹泻病毒株、其弱毒疫苗株及应用[P].河南:CN201310463385.0,2015-04-15.
[26]胡兴义,张双翔,冯旭芳,等.猪病毒性腹泻(PED)疫苗免疫后母猪乳汁中PEDV IgA消长动态[J].中国兽医学报,2017,37(9):1 659-1 663.
[27]Hou Y,Meulia T,Gao X,et al.Deletion of both the Tyrosine-Based Endocytosis Signal and the Endoplasmic Reticulum Retrieval Signal in the Cytoplasmic Tail of Spike Protein Attenuates Porcine Epidemic Diarrhea Virus in Pigs[J].J Virol,2019,93(2):e01758-18.
[28]Makadiya N,Brownlie R,van den Hurk J,et al.S1 domain of the porcine epidemic diarrhea virus spike protein as a vaccine antigen[J].Virol J,2016,13:57.
[29]Li Q,Xu Z,Wu T,et al.Aflagellin-adjuvanted PED subunit vaccine improved protective efficiency against PEDV variant challenge in pigs[J].Vaccine,2018,36(29):4 228-4 235.
[30]Lu Y,Clark-deener S,Gillam F,et al.Virus-like particle vaccine with B-cell epitope from porcine epidemic diarrhea virus(PEDV)incorporated into hepatitis B virus core capsid provides clinical alleviation against PEDV in neonatal piglets through lactogenic immunity[J].Vaccine,2020,38(33):5 212-5 218.
[31]WolffJ A,Ludtke J J,Acsadi G,et al.Long-term persistence of plasmid DNA and foreign gene expression in mouse muscle[J].Hum Mol Genet,1992,1(6):363-369.
[32]李爱花,杨雪梅,孙轶楠,等.核酸疫苗研发态势与发展建议[J].中国工程科学,2021,23(4):153-161.
[33]Yin Y,Zhu L,Liu P,et al.Evaluation on the efficacy and immunogenicity of recombinant DNA plasmids expressing S gene from porcine epidemic diarrhea virus and VP7 gene from porcine rotavirus[J].Braz J Microbiol,2019,50(1):279-286.
[34]Zhang Y,Zhang X,Liao X,et al.Construction of a bivalent DNA vaccine co-expressing S genes of transmissible gastroenteritis virus and porcine epidemic diarrhea virus delivered by attenuated Salmonella typhimurium[J].Virus Genes,2016,52(3):354-364.
[35]Lundstrom K.Alphavirus-based vaccines[J].Viruses,2014,6(6):2 392-2 415.
[36]李震,陈冰清,董世娟.猪流行性腹泻疫苗研究进展[J].上海畜牧兽医通讯,2021(6):1-7.
[37]Pardi N,Hogan M J,Porter F W,et al.mRNA vaccines-a new era in vaccinology[J].Nat Rev Drug Discov,2018,17(4):261-279.
[38]Wang J,Huang L,Mou C,et al.Mucosal immune responses induced by oral administration recombinant Bacillus subtilis expressing the COE antigen of PEDV in newborn piglets[J].Biosci Rep,2019,39(3):BSR20182028.
[39]Walls A C,Fiala B,Schäfer A,et al.Elicitation of Potent Neutralizing Antibody Responses by Designed Protein Nanoparticle Vaccines for SARS-CoV-2[J].Cell,2020,183(5):1 367-1 382.










