微生物管碟法测定血浆氨苄西林浓度分析论文
2024-12-31 11:19:46 来源: 作者:dingchenxi
摘要:该试验以藤黄微球菌为工作菌,按藤黄微球菌细菌生长曲线、菌悬液制备、氨苄西林钠溶液配制、双层培养基的制备进行试验,对精密度、线性关系和回收率试验结果进行讨论,探索了确定血浆中氨苄西林钠浓度的微生物学方法。
摘要:该试验以藤黄微球菌为工作菌,按藤黄微球菌细菌生长曲线、菌悬液制备、氨苄西林钠溶液配制、双层培养基的制备进行试验,对精密度、线性关系和回收率试验结果进行讨论,探索了确定血浆中氨苄西林钠浓度的微生物学方法。结果显示,氨苄西林钠浓度在0.04~5μg/mL范围内,药物浓度对数与抑菌圈直径之间有良好线性关系r=0.997,血浆中最低检测线0.04μg/mL。氨苄西林钠浓度在5.0、0.31、0.04μg/mL时,日内变异系数分别时6.55%、7.96%、7.06%;日间变异系数分别是5.97%、6.91%、7.71%。回收率为97.8%~100%。与测定血浆中氨苄西林钠浓度的仪器方法相比,微生物管碟法可靠、准确、灵敏,检定菌易培养,易观察结果,费用低廉,可以满足对血浆中氨苄西林钠浓度分析要求。
关键词:氨苄西林;管碟法;血浆;回收率;生长曲线;含量测定
0引言
氨苄西林钠是一种半合成的β-内酰胺青霉素,它具有较强的广谱杀菌活性,不耐酶耐酸,易于通过口服或肌内注射吸收[1],主要通过抑制细胞壁黏肽合成酶,细胞壁黏肽合成,从而发挥较强的杀菌效果[2]。其半衰期短至0.5~1 h,在临床用药中需多次服用。该药安全性高、成本低、抗菌作用效果佳,是首选治疗革兰氏阳性细菌引发感染的抗生素[3]。由于其强大的抗菌作用,而被普遍应用在防治畜禽疾病中,也广泛用在兽医治疗。主要用以治疗敏感细菌所导致全身或局部的感染,如治疗动物呼吸道、肠道、尿道、心内膜、脑膜、牛乳腺炎等其他疾病。由于其价格低廉、毒性低,使用过程中对动物无副作用,体内残留少等特点,被广泛用于畜牧业。
1研究意义
用于测定氨苄西林钠药物浓度当前研究的方法普遍有HPLC,荧光免疫测定法,酶联免疫吸附测定、反相高效液相色谱法和微生物法等。阮详春等[4]用高效液相色谱法测定肌肉组织中的氨苄西林钠含量,该方法标准曲线工作范围0.01~10μg/mL,血浆中最低测定浓度为0.001μg/mL,日内平均cv%为0.1%,日间平均cv%为0.14%,平均回收率为95.23%。王颖等[5]报道反相高效液相色谱法测定氨苄西林药物浓度。该方法标准曲线的工作范围在0.3~20μg/mL,r=0.999 4。日内、日间平均cv%<7.6%,回收率为98.8%。高效液相色谱法和反相高效液相色谱法对样品进行预处理较为复杂,因此不适用于现场快速检测。也需要特殊的仪器和试剂进行测量。尹致丹[6]量子点荧光免疫法测定牛奶中氨苄青霉素残留,该方法cv%为2.1%~9.2%,检测线为2.5μg/L,回收率为94.2%。该方法受基质影响大,二抗制备更复杂。Broto M等[7]使用酶联免疫吸附法检测牛奶中氨苄西林钠的含量,该方法的检测线为0.1μg/L。该方法的检测结果容易受到杂质的影响,并且存在假阳性或假阴性。一次只能测试一种药物,因此需要更多的抗体,导致成本增加。
免疫分析法需要选择合适的配体进行结合反应,线性范围较窄[8],而液相色谱法由于某些抗生素不存在紫外吸收特性,无法应用仪器法进行检测。多组分抗生素在不同组分的结构和生物学活性上存在差异,在化学分析方法的测定结果中很难以准确表达组分、组成、含量和生物学活性之间的关系[9]。
抗生素检测方法可以直接、特异性地反映抗生素的抗菌活性。李文平等[10]用微生物法测定鸡肉组织中氨苄西林残留,使用藤黄八叠微球菌作为检定菌,标准曲线工作范围是8.89~67.50 ng/mL,r=0.997,回收率为77%~96%,日间、日内cv%<11%。该方法灵敏度高、仪器要求简单、结果容易观察,可以用于对氨苄西林钠浓度分析。
本试验旨在建立一种检测血浆中氨苄西林钠的微生物方法。以藤黄八叠微球菌作为试验菌,采用管碟法测定血浆中氨苄西林钠的浓度,为测定血浆中氨苄西林钠的含量提供了参考。
2材料与方法
2.1材料与试剂
2.1.1试剂和药品
注射用氨苄西林钠(1 g/瓶,批号200708,购于华南动药保健股份公司);抗生素Ⅰ号培养基、营养琼脂培养基和肉汤琼脂培养基(购于苏州渝北生物公司)。
2.1.2菌种和样品
藤黄八叠球菌[CM(B)28001],批号C0072B,购于上海辉有科技公司;鸡血浆,实验室自制。
2.1.3仪器和设备
恒温水浴锅,购于边云市东山实验仪器厂;单人超净工作台,型号SW-DJ-5FD,购于江苏德化器材有限公司;高压灭菌锅,购于上海国全医疗器械厂;恒温生化培养箱,购于杭州恒飞科学器材有限公司。
2.2方法
2.2.1藤黄微球菌菌悬液的制备
挑取藤黄微球菌[CMCC(B)44103]在无菌营养琼脂表面连续划线培养活化,37℃培养24 h后,即获得纯化的藤黄微球菌。接种环用酒精灯灭菌冷却后,挑取平板上生长的单菌落,接种到5 mL肉汤培养基试管中。将其放置于34℃120 r/min摇床培养24 h,即获得藤黄微球菌菌悬液。
2.2.2藤黄微球菌生长曲线
用无菌移液器吸头,取1 mL细菌悬液注入9 mL无菌蒸馏水中,摇匀以均匀分散细菌,静置20~30 s,形成浓度为10-1的稀释液。使用另一只1 mL无菌移液器吸头,吸取1 mL的浓度为10-1的稀释液,转移到装有9 mL无菌蒸馏水的试管中,吹吸溶液3次,使细菌稀释液混匀,即配制成稀释浓度为10-2的稀释液;用另一只无菌移液器吸取1 mL的浓度为10-2的稀释液,将其转移到装有9 mL无菌水的试管中,然后吹打3次以形成浓度为10-3的稀释液。依此类推,重复稀释一系列细菌溶液,配制成稀释浓度为10-4、10-5、10-6、10-7、10-8、10-9。
取100μL稀释浓度为1×10-5的菌液于无菌营养琼脂培养基中,用无菌玻璃涂布器均匀涂布,静置10 min,再将培养基倒放入培养箱中培养,每4 h观察1次结果,培养结束时,计算平板上的菌落数并记录,选择计数为30~300个细菌数的平板作为测量细菌总数的标准,计算相同稀释浓度下不同平板上生长的细菌数,每个稀释浓度重复3个平板求出平均值,以绘制以时间为横坐标,细菌的活菌数的对数值为纵坐标的生长曲线。
2.2.3氨苄西林钠药品配制
准确称量注射用氨苄西林钠1 g,放置于10 mL容量瓶中,加9.6 mL灭菌蒸馏水溶解并摇匀,使其充分溶解,制成浓度为100 mg/mL的氨苄西林钠药液。取1 mL稀释后的药液定容至100 mL容量瓶中,即稀释浓度为100 mg/mL药液;再取1 mL稀释浓度为100 mg/mL的药液定容到100 mL容量瓶中,稀释成10 mg/mL药液,再用空白血清进行倍比稀释,按1∶2的剂间比逐步稀释成5.00、2.50、1.25、0.62、0.31、0.16、0.08、0.04μg/mL的工作液。
2.2.4双层含菌平板的制备
取带有陶瓦盖的平底双碟,分装灭菌后加热熔化的I号培养基20 mL,使其在平板底内匀称铺平,将其平稳放在水平台面上使其冷凝,作为底层培养基。另取高压灭菌后放至到55℃的培养基300 mL,加入20 mL菌液,摇匀消泡后,在每个加有底层培养基的平板上加入5 mL含有细菌的培养基,使其在底层上匀称铺平,作为含菌层。将牛津杯经过酒精灯干热灭菌后,稍微冷却后,取4个牛津杯等距等高码放双碟中,用陶瓦盖覆盖备用。整个过程平板口靠近酒精灯,严格进行无菌操作。在每个双碟中间隔的2个牛津杯中分别加入200μL相同浓度的稀释药液,其余2个杯中分别加入200μL另一个浓度稀释药液。双层培养基平稳送入恒温培养箱37℃培养24 h后,使用电子游标卡尺测量各个平板抑菌圈的直径,记录数据,计算其均值。
2.2.5标准曲线的建立
分别取氨苄西林钠浓度为5.00、2.50、1.25、0.62、0.31、0.16、0.08μg/mL和0.04μg/mL工作液,按2.2.4方法进行试验,设标准曲线y=ax-b,计算各个浓度下抑菌圈直径的平均值,以测得抑菌圈直径(D)为横坐标,氨苄西林钠在血浆中浓度的对数(lgC)为纵坐标,建立标准曲线,并求出线性回归方程及相关系数(r)。
2.2.6精密度试验
用血浆稀释不同浓度的氨苄西林钠溶液,制成药物浓度为高浓度(5μg/mL)、中等浓度(0.31μg/mL)、低浓度(0.04μg/mL)的药品溶液,按照2.2.4方法,每个浓度重复5次,连测3 d,将抑菌圈直径代入随行标准曲线,计算血药浓度,测定日内误差;另取上述3种浓度的氨苄西林钠溶液,按2.2.4方法每日测定,连测3 d,测定日间误差。
2.2.7回收率试验
按照2.2.4方法测定浓度为高浓度(5.0μg/mL)、中等浓度(0.31μg/mL)、低浓度(0.04μg/mL)的氨苄西林钠溶液,将结果代入标准曲线,计算实际药物浓度与添加浓度之比即为该方法的回收率,同时分别计算每个浓度的平均回收率和cv%。
3结果和讨论
3.1结果
3.1.1藤黄微球菌生长曲线
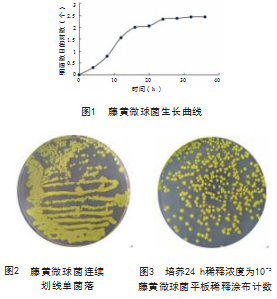
如图1所示,随着时间的逐渐增加,细菌数目逐渐增加,可知藤黄微球菌在24 h达到最适生长时间,此时藤黄微球菌的活菌群数如图2、图3所示,约为216群。根据预试验可知在使用稀释浓度为10-5时为最佳菌层浓度。故本试验使用生长时间为24 h稀释浓度为10-5的藤黄微球菌菌悬液。
3.1.2氨苄西林钠标准曲线
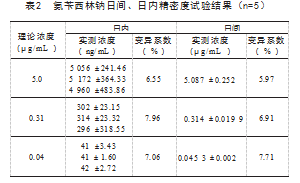
在0.04~5.0μg/mL浓度下,氨苄西林钠药物浓度的对数和抑菌圈直径具有良好的线性关系,标准曲线线性回归方程为y=0.288x-3.127 5,r=0.997(y表示药物浓度的对数,x表示抑菌圈直径)。氨苄西林钠标准曲线及其原始数据见表1和图4。
3.1.3精密度
将测量数据代入标准曲线计算可知氨苄西林钠在5.0、0.31、0.04μg/mL浓度时日内cv%为6.55%~7.96%,日间cv%为5.97%~7.71%。可认为本试验具有高重复性,可以满足测定标准,数据见表2。
3.1.4回收率
从表3可以看出,氨苄西林钠在本试验测定方法下,使用5.0μg/mL检测其实际浓度为(4.89±0.226)μg/mL,使用0.31μg/mL测定其实际浓度为(0.304±0.012 8μg/mL,使用0.04μg/mL检测其实际浓度为(0.04±0.001 41)μg/mL,该方法回收率范围为97.8%~100%,变异系数为3.95%~5.17%,符合试验要求。
3.2讨论
3.2.1不同方法测定氨苄西林钠浓度结果对比分析
盛杰等[11]使用微生物法测定血清中氨苄青霉素浓度,该方法标准曲线工作范围在0.232 9~0.698 8μg/mL内,r=0.999 1,日内cv%为1.44%~3.94%,日间cv%为1.27%~3.42%,氨苄青霉素日间的回收率为97.51%~104.16%。本试验操作步骤参照国家药典微生物检定法和该文献进行,试验基本数据符合检定标准并与该文献接近,说明该方法可靠。本试验工作曲线范围为0.04~5.00μg/mL,测定最低检测浓度为0.04μg/mL,比文献使用最低工作浓度低,有较高的灵敏度。回收率为97.8%~100%,比文献较高,符合检测方法。但本试验结果中日内、日间变异系数大于文献结果,说明本试验的精密度较差,重复性较低,操作方法不熟练,应多次重复试验增加试验数据,降低误差。王大菊等[12]使用微生物法测定猪和鸡组织中氨苄青霉素残留,以藤黄微球菌为检定菌,标准曲线范围在0.001 25~0.02μg/mL,日内和日间cv%均在10%以下,回收率在83%~107%。该文献使用微生物方法检测鸡组织中氨苄西林钠含量,未检测血浆中药物浓度。本试验回收率在97.8%~100%,文献方法检测高,说明组织中氨苄西林钠含量的检测受多种杂质的影响,如蛋白质与药物结合,降低药物检测率,回收率偏低。而使用空白血浆测定药物浓度,影响因素较少,故检测回收率较高。
孙礼瑞等[13]使用高效液相色谱荧光检测法检测鸡肝脏中氨苄西林残留量,该方法线性标准曲线工作范围为25~1 000μg/kg,日内cv%<9.21%,日间cv%<12.78%,回收率在75.31%以上。路杨等[14]建立了超高效液相色谱—串联质谱法测定牛奶中氨苄西林钠含量的方法,该方法的线性标准曲线工作范围为0.01~0.5μg/mL,方法回收率为70.9%~101.6%。孟欢欢等[15]报道了高效毛细管电泳测定牛奶中氨苄青霉素的含量的方法,在10~100μg/mL的浓度范围,r=0.9 9 8 9,回收率为8 0%~9 2%,变异系数范围为3.02%~10.11%。本试验使用微生物法的检测结果,日内cv%为6.55%~7.96%,日间cv%为5.97%~7.71%,回收率为97.8%~100%。与使用仪器方法测定结果相比,本试验标准曲线工作范围是0.04~5.00μg/mL,日内、日间变异系数均低于8%,回收率高达97%以上。使用仪器法检测血浆和牛奶中氨苄西林钠的含量,与微生物法相比回收率较低,说明微生物法方法可靠、精密度、回收率高,可以满足检测血浆中氨苄青霉素的需求。
3.2.2影响试验结果因素讨论
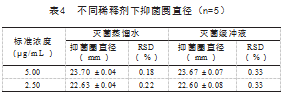
根据文献可知,使用不同pH值缓冲液会影响抑菌圈的形状出现卵圆形抑菌圈影响测量结果[16],故试验中要严格控制缓冲液pH值,为避免pH值因素对试验结果,进而讨论了对使用不同种稀释剂对试验结果的影响。根据盛杰等[11]报道可知使用灭菌蒸馏水、灭菌缓冲液在0.3μg/mL浓度测超高效液相色谱—串联质谱法测定牛奶中4种β-内酰胺类抗生素及其主要代谢产物量抑菌圈直径分别为(1.244±0.052)、(1.232±0.027)cm,在0.7μg/mL浓度下测量抑菌圈直径分别为(1.990±0.01)、(1.972±0.02)cm,同浓度不同稀释剂之间无显著差异。本试验使用同样方法测定同浓度下抑菌圈直径,经表4数据进行统计学处理可知,同浓度不同稀释剂对抑菌圈直径无显著差异(P>0.05),符合文献报道。本试验稀释药品使用的是灭菌蒸馏水,该稀释剂对抑菌圈直径无影响。
张可煜等[17]对藤黄微球菌对8种抗生素药物的敏感性进行相关试验数据表明,在β-内酰胺类药物中,藤黄微球菌对氨苄青霉素最敏感,对头孢氨苄不敏感。说明使用藤黄微球菌进行微生物法检测有一定的特异性,且氨苄西林钠对革兰氏阳性菌有很好的抗菌活性,藤黄微球菌作为国家药典微生物检定法中的标准菌株,目前对于微生物管碟法检测抗生素含量研究常使用藤黄微球菌作为检定菌。为方便本试验的开展,故选用藤黄微球菌作为本试验检定菌。
本试验中需要操作熟练,减少操作不当造成的误差,如控制培养基温度在55℃左右,培养基温度过高会杀死细菌,造成试验失败;温度过低使得培养基提前凝固,造成倾倒培养基形成平面高低不平,导致形成不规则的抑菌圈。试验中应减少恒温培养箱开关门次数,降低温度变化,影响试验抑菌圈的形成。
4结论
建立了测定血浆中氨苄西林钠浓度的微生物方法。该方法样品前处理简单、灵敏度高、精密度高(日内变异系数≤8%;日间变异系数≤7.8%),氨苄西林钠在0.04~5.00μg/mL浓度下药物浓度对数与其抑菌圈直径有良好线性关系,r=0.997,回收率高达97%。该方法快速、灵敏、可靠、简便,适用于血浆中氨苄西林钠浓度的检测。
参考文献
[1]阮祥春,曾明华.氨苄青霉素残留检测方法研究进展[J].动物医学进展,2008(8):91-96.
[2]邢浩春,陈建中,葛水莲,等.动物源性食品中β-内酰胺类抗生素前处理及检测方法研究进展[J].食品与发酵工业,2016,42(3):268-274.
[3]汤雨晴,叶倩,郑维义.抗生素类药物的研究现状和进展[J].国外医药(抗生素分册),2019,40(4):295-301.
[4]阮祥春,曾明华,陶小平.高效液相色谱法检测猪血浆和肌肉组织中的氨苄青霉素残留[J].中国兽药杂志,2007(5):14-17.
[5]王颖,张宁,吕慧怡.反相高效液相色谱法测定氨苄西林及丙磺舒血药浓度的方法学研究[J].大连医科大学学报,2006(3):240-241.
[6]尹致丹.量子点荧光免疫法测定牛奶中氨苄青霉素残留的研究[D].北京:中国农业科学院,2019.
[7]Broto M,Matas S,Babington R,et al.Immunochemical detection of penicillins by using biohybrid magnetic particles[J].Food Control,2015,51:381-389.
[8]马燕红,王妍,李*刚,等.动物源性食品中青霉素类药物残留检测[J].食品科学,2018,39(24):317-321.
[9]张明.抗生素微生物检定法:浊度法方法验证浅析[J].现代畜牧兽医,2019(2):12-15.
[10]李文平,阚鹿枫,马浩.微生物法测定鸡肉组织中的氨苄西林残留[J].中国兽药杂志,2004(9):20-22.
[11]盛杰,周嘉秀,郑志安.微生物法测定血清中氨苄青霉素的浓度[J].中国医院药学杂志,1992(2):7-9,49.
[12]王大菊,袁宗辉,范盛先,等.氨苄青霉素在猪和鸡组织残留的微生物测定法研究[J].华中农业大学学报,1999(3):245-247.
[13]孙礼瑞,马晓萌,谢恺舟,等.高效液相色谱荧光检测法检测鸡组织中氨苄西林残留量[J].安徽农业科学,2014,42(20):6 615-6 617,6 620.
[14]路杨,王丽英,秦振顺,等.超高效液相色谱—串联质谱法测定牛奶中4种β-内酰胺类抗生素及其主要代谢产物[J].食品安全质量检测学报,2021,12(5):1 662-1 668.
[15]孟欢欢,陈玎玎,祁克宗.高效毛细管电泳检测牛奶中氨苄青霉素和阿莫西林残留方法的建立[J].动物医学进展,2008(1):32-35.
[16]任仲丽,张秀花,王静,等.管碟法测定抗生素效价影响因素与控制方法的研究进展[J].中国当代医药,2020,27(25):27-29,33.
[17]张可煜,王大菊,袁宗辉,等.猪和鸡可食性组织中氨苄青霉素残留的微生物学检测法[J].中国兽医学报,2004(5):470-472.










