1例自繁种猪场猪蓝耳病抗体监测与分析论文
2024-12-17 11:07:44 来源: 作者:dingchenxi
摘要:猪蓝耳病是由猪繁殖与呼吸道综合征病毒引起的传染性疾病,主要引起猪的呼吸困难、发烧、厌食以及母猪繁殖障碍等症状。
摘要:猪蓝耳病是由猪繁殖与呼吸道综合征病毒引起的传染性疾病,主要引起猪的呼吸困难、发烧、厌食以及母猪繁殖障碍等症状。为了解某规模化母猪场对猪蓝耳病疫苗的免疫情况,通过对广西梧州某自繁种猪场随机抽取产后母猪、配怀母猪、公猪、产房仔猪、保育舍仔猪、育肥猪共258份样本,采用酶联免疫吸附试验(ELISA)对样品蓝耳病抗体水平进行检测分析。结果显示,该猪场的平均阳性率为80%,S/P值为1.02,离散度为63%,整体水平良好。但在不同阶段的猪群中仍存在一定的差异,产后母猪、产房仔猪和育肥猪的阳性率及S/P平均值偏低、离散度偏高,未到达合格水平,存在一定的感染风险,需要进一步优化免疫程序,加强生物安全体系建设,提高整体免疫水平。
关键词:养猪场;猪蓝耳病;抗体;监测
0引言
仔猪病症主要表现为呼吸系统障碍,死亡率高。高致病性蓝耳病还可引起成年猪群皮肤发红发绀、发热、食欲废绝、耳尖发紫,对应激敏感,呼吸障碍和急性死亡。临床上可见部分PRRSV感染病猪耳部发绀等症状。1996年,VR2332-LikePRRSV在中国出现,但没有引起大流行[1-2]。2006年,出现了以高烧为主要致病特征的亚型8.7,俗称高致病性PRRSV(HP-PRRSV)JXA1,给养猪业造成重大损失。2012年,NADC30-LikePRRSV首次出现在中国并且是目前最流行的毒株[3-4]。2017年,NADC34-LikePRRSV首次被报道[5-6],是在中国迅速传播的毒株另一种亚型1.5。2020年和2021年,NADC34-Like毒株分别占阳性病例的11.5%和28.6%,并已传播到中国的8个省份[7]。亚型变化、基因重组和流行病株突变对我国的PRRSV防控工作提出了重大挑战[8]。本试验选取广西梧州市某规模的母猪场,该猪场一直正常养殖管理,符合样本选取要求,按照试验设计对该猪场的猪开展血清采集、抗体检测以及结果分析讨论,依据检测结果在了解各类猪群的蓝耳病抗体水平情况下,提出有效防疫措施,为猪场防控蓝耳病提供参考意见。
1材料与方法
1.1猪场情况
该规模化猪场位于广西梧州地区,目前存栏8头公猪、231头母猪、412头产房仔猪、650头保育舍仔猪、1 250头育肥猪,属于自繁自养二元母猪场。
1.2免疫程序
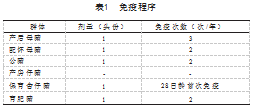
使用经典毒株VR2332的猪蓝耳病疫苗通过肌肉注射的方式进行免疫,免疫程序见表1。
1.3血样采集
2023年6月对该规模场猪群进行采样,随机抽取50头配怀母猪、50头产后母猪、8头公猪、50头产房仔猪、50头保育舍仔猪、50头育肥猪,在前腔静脉采血,每份取3~5 mL,采好后置于离心管内,做好分类编号,采集完成统一送往实验室,采集的血液样品须在室温下静置0.5 h,直到样品凝固,再将血样以2 000~3 000 r/min,离心5~10 min,取上层血清;将清澈血清收集于干燥洁净的指型管中,并做好标记。
1.4样品检测
采用酶联免疫吸附试验对样品抗体进行检测。操作方法和步骤参照试剂盒说明书,试剂盒由美国IDEXX公司生产,在酶标仪上检测各孔OD值,按照试剂盒相关要求算出对应的抗体检测结果。
1.5结果计算与判定
认真按照试剂盒结果判定标准开展结果判定,得出计算结果。设置检测样本组、对照组,根据吸光光度值换算出对照比率(S/P值)判定PRRS抗体水平,依据S/P值进行结果判定:S/P值<0.4判定为阴性;PRRS抗体结果S/P值≥0.4判定为阳性;CV值反映猪群体中个体之间的差异大小的数据指标,用于衡量风险大小。离散度CV值:CV=S/y×100%。计算式里y表示样本平均数,S表示样本标准差[9]。
2结果与分析
通过试验血清检测,猪场各类猪群蓝耳病抗体的数据结果见表2和图1。对该规模场的258份样品进行蓝耳病抗体检测,免疫抗体阳性率总体为80%,达到合格标准要求,整个规模场的蓝耳抗体水平总体良好。其中,配怀母猪、公猪均为100%,保育舍仔猪次之,为83%,产后母猪76%,产房仔猪65%,育肥猪56%。保育舍仔猪S/P平均值最高,为1.87,配怀母猪为1.35,公猪为1.12,产房仔猪为0.76,产后母猪为0.59,最低的是育肥猪0.43,总体平均值为1.02。在检测中,S/P最大值在公猪中检测出,为2.83,S/P最小值在育肥猪中检测出,为0.04。从离散度来看,育肥猪最高145%,产房仔猪次之,为76%,产后母猪为56%,配怀母猪为42%,保育舍仔猪为34%,公猪最低,为22%,猪群平均离散度为63%。
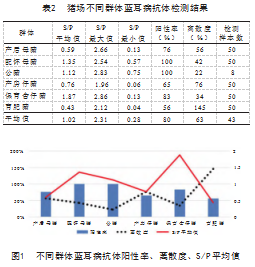
根据临床经验及试剂盒厂家的推荐,良好的猪场蓝耳病抗体阳性率在80%以上,离散度在30%左右,S/P值在0.8~1.2,并且保证猪的高抗比例(S/P值大于2.5的猪)占猪群5%以内[10]。结合S/P值、阳性率和离散度来看,该猪场公猪和配怀母猪的阳性率和S/P值都比较高,离散度较低,说明公猪和配怀母猪处于蓝耳病免疫有效期。产房仔猪阳性率低于平均水平,S/P值较低但离散度不高,可以认为是母源抗体,应该及时采样进行抗原检测,通过抗原检测结果来认定猪群是否处于感染初期,对于产房仔猪达到次免疫日期时,要及时免疫。育肥猪S/P值、阳性率都比较低,且离散度最大,表明猪群健康状况较差,免疫效果不理想,存在感染猪蓝耳病的风险,猪场管理人员要及时开展补免程序。保育舍仔猪蓝耳抗体未见异常,推测是该猪场对保育舍仔猪首次免疫不久。产后母猪群阳性率为76%,阳性率未达合格要求,S/P平均值偏低为0.59,离散度为56%,个体之间猪蓝耳病抗体水平差异大,应考虑对猪群使用猪蓝耳病疫苗进行补免。
3讨论
抗体水平作为猪群对疫病抵抗和疫病免疫的重要指标之一。从本次试验样本抽取和检测结果分析可以看出,整个猪场的蓝耳抗体水平虽然保持在75%以上,但猪场的个别群体的蓝耳抗体水平是达不到合格水平的,如产房仔猪、育肥猪分别为65%和56%,这可能与产房仔猪尚未开始接种蓝耳疫苗以及猪场对育肥猪蓝耳疫苗接种的重视度不够有关。从离散度和S/P值也可以反映猪群抗体水平的稳定性,如果离散度高,S/P值低,表明该猪群抗体水平不稳定,需要加强疫苗接种及时补免。在本试验中的数据可以反映出该猪群的公猪和配怀母猪不仅抗体水平合格,而且抗体水平比较稳定,具有较强的抗病能力。育肥猪离散度高达145%,S/P平均值值较低,为0.43,从检测数据来看,育肥猪的蓝耳抗体表现极其不稳定,需要管理人员高度重视,以免影响场内其他猪群。
4小结
蓝耳病毒还会与猪瘟病毒、伪狂犬病毒、猪圆环病毒等发生二重、三重、四重感染,使得猪发病更加严重,给疫病防控带来更加严峻的挑战。作为危害我国猪群健康的主要疫病之一,猪场一旦发生蓝耳病,对养殖户造成重大经济损失,影响养猪业健康发展。为减少猪蓝耳病的发生,可以通过制定有效的免疫程序和科学的血清学抗体检测措施,预防疾病的发生,及时评估猪场抗病能力,提升猪场生物安全水平。血清学抗体水平是评估免疫效果的科学依据,对动物疾病预防和控制有着重要意义。猪场管理人员对场内猪群定期开展猪蓝耳病抗体水平检测,了解各猪群每个阶段的蓝耳抗体水平,可以为免疫程序的优化提供科学依据,确保抗体水平合格,科学高效防控猪场蓝耳病。
目前,预防动物疫病的有效方法仍然是科学合理的疫苗接种。按照动物疫病防控思路,以“以防为主”的原则,不断加强猪场管理人员的防控意识水平,结合猪场实际情况,制定合理的免疫程序,定期开展疫病抗体水平检测或者病原检测,及时掌握猪群健康状况。当猪群的抗体水平较低或对疫病免疫能力下降时,要考虑进行二次免疫或补免,还要甄别疫苗的有效性问题。在饲养的同时根据猪群日龄特性以及本场发病特点,制定并开展适当的药物保健。防止猪群感染病毒性疫病后,机体免疫体系受到损害,很容易继发感染或混合感染其他细菌类病原菌,使猪群的病因与症状复杂化,给猪群的健康带来更为严峻的康复威胁。因此,在猪场的日常管理过程中,按免疫程序做好病毒性疫病的免疫防控工作,同时需要定期对猪群进行药物保健,对猪场环境进行消毒,提高猪群的抵抗力,降低继发或混合感染的风险。
参考文献
[1]李培勋.2021—2022年山东省猪繁殖与呼吸综合征流行病学调查及分离毒株遗传进化分析[D].济南:山东农业大学,2023.
[2]Liu J,Xu Y,Lin Z,et al.Epidemiology investigation of
PRRSV discharged by faecal and genetic variation of ORF5[J].Transbound Emerg Dis,2021,68(4):2 334-2 344.
[3]Zhao K,Ye C,Chang X B,et al.Importation and Recombination are Responsible for the Latest Emergence of Highly Pathogenic Porcine Reproductive and Respiratory Syndrome Virus in China[J].J Virol,2015,89(20):10 712-10 716.
[4]Zhou F,Zhao J,Chen L,et al.Complete Genome Sequence of a Novel Porcine Reproductive and Respiratory Syndrome Virus That Emerged in China[J].Genome Announc,2015,3(4):e00 702-e00 715.
[5]Bao H,Li X.Emergence and spread of NADC34-like PRRSV in China[J].Transbound EmergDis,2021,68(6):3 005-3 008.
[6]Zhao J,Xu L,Xu Z,et al.Emergence and spread of NADC34-like PRRSV in Southwest China[J].Transbound Emerg Dis,2022,69(5):e3 416-e3 424.
[7]Xu H,Li C,Li W,et al.Novel characteristics of Chinese NADC34-like PRRSV during 2020—2021[J].Transbound Emerg Dis,2022,69(5):e3 215-e3 224.
[8]Yu Y,Zhang Q,Cao Z,et al.Recent Advances in Porcine Reproductive and Respiratory Syndrome Virus NADC30-Like Research in China:Molecular Characterization,Pathogenicity,and Control[J].Front Microbiol,2022,11(12):791 313.
[9]冯洪恩.一例规模化猪场蓝耳病抗体检测报告的分析[J].当代畜牧,2023(7):8-10.
[10]康桦华.规模化种猪场猪蓝耳病和猪瘟抗体变化规律研究及在健康流程管理中的应用[D].广州:华南农业大学,2016.










