水牛奶及荷斯坦牛奶对Caco-2细胞抗炎抗氧化能力的影响论文
2024-11-28 16:10:21 来源: 作者:liziwei
摘要:该试验旨在探究水牛奶及荷斯坦牛奶各组分对人结直肠癌细胞(Caco-2)抗炎抗氧化能力的影响。分别用水牛奶及荷斯坦牛奶各组分预处理细胞,后使用终浓度为1μmol/L的LPS或H2O2诱导细胞,通过CCK-8、qPCR、流式细胞术、ELISA及MDA、SOD、CAT和GSH-Px试剂盒检测细胞抗炎抗氧化能力的变化。结果显示,与对照组相比,各组Caco-2细胞的存活率显著上升(P<0.05);各组TNF-α、IL-1β、IL-6蛋白及mRNA的表达量均降低,Nrf-2的表达量显著上升(P<0.05),Keap1
摘要:该试验旨在探究水牛奶及荷斯坦牛奶各组分对人结直肠癌细胞(Caco-2)抗炎抗氧化能力的影响。分别用水牛奶及荷斯坦牛奶各组分预处理细胞,后使用终浓度为1μmol/L的LPS或H2O2诱导细胞,通过CCK-8、qPCR、流式细胞术、ELISA及MDA、SOD、CAT和GSH-Px试剂盒检测细胞抗炎抗氧化能力的变化。结果显示,与对照组相比,各组Caco-2细胞的存活率显著上升(P<0.05);各组TNF-α、IL-1β、IL-6蛋白及mRNA的表达量均降低,Nrf-2的表达量显著上升(P<0.05),Keap1的表达量显著降低(P<0.05)。水牛奶及荷斯坦牛奶作用于Caco-2细胞后,相比对照组,ROS含量均显著下降(P<0.05);各组SOD含量相比对照组均上升;MDA含量除荷斯坦全奶组和水牛乳清组外,其余各组相比对照组均显著下降(P<0.05);CAT含量相比对照组均显著上升(P<0.05);GSH-Px(GPx)含量相比空白组均显著下降(P<0.05)。试验结果表明,水牛奶及荷斯坦牛奶作用于细胞后,能不同程度的提升Caco-2细胞的抗炎抗氧化能力。
关键词:人结直肠癌细胞;炎症;氧化应激
0引言
牛奶含有多种人体所需的多种营养物质,如蛋白质、氨基酸等。由于奶业的快速发展,奶产量逐年上升,牛奶及其衍生产品(奶酪等)的消费市场也在不断扩大。牛奶中含有抗氧化剂,包括酶类抗氧化剂和非酶抗氧化剂,如维生素、乳铁蛋白和酪蛋白等,它们能有效地防止和减少自由基和脂质过氧化物的形成。牛奶中的抗氧化活性物质在保证其稳定性、营养价值和生理功能方面发挥重要作用。有研究表明,乳源的抗氧化物质对于自由基可以起到抑制其形成及清除已形成自由基的能力,同时还可以抑制活性氧的形成。在慢性炎症及免疫系统的调节中,营养物质的补充至关重要。研究发现,牛奶中的抗炎物质可以减少细胞中由TNF-α所介导的前列腺素2系列的分泌。水牛奶及荷斯坦牛奶的营养组成较相似,均富含多种营养成分和生物活性物质,但是其含量存在不小的差异,这意味着2种牛奶的生物学特性也具有一定的差异。牛奶中生物活性化合物的抗炎抗氧化能力大多是在Caco-2细胞体外模型上进行初步评价的,其能够模拟肠道屏障,从而研究代谢物对远处器官的吸附和分布。本研究使用水牛奶及荷斯坦牛奶,研究其各组分作用于Caco-2细胞后,对细胞抗炎抗氧化能力的影响,为重新评估在肠道细胞模型中,水牛奶及荷斯坦牛奶对健康的影响提供了一定的数据参考。
1材料与方法
1.1试验材料
1.1.1细胞
Caco-2细胞从上海酶研生物科技有限公司购入。
1.1.2试剂
D MEM高糖培养基(21068028)和胰蛋白酶(25200056)购自Gibco,胎牛血清(FBS,35-081-CV)购自普诺赛公司,脂多糖(LPS,L8880)、CCK-8试剂盒(C0037)、ROS检测试剂盒(S0033)购自碧云天生物技术公司,HiScript®III 1st Strand cDNA Synthesis Kit(R323-01)购自诺唯赞生物科技有限公司,青链霉素混合液(P1400)、SOD试剂盒(BC0170)、MDA试剂盒(BC0020)、CAT试剂盒(BC0200)和GSH-Px试剂盒(BC1190)购自索莱宝科技有限公司,TNF-αELISA试剂盒、IL-1βELISA试剂盒和IL-6 ELISA试剂盒购自九邦生物科技有限公司。
1.1.3主要仪器与设备
细胞培养箱(Thermo,a3111)、倒置显微镜(Nikon,TI-E)、离心机(Thermo,Heraeus Multifuge X3)、声波聚焦流式细胞仪(Invitrogen,Attune MT Nxt)、多功能酶标仪(TECAN,A-5082)、实时荧光定量PCR仪(Roche,LightCycler96)。
1.2试验方法
1.2.1细胞培养及分组处理
C a c o-2细胞置于含2 0%FB S、1%双抗的高糖DMEM培养液中,于37℃、5%CO2培养箱中培养。将Caco-2细胞分为8组,即空白组(Blank)、对照组(Control)、水牛全奶组(BWMG)、水牛乳脂组(BMFG)、水牛乳清组(BMWG)、荷斯坦全奶组(HWMG)、荷斯坦乳脂组(HMFG)和荷斯坦乳清组(HMWG)。
Caco-2细胞按照不同浓度接种于不同规格的孔板,过夜培养后,加入水牛奶和荷斯坦牛奶不同组分共培养4 h,后更换为完全培养基;空白组和对照组加入等体积的完全培养基。
1.2.2细胞活力测定
将处于对数期生长Caco-2细胞接种于96孔板,调整细胞浓度至5×103个/孔,于37℃、5%CO2条件下培养;按照1.2.1的分组处理各组细胞,待细胞密度为80%时,换液加入终浓度为1μmol/L的LPS或H2O2分别共培养24 h或1 h后,每孔加入10μL CCK-8,调整酶标仪波长为450 nm,测定各孔OD值。
1.2.3 ELISA试剂盒检测炎症因子的表达水平
将处于对数期生长Caco-2细胞接种于6孔板,调整细胞浓度至7.5×105个/孔,于37℃、5%CO2条件下培养;按照1.2.1的分组处理各组细胞,待细胞密度为80%时,换液加入终浓度为1μmol/L的LPS共培养24 h;处理后的细胞弃去培养基,PBS洗3次,加入胰酶(含EDTA)消化2 min,转移至15 mL离心管,离心(1 200 r/min,3 min),弃上清,加入配好的裂解液(RIPA∶PMSF=1 mL∶10μL),吹打重悬细胞后置于冰上裂解30 min后,4℃离心(1 000 r/min,10 min),取上清备用。按照ELIAS试剂盒说明书进行炎症因子表达水平的检测。
1.2.4实时荧光定量PCR
将处于对数期生长Caco-2细胞接种于6孔板,调整细胞浓度至7.5×105个/孔,于37℃、5%CO2条件下培养;按照1.2.1的分组处理各组细胞,待细胞密度为80%时,换液加入终浓度为1μmol/L的LPS或H2O2分别共培养24 h或1 h后,提取RNA,经逆转录后,应用Real-time PCR方法检测TNF-α、IL-1β、IL-6、Nrf-2及Keap1 mRNA的表达水平。反应总体积为20μL,PCR扩增程序为95℃预变性30 s;95℃变性10 s,60℃扩增30 s,40个循环;95℃变性15 s,60℃扩增1 min,95℃变性15 s。于每个退火步骤之后,进行荧光数据采集,60~95℃绘制熔解曲线,采用自动分析软件进行试验数据分析。引物序列由南宁捷尼斯生物科技有限公司合成,引物序列见表1。

1.2.5流式细胞术检测细胞内活性氧水平
将处于对数期生长Caco-2细胞接种于6孔板,调整细胞浓度至7.5×105个/孔,于37℃、5%CO2条件下培养;按照1.2.1的分组处理各组细胞,待细胞密度为80%时,换液加入终浓度为1μmol/L的H2O2共培养1 h后,弃去培养基,PBS洗涤2次。加入终浓度为10μmol/L的DCFH-DA(1 mL/孔);37℃、5%CO2条件下孵育20 min;用无血清细胞培养液洗涤细胞3次,收集细胞,使用流式细胞仪对细胞内ROS含量进行检测。
1.2.6试剂盒检测Caco-2细胞中MDA、SOD、CAT和GSH-Px的水平
将处于对数期生长Caco-2细胞接种于6孔板,调整细胞浓度至7.5×105个/孔,于37℃、5%CO2条件下培养;按照1.2.1的分组处理各组细胞,待细胞密度为80%时,换液加入终浓度为1μmol/L的H2O2共培养1 h后,按照试剂盒要求检测MDA的含量及SOD、CAT和GSH-Px活力。
2结果
2.1水牛奶及荷斯坦牛奶乳成分分析
乳成分分析结果如表2所示,其中水牛奶的乳脂、蛋白质、总固形物和SNF含量显著高于荷斯坦牛奶(P<0.05),而水牛奶的乳糖含量低于荷斯坦牛奶。

2.2水牛奶、荷斯坦牛奶对LPS诱导下Caco-2细胞形态及活力的影响
对LPS诱导前后的Caco-2细胞的细胞形态进行了观察,结果如图1A所示。空白组细胞形态完整、排列紧密、边界光滑,对照组细胞漂浮数量增加,空泡化严重,而水牛奶及荷斯坦牛奶处理后的各组细胞相比对照组边界更清晰、形态更为完整。

经LPS诱导24 h后不同组别的CCK-8检测结果如图1B所示。结果表明,水牛奶及荷斯坦各组与对照组相比均提高了LPS诱导下的细胞存活率(P<0.05),荷斯坦全奶组细胞存活率为82%左右,其余各组细胞存活率均为95%左右。结果表明,水牛奶及荷斯坦牛奶各组分作用于Caco-2细胞后,提高了细胞的存活率,使细胞对LPS诱导的炎症均有一定的抵抗能力。
2.3炎症因子mRNA的表达水平
炎症因子mRNA的表达水平如图2所示。经LPS诱导24 h后,对照组Caco-2细胞内TNF-α、IL-1β、IL-6含量均显著升高(P<0.01);而经水牛奶及荷斯坦牛奶各组分处理4 h后再进行诱导的Caco-2细胞,其TNF-α、IL-1β、IL-6含量均有不同程度的下降,其中水牛全奶组的TNF-α、IL-1β、IL-6含量均显著下降(P<0.01)。结果表明,LPS诱导细胞炎症模型建立成功,水牛奶及荷斯坦牛奶作用于细胞后提高了细胞的抗炎能力,其中水牛全奶组效果最为显著,说明水牛全奶对于预防炎症有较好的功效。
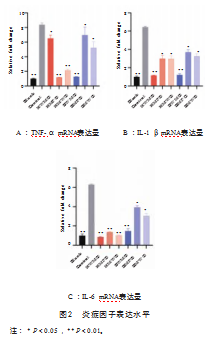
2.4 TNF-α、IL-1β、IL-6表达量(ELISA)
各炎症因子的表达量如表3所示。经LPS诱导后,对照组TNF-α的表达量显著高于空白组(P<0.05),经水牛奶和荷斯坦牛奶各组分处理后,各组的TNF-α的表达量显著低于对照组(P<0.05);其中水牛全奶组、水牛乳脂组及水牛乳清组的TNF-α的表达量相比荷斯坦全奶组、荷斯坦乳脂组及荷斯坦乳清组均下降;LPS诱导后,对照组IL-1β的表达量显著高于空白组(P<0.05),经水牛奶和荷斯坦牛奶各组分处理后,各组的IL-1β的表达量显著低于对照组(P<0.05),其中水牛乳脂组的IL-1β的表达量显著低于其余处理组(P<0.05);LPS诱导后,对照组IL-6的表达量显著高于空白组(P<0.05),经水牛奶和荷斯坦牛奶各组分处理后,除水牛乳脂组和水牛乳清组外,其余各组IL-6的表达量显著低于对照组(P<0.05)。

2.5水牛奶及荷斯坦牛奶对H2O2诱导下Caco-2细胞形态及活力的影响
对H2O2诱导前后的Caco-2细胞的细胞形态进行了观察。结果如图3A所示,空白组细胞形态完整、排列紧密、边界光滑,对照组细胞边界模糊、漂浮死细胞数量增加,而水牛奶及荷斯坦牛奶处理后的各组细胞相比对照组边界更清晰、形态更为完整,漂浮死细胞数较少。

经H2O2诱导1 h后不同组别的CCK-8检测结果如图3B所示,结果表明,水牛奶及荷斯坦各组与对照组相比均提高了H2O2诱导下的细胞存活率(P<0.05)。其中荷斯坦全奶组及水牛奶各组均显著提高了细胞存活率(P<0.01),荷斯坦全奶组的细胞存活率约为88%左右,水牛奶各组的细胞存活率分别为97%、98%及97%左右。结果表明,水牛奶及荷斯坦牛奶各组分作用于Caco-2细胞后,提高了细胞的存活率,使细胞对H2O2诱导的氧化应激均有一定的抵抗能力。
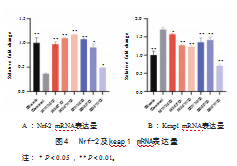
2.6 Nrf-2及Keap1 mRNA的表达水平
Nrf-2及Keap1 mRNA的表达水平如图4所示。经H2O2诱导1 h后,对照组Caco-2细胞内Nrf-2含量均显著降低(P<0.01),Keap1含量均显著升高(P<0.01);而经水牛奶及荷斯坦牛奶各组分处理4 h后再进行诱导的Caco-2细胞,其Nrf-2含量相比对照组均有不同程度的上升,而Keap1含量相比对照组则有不同程度的下降,即Nrf-2 mRNA的表达水平与Keap1 mRNA的表达水平呈次相反趋势。结果表明,H2O2诱导细胞氧化应激模型建立成功,水牛奶及荷斯坦牛奶作用于细胞后提高了细胞的抗氧化能力,说明水牛奶及荷斯坦牛奶对于预防氧化应激都具有较好的功效,其中水牛奶的效果较为显著。
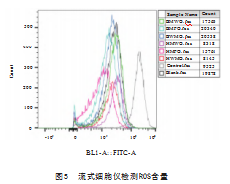
2.7 ROS、MDA、SOD、CAT及GSH-Px含量的测定
水牛奶和荷斯坦牛奶各组分作用于Caco-2细胞后,通过H2O2来诱导氧化应激。ROS检测结果如图5所示,水牛奶和荷斯坦牛奶各组作用于细胞后,相比对照组,均降低了H2O2诱导后Caco-2细胞中的ROS含量。其中,如图5峰值所在横坐标可知,相比对照组,其余各组ROS含量均显著降低;而在水牛各组分中,水牛乳脂组的ROS含量更低。
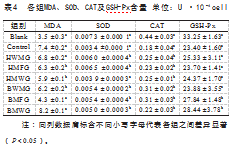
如表4所示,水牛奶和荷斯坦牛奶各组分作用于细胞后,除荷斯坦全奶组和水牛乳清组外,其余各组MDA含量相比对照组显著下降(P<0.05);除荷斯坦乳清组外,其余各组SOD含量相比对照组均显著升高(P<0.05),各组CAT含量相较于对照组均显著上升(P<0.05),其中水牛奶相较于荷斯坦牛奶各组升高更显著(P<0.05);各组GSH-Px(GPx)含量相比空白组均显著降低(P<0.05),而水牛乳脂组和水牛乳清组相比对照组则显著升高(P<0.05)。
3讨论
本研究基于Caco-2细胞模型,研究了水牛奶与荷斯坦牛奶作用于细胞后对其抗炎抗氧化能力的影响。近年,对牛奶中功能因子的研究再次成为热门话题。本研究发现,细胞活力升高的原因可能是水牛奶及荷斯坦牛奶各组分在不同程度上提高了细胞的抗炎能力。Chen H Y等[13]的研究表明,牛奶蛋白具有多功能活性,如免疫调节、抗炎、抗菌和抗癌特性等。在本研究中,通过对炎症因子TNF-α、IL-1β、IL-6表达量的测定,发现水牛奶及荷斯坦牛奶各组分均能在不同程度上抑制LPS诱导的炎症因子的释放。这与Leischner C等研究相符,其研究表明酪蛋白、乳清蛋白及其衍生物与乳脂等成分一起,在调节免疫力、预防感染及抗炎等方面的作用越来越明显。
在氧化应激损伤的各项指标中,同样利用CCK-8法测定细胞活性,经过水牛奶及荷斯坦牛奶的处理后,细胞活力均有一定提升,说明各组分均有一定的抗氧化特性,这与Bertino E等的研究相符。在本研究中,经过H2O2的诱导刺激1 h后,对照组相比空白组,Nrf-2显著降低(P<0.01),Keap1表达量显著升高(P<0.01),该趋势与之前的研究一致,其余各组相比对照组,Nrf-2表达量均显著升高(P<0.05),与其对应的Keap1表达量均显著降低(P<0.05);说明不管是水牛奶还是荷斯坦牛奶,其各组分均具有一定的抗氧化能力,这与Aresta A等[17]所得结论保持一致。之前已有研究表明,诱导氧化应激会导致抗氧化酶系统和MDA含量的变化[18]。在本研究中,SOD、CAT和GSH-Px的变化趋势相似,当不同组分的水牛奶及荷斯坦牛奶作用于细胞后,与对照组相比,SOD、CAT和GSH-Px的含量升高。水牛奶及荷斯坦牛奶的不同组分能有效提高3种抗氧化酶活力,与空白组差异显著(P<0.05)。ROS含量也表明,H2O2对细胞有强烈的损害作用,H2O2诱导氧化损伤后,ROS水平显著升高(峰值右移明显),而当不同组分的水牛奶及荷斯坦牛奶作用于细胞后,ROS的含量相比对照组显著左移。水牛奶及荷斯坦牛奶可能是通过增强抗氧化系统酶活性和减少脂质过氧化产物MDA含量等功能,减轻自由基的损伤效力,维持细胞内环境的稳定,从而起到提升细胞抗氧化能力的作用,这与前人的研究结果相符合。综上,牛奶中所含有的抗炎抗氧化活性物质在保证其稳定性、营养价值和生理功能方面发挥着重要作用。
4结论
本研究发现水牛奶及荷斯坦牛奶作用于细胞后,均能不同程度的提升细胞的抗炎抗氧化能力。其中,水牛奶对细胞抗炎抗氧化的影响相比荷斯坦牛奶来说更为显著。而在水牛奶各组分中,水牛奶乳脂作用于细胞后对细胞活力的影响最为显著。本研究所述的水牛奶各组分的抗炎抗氧化特性为研究水牛奶及荷斯坦牛奶的功能提供了一定的数据支持。
参考文献:
[1]Visioli F,Strata A.Milk,dairy products,and their functional effects in humans:a narrative review of recent evidence[J].Adv Nutr,2014,5(2):131-143.
[2]Huang Y,Tocmo R,Nauman M C,et al.Defining the Cholesterol Lowering Mechanism of Bergamot(Citrus bergamia)Extract in HepG2 and Caco-2 Cells[J].Nutrients,2021,13(9):3 156.
[3]Stobiecka M,Król J,Brodziak A.Antioxidant Activity of Milk and Dairy Products[J].Animals(Basel),2022,12(3):245.
[4]Liu Z,Logan A,Cocks B G,et al.Seasonal variation of polar lipid content in bovine milk[J].Food chemistry,2017,237:865-869.
[5]Moon J Y,Lee S,Jeong S,et al.Free radical-scavenging activities and cytoprotective effect of polyphenol-rich ethyl acetate fraction of guava(Psidium cattleianum)leaves on H2O2-treated HepG2 Cell[J].Journal of the Korean Society for Applied Biological Chemistry,2013,56(6):687-694.
[6]Aldoori J,Cockbain A J,Toogood G J,et al.Omega-3 polyunsaturated fatty acids:moving towards precision use for prevention and treatment of colorectal cancer[J].Gut,2022,71(4):822-837.
[7]Dierge E,Debock E,Guilbaud C,et al.Peroxidation of n-3 and n-6 polyunsaturated fatty acids in the acidic tumor environment leads to ferroptosis-mediated anticancer effects[J].Cell Metab,2021,33(8):1 701-1 715.
[8]Colarow L,Turini M,Teneberg S,et al.Characterization and biological activity of gangliosides in buffalo milk[J].Biochimica Et Biophysica Acta,2003,1 631(1):94-106.
[9]Maity S,Ambatipudi K.Quantitative proteomics of milk whey reveals breed and season specific variation in protein abundance in Holstein Friesian cow and Murrah buffalo[J].Research in Veterinary Science,2019,125:244-252.
[10]Vohra V,Kumar B T,Dayal S,et al.Genetic variants of beta-lactoglobulin gene and its association with milk composition traits in riverinebuffalo[J].J Dairy Res,2006,73(4):499-503.
[11]Qingbiao Xu H H J W.Bioavailability of bioactive peptides derived from food proteins across the intestinal epithelial membrane:A review[J].Trends in Food Science&Technology,2019,86:399-411.
[12]Sadeghi E S,Iskandar M M,Sleno L,et al.Absorption and Metabolism of Phenolics from Digests of Polyphenol-Rich Potato Extracts Using the Caco-2/HepG2 Co-Culture System[J].Foods,2018,7(1):8.
[13]Chen H Y,Mollstedt O,Tsai M H,et al.Potential clinical applications of multi-functional milk proteins and peptides in cancer management[J].Curr Med Chem,2014,21(21):2 424-2 437.
[14]Leischner C,Egert S,Burkard M,et al.Potential Protective Protein Components of Cow's Milk against Certain Tumor Entities[J].Nutrients,2021,13(6):1 974.
[15]Bertino E,Peila C,Cresi F,et al.Donor Human Milk:Effects of Storage and Heat Treatment on Oxidative Stress Markers[J].Front Pediatr,2018,6:253.
[16]Khan I T,Nadeem M,Imran M,et al.Antioxidant capacity and fatty acids characterization of heat treated cow and buffalo milk[J].Lipids Health Dis,2017,16(1):163.
[17]Aresta A,De Santis S,Carocci A,et al.Determination of Commercial Animal and Vegetable Milks'Lipid Profile and Its Correlation with Cell Viability and Antioxidant Activity on Human Intestinal Caco-2 Cells[J].Molecules(Basel,Switzerland),2021,26(18):5 645.
[18]Miao T,Song G,Yang J.Protective Effect of Apple Polyphenols on H2O2-Induced Oxidative Stress Damage in Human Colon Adenocarcinoma Caco-2 Cells[J].Chemical&pharmaceutical bulletin,2023,71(4):262-268.










