高原腹部创伤对猪免疫器官的影响论文
2024-11-13 17:07:23 来源: 作者:liziwei
摘要:为探究高原腹部创伤对免疫器官的影响,该研究选取33只长白仔猪,随机分为平原腹部创伤组(LN组)和高原腹部创伤组(HC组),每组按0、8、24 h时间点采集脾脏、胸腺、肠系膜淋巴结组织样品,并制作脾脏和胸腺组织切片,HE染后观察组织结构变化。结果表明,腹部创伤后猪免疫器官脾脏、胸腺和肠系膜淋巴结有间质毛细血管扩张充血、淋巴细胞数量减少等病理变化。
摘要:为探究高原腹部创伤对免疫器官的影响,该研究选取33只长白仔猪,随机分为平原腹部创伤组(LN组)和高原腹部创伤组(HC组),每组按0、8、24 h时间点采集脾脏、胸腺、肠系膜淋巴结组织样品,并制作脾脏和胸腺组织切片,HE染后观察组织结构变化。结果表明,腹部创伤后猪免疫器官脾脏、胸腺和肠系膜淋巴结有间质毛细血管扩张充血、淋巴细胞数量减少等病理变化。
关键词:高原;创伤;脾脏损伤;胸腺;肠系膜淋巴结;组织切片
0引言
目前,各类意外(车祸、撞击、刺穿伤)及非法打猎极易导致稀有品种动物或大、小动物受伤或死亡,尤其在高原、戈壁偏远地区国家保护动物腹部创伤频发[1-3]。高原复合环境(低压低氧寒冷)和腹部创伤均可造成不同程度生理功能紊乱和机体代谢功能失调,导致免疫系统损伤。高原环境基础上出现腹部创伤会加重机体免疫系统负担,出现生理功能紊乱、机体代谢功能失调,继而导致免疫功能障碍。本文选择猪为试验动物模型,初步观察高原环境下腹部创伤对试验猪免疫器官损伤作用。
1材料与方法
1.1材料与试剂
甲醛、乙醇、二甲苯、伊红、苏木精、石蜡等。
1.2方法
1.2.1试验动物
本试验选择2~3月龄,体重为(30~35)kg雄性长白仔猪33只,购于新疆泰昆农牧科技有限责任公司,检疫合格证明(NO.9001068323)。
1.2.2动物分组与处理
将33只2~3月龄长白仔猪,分为6组,分别为平原腹部创伤0、8、24 h组(每组5头),高原腹部创伤0、8、24 h组(每组6头)。试验猪颈部注射阿托品注射液(1mL:0.5mg),10min注射氯胺酮注射液(6mL:150mg)进行麻醉后腹部射击。致伤后0、8、24h取脾脏组织浸泡于4%多聚甲醛溶液。
1.2.3试验猪脾脏组织切片制作
取材后分别进行固定、脱水、浸蜡包埋和切片。
2结果
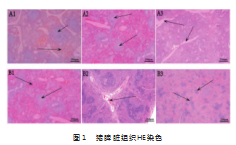
2.1平原、高原环境下腹部创伤对猪脾脏组织的影响
如图1所示,同一时间点LN组与HC组相比,0 h点LN组可见白髓和红髓结构清晰,HC组可见生发中心,白髓范围减少;8 h点LN组可见白髓范围减少,HC组可见间质血管充血扩张;24 h点LN组可见小梁轻度增生,HC组可见白髓范围减少及散在分布。
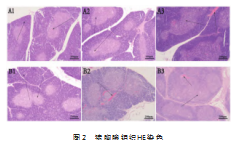
2.2平原、高原环境下腹部创伤对猪胸腺组织的影响
如图2所示,同一时间点LN组与HC组相比,0 h点LN组皮质区和髓质区结构清晰,可见胸腺小体,HC组可见较多的巢状结构,皮质区髓质区未见明显改变;8 h点LN组可见胸腺小体外周的细胞较幼稚,HC组可见毛细血管扩张充血;24 h点LN组可见血管轻度充血,髓质增大,HC组可见大部分髓质增大,胸腺小体数量增多,轻度充血。
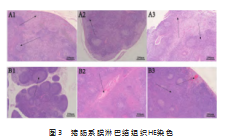
2.3平原、高原环境下腹部创伤对猪肠系膜淋巴结组织的影响
如图3所示,同一时间点LN组与HC组相比,0 h点LN组可见生发中心,被膜下淋巴窦增宽,又可见部分淋巴小结,HC组可见被膜下可见次级淋巴小结,副皮质区较为明显;8 h点LN组可见少量浆细胞,被膜下部分淋巴小结淋巴细胞数量减少,HC组可见间质中血栓形成和血管扩张;24 h点LN组可见淋巴小结结构不太清晰,间质中血管轻度扩张充血,HC组可见被膜下毛细血管扩张充血,副皮质区淋巴细胞数量减少。
3讨论
腹部创伤是指各种物理、化学和生物的外源性致伤因素作用于机体,导致腹壁或腹腔内部组织器官结构完整性以及同时或相继出现的一系列功能障碍。由于腹腔脏器遭受严重损伤,致组织缺血缺氧,机体则产生应激反应,并释放大量炎性介质,加重局部组织损伤。腹腔脏器破裂出血,机体很快会出现血流灌注不足,生理功能处于紊乱,出现低温,凝血功能障碍和重度酸中毒。腹部创伤中血管损伤占95%,引起大量失血,同时还合并周围器官损伤。而肝脾等脏器破裂时,腹腔广泛存在着不同密度样的血肿和大量积液,易出现失血性休克。还影响正常的凝血机制。当胰腔破裂时,引起多器官功能衰竭死亡。上述失血性休克,多器官功能衰竭均可诱发机体一系列创伤后继发性损害的发生。其中,包括腹腔感染引起的腹腔脓肿或腹膜炎以及毒素血症,细菌移位引起的脓毒症或脓毒性休克等。胸部创伤引起的五高典型特征是,脏器损害发生率高、出血性休克发生率高、感染率高、多器官功能障碍综合征发生率高,死亡率高,对机体本身造成很大的威胁。
高海拔地区平均海拔超过2 500 m,常年寒冷气候(年平均气温低于10℃)相伴的自然生态系统,而免疫系统是淋巴器官、细胞、体液因子和细胞因子的互动网络,它们共同作用,并产生针对体内入侵和有害压力源的免疫反应。众多研究表明,高海拔低氧低温条件与机体免疫的具有相关性。若高原复合环境基础上出现腹部创伤会加重机体免疫器官损伤及负担。
免疫器官,如脾脏、胸腺和淋巴结,在细胞介导免疫应答和确保建立保护性应答以抵消有害刺激的影响方面发挥重要作用。这些高度复杂的生物反应涉及巨噬细胞、树突状细胞和各种免疫细胞,包括淋巴细胞。由白细胞组成的淋巴细胞可分为T细胞、B细胞和自然杀伤细胞。自然杀伤细胞(NK)细胞属于先天免疫系统,在保护宿主免受癌细胞、细菌和病毒感染细胞的侵害方面发挥着重要作用。T细胞和分泌的细胞因子与适应性或细胞介导的免疫反应有关,而B细胞和抗体是体液免疫反应的关键因素。此外,免疫系统的失衡与自身免疫性疾病和各种器官炎症反应引起的疾病有关。
脾脏是最大免疫器官,其中存在丰富多样的免疫细胞群,它们与先天免疫和适应性免疫有着密不可分的联系。胸腺作为初级淋巴器官,参与胸腺细胞分化为成熟的T淋巴细胞,T淋巴细胞从胸腺迁移形成外周T细胞,外周T细胞对适应性免疫系统至关重要。淋巴结是淋巴系统的卵形器官,其功能包括免疫反应、抑制或耐受。
本试验通过观察病理切片发现,脾脏白髓范围减小,间质血管扩张充血。胸腺大部分髓质增大,胸腺小体数量增多,轻度充血。肠系膜淋巴结被膜下毛细血管扩张充血,副皮质区淋巴细胞数量减少。本试验组织病理变化结果与郑素玲[20]和王思芦等研究结果相一致。试验结果表明,高原腹部创伤对猪免疫器官有一定损伤作用,可减少组织中淋巴细胞、巨噬细胞增殖,这将抑制免疫器官的正常结构和功能出现病理变化,且与平原腹部创伤组相比,高原腹部创伤组病理损伤更显著。其他高原环境下猪腹部创伤有关免疫变化及机制仍需进一步研究。
参考文献:
[1]杨红娇,代瑞雪,蜂红妹,等.犬车祸骨折并发尿道破裂与软组织损伤的诊断与治疗[J].现代畜牧兽医,2022(5):34-39.
[2]臧高.青藏高原的珍稀动物[J].环境,2012(3):72-xx.
[3]Risselada M.Perforating Cervical,Thoracic,and Abdominal Wounds[J].Veterinary Clinics of North America:Small Animal Practice,2017,47(6):1 135-1 148.
[4]陈志达,吴佳佳,卫勃,等.野战条件下多发伤动物模型损伤控制外科救治效果分析及卫勤手术力量优化的思考[J].解放军医学院学报,2022,43(7):763-768.
[5]黄彪,李建国,黄发贵.多发伤的诊疗进展[J].医学综述,2019,25(5):973-977.
[6]Suzanne E,Ethan T,Nicholas H,et al.Mesenteric Vascular Injury in Trauma:an NTDB study[J].Ann Vasc Surg,2020,70:542-548.
[7]刘淑芳,李娇.休克指数指导在外伤性肝脾破裂大出血患者救护中的应用[J].承德医学院学报,2022,39(2):146-148.
[8]邬燕萍,高捷,施孝海,等.急诊超声对钝性腹部创伤内脏破裂出血的诊断分析[J].浙江创伤外科,2020,25(3):588-589.
[9]Huang L,Luo M,Xia X.Bacterial translocation in acute pancreatitis[J].Crit Rev Microbiol,2019,45(5-6):539-547.
[10]Haupt J,Krysiak N,Unger M,et al.The potential of
adipokines in identifying multiple trauma patients at risk of developing multiple organ dysfunction syndrome[J].Eur J Med Res,2021,26:38.
[11]Leon M,Chavez L,Surani S.Abdominal compartment syndrome among surgical patients[J].WJGS,2021,13(4):330-339.
[12]Li J,Jian Y,Jia L,et al.Molecular characterization of tick-borne bacteria and protozoans in yaks(Bos grunniens),Tibetan sheep(Ovis aries)and Bactrian camels(Camelus bactrianus)in the Qinghai-Tibetan Plateau Area,China[J].Ticks and Tick-borne Dis,2020,11:101 466.
[13]Khanna K,Mishra K P,Ganju L,et al.High-Altitude-Induced alterations in Gut-Immune Axis:A review[J].International Reviews of Immunology,2018,37(2):119-126.
[14]Springer T A.Adhesion receptors of the immune system[J].Nature,1990,346(6 283):425-434.
[15]Wynn T A,Chawla A,Pollard J W.Macrophage biology in development,homeostasis and disease[J].Nature,2013,496(7 446):445-455.
[16]Spiering M J.Primer on the immune system[J].Alcohol Res,2015,37(2):171-1xx.
[17]Raj S,Gothandam K M.Immunomodulatory activity of methanolic
extract of Amorphophallus commutatus var.wayanadensis under normal and cyclophosphamide induced immunosuppressive conditions in mice models[J].Food Chem Toxicol,2015,81:151-159.
[18]Shin J S,Chung S H,Lee W S,et al.Immunostimulatory effects of cordycepin-enriched WIB-801CE from Cordyceps militaris in spleno cyte s and cy clophosph amide-induced immunosuppressed mice[J].Phytother Res,2018,32(1):132-139.
[19]Bai J,Zhang L,Zhao Z,et al.Expression of melatonin receptors and CD4 in the ovine thymus,lymph node,spleen and liver during early pregnancy[J].Immunology,2020,160(1):52-63.
[20]郑素玲,郑素琴,石洪陵,等.亚硒酸钠对小鼠免疫器官组织结构的影响[J].动物医学进展,2004,25(4):94-96.
[21]王思芦.鸡枞菌多糖抗环磷酰胺对小鼠免疫器官损伤的作用[J].动物医学进展,2013,34(4):56-59.










