不同杀虫剂对鸡柔嫩艾美耳球虫卵囊孢子化的影响论文
2024-11-07 11:34:59 来源: 作者:liziwei
摘要:为了解不同杀虫剂对鸡柔嫩艾美耳球虫卵囊孢子化的影响,为鸡球虫病的防治提供参考。试验采用不同浓度的大灭25CS(1:50、1:100)、保安定500EC(1:2 500、1:5 000)、大灭G 15.1%ZC(1:100、1:200)、剑心200SC(1:800、1:1 600)分别对鸡柔嫩艾美耳球虫卵囊作用24、48 h,观察其对球虫卵囊孢子化的影响。结果表明,不同杀虫剂对鸡柔嫩艾美耳球虫卵囊的孢子化均有一定的抑制作用,但其抑制作用随着时间的推移有所减弱;不同杀虫剂使鸡柔嫩艾美耳球虫孢子化卵囊的外观结构
摘要:为了解不同杀虫剂对鸡柔嫩艾美耳球虫卵囊孢子化的影响,为鸡球虫病的防治提供参考。试验采用不同浓度的大灭25CS(1:50、1:100)、保安定500EC(1:2 500、1:5 000)、大灭G 15.1%ZC(1:100、1:200)、剑心200SC(1:800、1:1 600)分别对鸡柔嫩艾美耳球虫卵囊作用24、48 h,观察其对球虫卵囊孢子化的影响。结果表明,不同杀虫剂对鸡柔嫩艾美耳球虫卵囊的孢子化均有一定的抑制作用,但其抑制作用随着时间的推移有所减弱;不同杀虫剂使鸡柔嫩艾美耳球虫孢子化卵囊的外观结构出现皱褶、凹陷等变化。这些试验结果为鸡柔嫩艾美耳球虫病的预防提供了新的思路。
关键词:柔嫩艾美耳球虫;杀虫剂;卵囊
0引言
鸡球虫病一直被列为我国《一二三类动物疫病病种名录》的三类动物疫病,是一种具有重要经济意义的疾病,几乎可以说,有养鸡的地方就有鸡球虫的存在。球虫所造成的经济损失,参考Williams 1995年的统计数据,全球因鸡球虫病引起的经济损失高达30亿美元。20多年过去了,包括巴西、中国和印度在内,养鸡数量成倍增长,全球鸡饲养量比1995年翻了一番以上,加上货币购买力因素的变化,根据Williams模型2016年更新的数据表明,鸡球虫病的全球损失保守估计为130亿美元。而我国养鸡总量约占全球20%,球虫造成的损失保守估计为150亿人民币。
鸡球虫病是由艾美耳属球虫感染引起的,目前世界公认的鸡球虫种类有7种,其致病力由强到弱为柔嫩艾美耳球虫、毒害艾美耳球虫、布氏艾美耳球虫、巨型艾美耳球虫、堆型艾美耳球虫、和缓艾美耳球虫、早熟艾美耳球虫。球虫属于单宿主型寄生虫,生活周期不需要通过中间宿主,在外界环境中(主要指土壤)发育到感染期后可以直接感染宿主。
为探讨不同杀虫剂有效成分是否对球虫卵囊具有抑制作用,试验中选择4种不同杀虫剂的有效成分对鸡柔嫩艾美耳球虫卵囊孢子化率的影响进行研究。
1材料与方法
1.1试验动物
1日龄海兰褐蛋公雏20只,购自南京特给力种养专业合作社,分笼饲喂于经严格消毒的鸡笼中(每笼10只),饮水经煮沸消毒,饲喂自配无抗球虫药的饲料。
1.2主要试验药物
大灭(2.5%高效氯氟氰菊酯CS)、保安定(50%甲基嘧啶磷EC)、大灭G(15.1%高效氯氟氰菊酯·噻虫嗪ZC)、剑心(200 g/L氯虫苯甲酰胺SC),均由先正达(中国)投资有限公司提供。
1.3鸡柔嫩艾美耳球虫卵囊
由南京农业大学寄生虫教研室保存、惠赠。
1.4卵囊的处理与试验分组
1.4.1卵囊的处理
球虫卵囊的培养:将保存的鸡柔嫩艾美耳球虫卵囊3 000 r/min离心10 min,去上清后,在沉淀中加入等量的2.5%重铬酸钾溶液并移入平皿中,置27~29℃生化培养箱中培养72 h;80%以上卵囊孢子化后,置4℃冰箱中保存,备用。期间每天用吸管反复吹打培养液3~4次,并视情况滴加2.5%重铬酸钾溶液防止干涸,但培养液深度不超过2 cm。
球虫卵囊的继代培养:将上述孢子化卵囊按3.0×104个/只(0.3 mL/只)经口一次性感染2周龄雏鸡10只(试验组、对照组10只经口灌服等量的生理盐水)进行卵囊继代增数,攻毒后从第72 h开始,每天用饱和食盐水漂浮法检查粪便中有无卵囊出现,并观察血便和死亡情况。攻毒1周后逐只剖杀,取盲肠内容物及盲肠黏膜于研钵内轻轻研磨后加适量生理盐水搅匀,分别置于40目铜丝筛和260目尼龙筛中过滤,将滤液以3 000 r/min离心10 min;弃去上清液,在沉淀物中加入饱和食盐水,充分搅匀后以3 000 r/min离心漂浮10 min;吸取上层液体加入约10倍量清水,充分搅匀后再以3 000 r/min离心10 min;弃去上清液,沉淀中加入等量的2.5%重铬酸钾溶液,收集卵囊,放入4℃冰箱保存,备用。
1.4.2试验分组
试验共分10个组,1~8组分别为大灭(2.5%高效氯氟氰菊酯CS)、保安定(50%甲基嘧啶磷EC)、大灭G(15.1%高效氯氟氰菊酯·噻虫嗪ZC)、剑心(200 g/L氯虫苯甲酰胺SC)处理组,9组为阴性对照组(生理盐水),10组为阳性对照组(8%氨水),见表1。
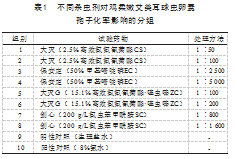
参考Fetterer R H等[6]的研究结果,每组2个重复。将收集待用的未孢子化的卵囊液和重铬酸钾溶液以1∶19的比例混合,配成A溶液,调整浓度为1.0×105个/mL。再按表1的稀释倍数量计算出4种不同杀虫剂有效成分所需要的的体积(总体积为5 mL),与A溶液充分混合,分别加入10 mL的管中,混悬球虫未孢子化卵囊。在48 h时将试验各组的卵囊按扫描电镜样品要求处理后加入2.5%的戊二醛固定液内固定、送检。
1.4.3对鸡柔嫩艾美耳球虫卵囊孢子化率的影响试验
在28℃恒温摇床振荡孢子化培养48 h,每12 h打开盖子透氧1次。分别在24、48 h时混匀,在各管中取出500μL加入2 mL的EP管中,剩下的混合液放回继续28℃恒温振荡培养。将取出的500μL的混合液4 000 r/min离心8 min,除去药液并加水重复洗涤3次,最后加入500μL的水,用血球计数法在显微镜下计数球虫卵囊的孢子化率和孢子化抑制率,评价不同杀虫剂有效成分对卵囊的孢子化抑制效果。卵囊孢子化率(%)=孢子化卵囊数量/(孢子化卵囊数量+未孢子化卵囊数量)×100%;孢子化抑制率(%)=(处理组平均未孢子化率-对照组平均未孢子化率)/(1-对照组平均未孢子化率)×100%。
2试验结果
2.1攻毒试验
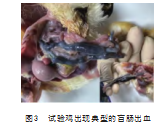
在攻毒后第4天,试验组鸡相继出现临床症状。病初食欲减退,翅膀下垂,羽毛松乱,缩头闭眼,呆立或伏卧,呈昏睡状,第5天出现血便,采食量明显减少,到第7天共有7只排血便(图1、图2),有3只相继死亡。剖检发病鸡见明显的盲肠出血(图3),对照组鸡未出现上述临床表现,粪便中未发现卵囊,无死亡。


2.2不同杀虫剂对球虫卵囊孢子化率和孢子化抑制率的影响
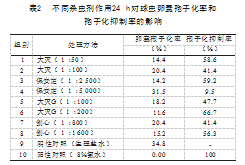
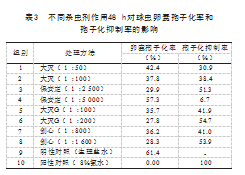
不同杀虫剂在24、48 h时对球虫卵囊孢子化率和孢子化抑制率的影响,见表2和表3。可以看出不同杀虫剂对鸡柔嫩艾美耳球虫卵囊的孢子化均有一定的抑制作用,但其抑制作用随着时间的推移有所减弱。
2.3不同杀虫剂有效成分对球虫卵囊孢子化影响的扫描电镜观察
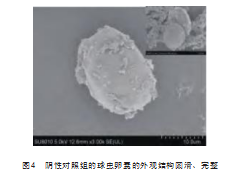
从送检样品的电镜扫描结果看,阴性对照组(生理盐水组)卵囊的外观结构圆滑、完整(图4),阳性对照组(氨水组)卵囊的外观变形、发生皱褶、凹陷等(图5),各试验组卵囊的外观发生了与阳性对照组类似的外观变化,只是变化的程度略轻(图6~图9)。根据形态结构决定功能的理论,说明不同杀虫剂对鸡柔嫩艾美耳球虫孢子化卵囊的形态结构造成了不同程度的影响,进而影响了球虫卵囊的孢子化进程,为鸡柔嫩艾美耳球虫病的防控提供了理论依据。


3讨论与结论
成熟的孢子化球虫卵囊经粪—口途径进入鸡的肠道,随食糜到达其特异性寄生部位(盲肠或小肠的特定位置),钻入肠上皮细胞内进行爆炸性的繁殖,导致血管破裂、肠上皮细胞崩解,从而影响肠黏膜的完整性,失去屏障作用,引起消化机能紊乱,营养物质不能吸收,从而出现临床上所见的贫血、消瘦、血痢等症状。感染严重时,可继发肠道感染,同时大量崩解的肠上皮细胞和死亡的球虫虫体产生毒素,毒素被机体吸收后造成自体中毒。在临床上病鸡表现为精神委顿、食欲下降、运动失调、昏迷等临床现象,最终导致死亡。
从1990年之后,就没有新的抗球虫新药出现,原有抗球虫药物的耐药性及药物残留等问题正逐渐显现。加上我国饲料禁抗、限抗政策的实施(农业农村部发布第194号公告),寻找从源头上控制球虫卵囊的数量,针对传染病防控的3个环节(传染源、传播途径、易感动物),即加强卫生和生物安全措施,强化鸡舍和鸡舍内垫料的的处理,减少鸡经粪—口感染球虫就显得势在必行。
目前,环境消毒是预防鸡球虫病一个相对薄弱的环节,而环境中的球虫卵囊是引发鸡球虫病的重要因素,但还没有一种有效的在外环境中使用的球虫卵囊抑杀剂。氨可渗入卵囊壁进而抑制球虫卵囊发育,故氨水理论上可用于球虫的环境消毒,但氨水具有强烈的刺激作用,对鸡会造成一定程度的伤害,其应用受到限制。本试验的研究结果表明,不同杀虫剂处理组鸡柔嫩艾美耳球虫卵囊的孢子化率均低于阴性对照组,提示这些杀虫剂对球虫卵囊发育具有一定的抑制/抑杀效果,随着培养时间的延长(24~72 h),其抑制/抑杀效果有减弱的趋势。从试验结果看,大灭G、保安定的抑制效果更好。试验结果提示,试验用的杀虫剂可作为鸡球虫环境消毒的有效候选药物,各养鸡场可根据实际情况选择使用,以进一步确诊其实际临床使用效果。
参考文献:
[1]Williams R B.A compartmentalised model for the estimation of the cost of coccidiosis to the world's chicken production industry[J].International Journal for Parasitology,1999,29:1 209-1 229.
[2]Mesa C,Gomez-Osorio L M,Lopez-Osorio S,et al.Survey of coccidia on commercial broiler farms in Colombia:frequency of Eimeria species,anticoccidial sensitivity,and histopathology[J].Poultry Science,2021,100:101 239.
[3]Blake D P,Knox J,Dehaeck B,et al.Re-calculating the cost of coccidiosis in chickens[J].Vet Res,2020,51:115.
[4]朱博.鸡球虫卵囊分离收集和体外培养技术研究[D].晋中:山西农业大学,2013.
[5]李天乐.鸡球虫卵囊收集生产工艺的优化[D].晋中:山西农业大学,2022.
[6]Fetterer R H,Jenkins M C,Miska K B,et al.Metam sodium reduces viability and infectivity ofEimeria oocysts[J].J Parasitol,2010,96(3):632-637.
[7]Anita H,Williams R B,Larsen S,et al.Counting coccidial oocysts in chicken faeces:A comparative study of a standard McMaster technique and a new rapid method[J].Veterinary Parasitology,2006,136:233-242.
[8]王丽霞,郑明学,王运盛,等.消毒药对柔嫩艾美尔球虫卵囊的抑杀作用[J].中国家禽,2006,28(10):30-31.
[9]周作勇,王芝英,胡世君,等.6种杀虫剂对鸡柔嫩艾美耳球虫卵囊孢子化率及致病力的影响[J].中国兽医杂志,2015,51(3):91-94.
[10]温福利,张嘉,郑和平,等.不同药物与消毒剂对兔球虫卵囊孢子化的影响[J].实验动物与比较医学,2016,36(4):301-306.
[11]陈益,夏艳勋,贺桂芬,等.三种消毒剂对兔球虫卵囊孢子化的抑制作用研究[J].中国草食动物科学,2018,38(5):33-35.
[12]何学柏,迟依明,梁圣杰,等.对氯间甲酚及复方对氯间甲酚对鸡柔嫩艾美耳球虫卵囊的抑杀效果[J].西北农业学报,2024,33(1):8-14.
[13]索勋,李国清.鸡球虫病学[M].北京:中国农业大学出版社,1998.
[14]安健,王黎霞.鸡柔嫩艾美耳球虫与球虫病[M].北京:中国农业大学出版社,2008.
[15]Adnane R,Sanaa A,Latifa B,et al.In vitro destruction of Eimeria oocysts by essential oils[J].Veterinary Parasitology,2011,182:121-126.
[16]谢明权,卢奕民,温列娜.抑杀鸡球虫卵囊试验[J].中国兽医杂志,1983(10):2-5.










