鲈鱼尾水中微生物多样性研究论文
2024-06-06 11:53:41 来源: 作者:xieshijia
摘要:该文采用高通量测序法分析鲈鱼尾水中微生物的多样性,结果表明鲈鱼尾水的优势细菌门为变形菌门(Proteobacteria)、优势真菌门为子囊菌门(Ascomycota)。主要的菌属有hgcI_clades属、不整孢菌属(Plectosphaerella)、氢噬胞菌属(Hydrogenophaga)、黄杆菌属(Flavobacterium)、镰刀菌属(Fusarium)、Aphelidium属、虫草属(Cordyceps)、中国鳞伞属(Pholiota)。养殖场尾水的物种最多,群落丰富度最好,丰度均匀度最高,
摘要:该文采用高通量测序法分析鲈鱼尾水中微生物的多样性,结果表明鲈鱼尾水的优势细菌门为变形菌门(Proteobacteria)、优势真菌门为子囊菌门(Ascomycota)。主要的菌属有hgcI_clades属、不整孢菌属(Plectosphaerella)、氢噬胞菌属(Hydrogenophaga)、黄杆菌属(Flavobacterium)、镰刀菌属(Fusarium)、Aphelidium属、虫草属(Cordyceps)、中国鳞伞属(Pholiota)。养殖场尾水的物种最多,群落丰富度最好,丰度均匀度最高,实验室尾水物种最低,群落丰富度最少,丰度的均匀度最差,不同环境不同浑浊度鲈鱼尾水微生物多样性具有显著差异。
关键词:鲈鱼;尾水;微生物;多样性;结构;组成
Study on Microbial Diversity in Perch Tail Water
XU Changfeng1,2,WANG Haili1,3,TANG Weibin1,2,SONG Mengxuan1
(1.Xingtai University,Xingtai Hebei 054000,China;
2.Key Laboratory of Digital Freshwater Aquaculture Technology in Hebei Province,Xingtai Hebei 054000,China;
3.Hebei University of Economics and Business,Shijiazhuang Hebei 050200,China)
Abstract:The diversity of microorganisms in the tail water of sea bass was analyzed using high-throughput sequencing,and the results showed that the dominant bacteria in Perch tail water were Proteobacteria and Ascomycota.According to the study of species at intergenera level,the main fungi are hgcI clade,Plectosphaerella,Hydrogenophaga,Flavobacterium,Fusarium,
Aphelidium,Cordyceps and Pholiota.The results showed that there were the most species in silt,the best community richness,the highest abundance uniformity,the lowest species in laboratory tail water,the least community richness and the worst abundance uniformity.There were significant differences in the microbiology diversity of Perch tail water with different turbidity in different environments.
Keywords:Perch,tailwater,microbiology,diversity,structural,composition
0引言
鲈鱼营养丰富受到消费者喜爱,其对水体环境要求较高,水质对其尤为重要。有利菌群平衡可消除污染物,抑制有害藻繁殖,调节水体pH值,维持水体酸碱平衡,从而改善水质,因而可科学使用微生物技术改善水质。鲈鱼尾水微生物多样性可以影响鲈鱼质量[1-4],探究鲈鱼尾水中微生物多样性有助于生产高品质鲈鱼[5-8]。本文研究鲈鱼尾水中细菌菌群以及真菌群落结构,以期为鲈鱼养殖尾水净化工作提供参考。
1材料与方法
1.1试验材料
1.1.1鲈鱼尾水样品
样品取自养殖场鲈鱼尾水,并且依据浑浊度不同,由低到高将样品编号z-s1、z-s2、z-s3、z-s4,鲈鱼养殖场的淤泥编号z-n,实验室鲈鱼尾水编号s-s。取样分别不同方位进行取样后混合。

1.1.2试验器材与试剂
PCR仪:ABI GeneAmp®9700型;AxyPrepDNA凝胶回收试剂盒:AXYGEN公司;QuantiFluor™-ST蓝色荧光定量系统:Promega公司。
试剂:5×FastPfu Buffer,2.5×10-3 mol/L dNTPs,Forward Primer(5×10-6 mol/L),Reverse Primer(5×10-6 mol/L),FastPfu Polymerase,Template DNA,ddH2O,Tris-HCl,NaOH。
1.2研究方法
对6个样品分别处理,样品z-s1、z-s2、s-s水体澄清或略浑浊采用过滤瓶抽滤,过滤到直径3~4 cm孔径0.22μm滤膜再装入无菌密封袋,所采样品水体不少于5 L。z-s3、z-s4、z-n样品较为浓稠,直接取样品,样品量不少于3 g。
采用Illumina PE250测序技术[9-12],设计合适的引物接头并进行合成,细菌引物为341F-806R、真菌引物为ITS1F-ITS2R。随后分析鲈鱼尾水中的微生物多样性和丰富度。根据数据进一步分析鲈鱼尾水中细菌和真菌的多样性和丰富度。
2试验结果与数据分析
2.1尾水中细菌群落多样性
2.1.1 OTU分布花瓣图
图1结果显示,样品z-s1、z-s2、z-s3、z-s4各含有的细菌OTU总数分别为253、212、220、312。样品z-n含有细菌OTU总数为508。样品s-s含有的细菌OTU总数为214。水体和水体的差异没有水体和淤泥的差异大,淤泥的细菌群落要比水体的细菌群落丰富。

2.1.2细菌群落结构组分图
图2结果显示,属间水平6个样品细菌群落所占比例最高的都为未分类物种(Others)。s-s的hgcI_ clade属相对丰度略低于未分类物种,除了氢噬胞菌属(Hydrogenophaga)和Candidatus Competibacter属相对丰度比较低外,其余菌属的相对丰度较为均匀,在5%~15%。z-s1除未分类物种,其余菌属相对丰度较为均匀,总体不超过2%。样品z-s2第1个相对丰度较高的菌属是黄杆菌属(Flavobacterium),明显高于其余菌属。6个样品微生物组成较为相似,但各个样品菌属相对丰度差异较大。黄杆菌属只在z-s2丰富度较高,黄杆菌属含有致病细菌较多,其普遍存在于养殖水体中,会在健康的动物表皮形成生物膜,抵抗黏膜免疫防御,进而造成感染,导致其烂鳃、体表溃疡等症状[8]。在z-s2水体添加抑制黄杆菌属的微生物制剂可预防鲈鱼疾病,比如柱状黄杆菌的拮抗菌有解淀粉芽孢杆菌及约氏不动杆菌[13]。
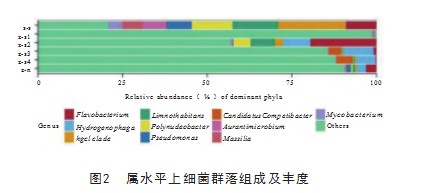
图3结果显示,6个样品中变形菌门丰富度最高,s-s第2优势菌门为放线菌门(Actinobacteriota),第3优势菌门为拟杆菌门(Bacteroidota),其余门以及未分类门(Others)的相对丰度要远低于这3个门。z-s1第2优势菌门为蓝菌门(Cyanobacteria),其它养殖场鲈鱼尾水和淤泥的第2优势菌门为拟杆菌门,z-s3第3优势菌门为蓝菌门。放线菌门对水体有机微污染的降解有重要作用[8]。养殖场样品细菌群落结构较为相似,物种相对丰度略有差异,与实验室样品差距较大,在养殖场尾水蓝菌门相对丰度高于实验室。

2.1.3细菌群落Heatmap图
图4结果显示,hgcI_clade属在s-s丰富度较高,在其它样品的丰富度基本没有差异,都较低。黄杆菌属在z-s2丰富度较高,在z-s1、z-s3、z-s4丰富度较低。氢噬胞菌属在z-s2、z-s3、z-s4的丰富度较高。
研究表明,自然环境下,水体处于低污染浓度,hgcl_ clade属丰富度比较稳定,水的污染浓度高于1%时,hgcl_clade属的丰富度将会下降,hgcl_clade属与污染浓度呈强负相关。污水浓度上升时,氢噬胞菌属(Hydrogenophaga)丰富度增加,而hgcl_clade属的丰富度减少,与Heatmap图相一致,养殖场鲈鱼尾水样品污染程度高于实验室鲈鱼尾水样品[14]。实验室鲈鱼发育情况比养殖场鲈鱼好,可在养殖场尾水添加对水体有机微污染的降解有重要作用的微生物制剂,如添加一些放线菌目(Actinomycetales)的细菌,进而改善水质,有利鲈鱼生长。

2.2尾水中真菌群落多样性
2.2.1 OTU分布花瓣图
图5结果显示,取自养殖场的鲈鱼尾水样品z-s1、z-s2、z-s3、z-s4各含有的真菌OTU总数分别为153、28、45、31。z-n含有的真菌OTU总数126。s-s含有的真菌OTU总数51。
2.2.2真菌群落结构组分图
图6结果显示,6个样品的其他物种(Others)相对丰度所占比例较大,均达到95%以上。s-s优势真菌属为不整孢菌属,z-s1和z-s3优势真菌属为中国鳞伞属[15],z-n优势真菌属为镰刀菌属,z-s4优势真菌属为Aphelidium属,z-s2优势真菌属为虫草属。6个样品相对丰富度高真菌属有链格孢属(Alternaria)、短梗霉属(Aureobasidium)、枝孢菌属(Cladosporium)等[16]。
2.2.3真菌Heatmap图

图7结果显示,z-s2优势真菌门为担子菌门(Basidiomycota),其余5个样品的优势真菌门为子囊菌门(Ascomycota)。样品s-s子囊菌门相对丰度接近95%。子囊菌门在样品z-s2中相对丰度排名第二,此样品壶菌门(Chytridiomycota)相对丰度比其它样品高。图7结果显示养殖场样品z-s1、z-s2、z-s3、z-s4、z-n的其他物种(Others)的相对丰度所占比例较大,均达到75%以上。

图8结果显示s-s中不整孢菌属丰富度较高,其它样品丰富度基本没有差异,都比较低。Aphelidium属在z-s4中丰富度远高于其它样品。短梗霉属和Crocothemis属在z-s1中丰富度高于除Pholiota属以外的其它样品,其它样品丰富度基本没有差异。中国鳞伞属在z-s1、z-s2、z-s3丰富度由高到低。镰刀菌属在z-n和z-s1中丰富度相对于其它样品高。6个样品的菌属相似,在丰富度上有所差异。
3结论与讨论
鲈鱼尾水多样性分析发现s-s、z-n、z-s2优势细菌属分别是hgcI_clade属、氢噬胞菌属和黄杆菌属,z-s3、z-s4优势细菌属都是氢噬胞菌属。s-s、z-n、z-s4、z-s3优势真菌属分别是不整孢菌属、镰刀菌属、Aphelidium属、虫草属,z-s1、z-s2优势真菌属为中国鳞伞属。养殖场尾水群落结构的多样性和丰富度不管是在真菌还是细菌中都是最高的。由此推测外部环境对微生物多样性具有很大影响[17]。越来越多的数据将微生物多样性推向可以解决基础生态问题的源头,如hgcI_clade属常用于微生物群落转变以及营养状态改变研究中的分析菌属,通过对hgcI_clade属的细菌群落热图分析养殖场鲈鱼尾水样品的污染程度变化。真菌的微生物多样性明显低于细菌微生物多样性。真菌的研究经常容易被忽略,真菌参与物质循环和能量流动,并在其中发挥着重要作用有明确的研究表明生态的稳定发展离不开真菌。
参考文献
[1]胡睿同,陈昊楠,张家豪,等.壳寡糖对水产动物生理活性影响的研究进展[J].饲料研究,2023,46(6):123-127.
[2]洪磊,张秀梅.环境胁迫对许氏平鮋和花鲈血糖、血沉降的影响[J].中国水产科学,2005(4):414-418.
[3]常青,梁萌青,王家林,等.壳聚糖对花鲈生长和非特异性免疫力的影响[J].海洋水产研究,2006(5):17-22.
[4]张雅芝,郑金宝,谢仰杰,等.花鲈仔、稚、幼鱼摄食习性与生长的研究[J].海洋学报(中文版),1999(5):110-119.
[5]薛恒平,薛彦青.水产养殖同微生态与微生物生态之间关系初探[J].饲料工业,1997(2):25-28.
[6]张利兰.自然湿地水体中微生物多样性的研究[D].新乡:河南师范大学,2011.
[7]范立民.吉富罗非鱼养殖池塘微生物群落研究[D].南京:南京农业大学,2015.
[8]张弘杰,徐慧敏,过梓栩,等.水产养殖不同物种对水体和沉积物中细菌群落的影响[J].生态学报,2022,42(8):3 254-3 266.
[9]费鹏,白洪健,程述震,等.PCR—DGGE法分析婴儿肠道菌群多样性[J].食品与机械,2013,29(2):60-63.
[10]Neilson J W,Jordan F L,Maier R M,et al.Analysis of artifacts suggests DGGE should not be used for quantitative diversity analysis[J].Journal of Microbiological Methods,2013,92(3):256-263.
[11]王新珍,王凤花,孙瑞波,等.高通量测序技术在微生物分子生态学研究中的应用[J].中国生态农业学报,2018,26(10):1 593-1 600.
[12]Eckburg P B,Bik E M,Bernstein C N,et al.Diversity of the Human Intestinal Microbial Flora[J].Science,2005,308(5 728):1 635-1 638.
[13]李晓超.柱状黄杆菌的拮抗菌筛选及其对鲫鱼生长性能和免疫功能的影响[D].长沙:湖南师范大学,2019.
[14]Ruprecht J E,Birrer S C,Dafforn K A,et al.Wastewater effluents cause microbial community shifts and change trophic status[J].Water Res,2021,200:117 206.
[15]田恩静.中国鳞伞属[Pholiota(Fr.)Kummer]真菌分类学研究[D].长春:吉林农业大学,2005.
[16]高芬,吴元华.链格孢属(Alternaria)真菌病害的生物防治研究进展[J].植物保护,2008(3):1-6.
[17]Bell T,Newman J A,Silverman B W,et al.The contribution of species richness and composition to bacterial services[J].Nature,2005,436:1 157-1 160.










