脂肪酶固定化常用载体及方法的研究进展论文
2024-05-18 14:23:12 来源: 作者:xuling
摘要:脂肪酶被广泛应用于生物传感器、精细化工和生物催化等诸多领域,在此情形下脂肪酶固定化是提高其重复利用率和催化效率的重要手段。文章按照微生物属、海洋属、动植物属的分类,分别介绍了脂肪酶的不同来源,重点总结了金属有机框架、介孔氧化硅和凝胶等常用的新型酶固定化载体,并讨论了吸附法、共价交联法、包埋法、复合法等脂肪酶固定化常用方法的优缺点,以期为后续研究提供理论依据和参考。
摘要:脂肪酶被广泛应用于生物传感器、精细化工和生物催化等诸多领域,在此情形下脂肪酶固定化是提高其重复利用率和催化效率的重要手段。文章按照微生物属、海洋属、动植物属的分类,分别介绍了脂肪酶的不同来源,重点总结了金属有机框架、介孔氧化硅和凝胶等常用的新型酶固定化载体,并讨论了吸附法、共价交联法、包埋法、复合法等脂肪酶固定化常用方法的优缺点,以期为后续研究提供理论依据和参考。
关键词:脂肪酶,固定化,金属有机框架
1前言
随着生物技术的高速发展,酶作为生物催化剂的应用逐渐变得越来越广泛[1]。酶的种类繁多,目前研究较多的酶有过氧化氢酶、脂肪酶和葡萄糖氧化酶等。其中,脂肪酶具有多功能性、高选择性和立体特异性等特性,极易催化多种反应并获得高产率的优质产品,如洗涤剂、面团和奶酪调味剂等,故而被广泛应用于造纸及油脂生产等领域[2]。图1汇总了近十年来发表的脂肪酶和脂肪酶固定化相关研究的论文数(来源于web of science),由此可见,对脂肪酶及其衍生物的探索一直备受关注。目前的研究难点主要集中在游离脂肪酶生产成本高且稳定性低,在恶劣环境下容易失去活性,且难以回收和再利用,不符合绿色环保原则[3]等方面,因此,提高脂肪酶的储存性能和重复使用性能显得尤为重要。
通过分子酶工程、化学修饰、介质工程、固定化等方法对脂肪酶进行修饰或为其外加保护罩能够很好地实现对其的储存和重复利用。其中,固定化方法应用较为广泛且更易于实现。固定化后,酶活动将会受到完全或局部约束,使酶在催化反应过程中与反应物分开,有利于控制生产过程。酶固定化可以通过多种途径实现[4],如设计不同结构、不同合成条件(温度和pH等)来构建不同性能的新型载体[5],从而提高固定化酶的性能。本文通过综述脂肪酶的来源、常用的固定化载体,以及各种固定化方法的特点来呈现脂肪酶的固定化过程,以期为后续研究提供理论依据和实践参考。

2脂肪酶
脂肪酶,又名甘油酯水解酶,是一种羧基酯水解酶,其结构一般包括疏水区和亲水区,活性中心大多酶,其结构一般包括疏水区和亲水区,活性中心大多为丝氨酸残基,通常由被称为“盖子”的可移动区域 覆盖。当脂肪酶吸附在疏水载体上时,载体上的疏水微环境会使“盖子”完全暴露,从而提高酶活性。脂肪酶有 16 个超家族和 39 个同源家族,且均广泛存在于动植物组织及微生物菌体组织中。脂肪酶是 工业行业应用最广泛的酶,常被用于催化羧酸酯的水解、醇解、酯化和酯交换反应等过程。在非水介质中,脂肪酶具有优异的催化活性和稳定性,可促进生物柴油生产过程中的酯化和酯交换反应过程。而且 脂肪酶在水性环境中也具有催化其他化学反应的潜力,具有巨大的工业价值。
脂肪酶可从微生物、海洋生物、动物或植物中获取。实验中脂肪酶的获取方法可粗略分为三种,第 一,直接购买商业脂肪酶;第二,通过菌中发酵获得;第三,构建所需脂肪酶基因的完整编码序列导入感 受态细胞(如大肠杆菌)中进行表达并发酵生产。第 一种方法虽然很方便,且得到的脂肪酶纯度较高,但价格不菲;而最后一种方法较为经济,但比较耗费人力物力。因此,不少研究者通常会直接选用第二种 方法提取脂肪酶。
2.1 微生物属
微生物包括细菌和真菌,常见的产脂肪酶的微 生物有念珠菌、酵母菌、杆菌、毛霉和黑曲霉等。其 中,针对南极假丝酵母、皱褶假丝酵母、米曲霉、黑曲 霉、爪哇毛霉菌和洋葱假单孢菌等脂肪酶的相关研 究范围较为广泛。与动植物属的脂肪酶相比,源自微生物的脂肪酶更受青睐,因为这类微生物具有高 多样性和特异性,且稳定性较强,易于培养[6],容易 进行基因改造。
假丝酵母又名念珠菌(Candida rugosa,CRL)[7]。产假丝酵母脂肪酶的种类有南极假丝酵母、褶皱假 丝酵母和柱状假丝酵母等。其中,南极假丝酵母脂肪酶是一种丝氨酸水解酶,也是最常用的假丝酵母 脂肪酶。其游离形式和固定形式都对仲醇的动力学拆分表现出了非常优秀的活性和稳定性[8-9] 。1994 年,南极假丝酵母脂肪酶被确定为三维结构[10],且其 氨基酸序列由 317 个氨基酸组成;同时,研究表明,南极假丝酵母脂肪酶属于α/β 水解酶折叠家族,其 活性位点包含由 Ser105、His224 和 Asp187 形成的 催化三联体。该发现为后续研究提供了坚实的理论依据。2012 年,有研究者通过修改基因序列,将念珠菌属脂肪酶的五肽改成与褶皱脂肪酶相似的序列, 并证明这一改造可以改善天然脂肪酶的一些特性[11]。Tan 等[12]选择对南极假丝酵母脂肪酶 B(Candida antarctica lipase B,CalB)分子表面的 8 个氨基酸位 点进行饱和诱变。其中,高甲醇耐受性变体 CalB- P218W(氨基酸位点为 pro218)和 CalB-V306N(氨基酸位点为 Val306)在包含 15%(V/V)甲醇的乳化 三丁酸甘油酯固体板上能够产生更大的光环,其活性比野生型 CalB-WT(wild-type,WT)分别高 19%和 31%。由此可见,对脂肪酶进行基因修饰,不仅可 以改变脂肪酶的特征,还有助于提高其活性。南极假丝酵母脂肪酶常被用于生物柴油的制备,即将油脂(甘油三酯)水解为游离脂肪酸和甘油。南极假丝酵母在室温下也具有较强的催化活性,甚至在潮湿环 境中仍具备高度催化活性和选择性。除了底物以外,南极假丝酵母脂肪酶不易与其他化学品发生反应,因而被广泛用于多种化学过程中,例如,环酯和脂肪族聚酯的合成与降解、油脂加工、对映异构体的拆分,以及具有生物活性的酯的合成。然而,南极假丝 酵母脂肪酶作为生物催化剂也存在一定的局限性, 例如,分离难度较大、不稳定、只能在特定溶剂中发 挥作用,以及重复使用次数少等。对此,可以通过固 定化技术来克服这些问题。
黑曲霉可生产酸性脂肪酶,且作为外源蛋白表达宿主,具有优异的蛋白分泌能力及遗传稳定性。黑曲霉脂肪酶多为胞外酶,可利用液体培养基或固体培养基进行发酵。例如,可使用低成本的农产边角料(如稻壳、棉籽和红豆壳等)作为底物混合物,利用黑曲霉 MTCC 872(Microbial Type Culture Collection,MTCC)固态发酵制备脂肪酶[13],如图 2 所示。其中,棉籽饼和红豆壳是关键营养成分,而稻壳为真菌生长提供了足够的表面积。研究发现,底物比、温度、水分含量和 pH 的最佳制备条件分别为 2 ∶ 1 ∶ 1、40 ℃、75%和 6[6]。Chen 等[14]尝试将黑曲霉接种到培养 基中,并在 30 ℃和 180 r/min 的摇床上孵育 48 h,最终得到的脂肪酶表现出了良好的特性,并且在优化 提取条件后,脂肪酶的提取率高达 85%。黑曲霉脂肪酶不仅生产成本低,还为生产多样化的脂肪酶提供了无限可能。Cong等[15]从黑曲霉中鉴定出了一种新型脂肪酶,该酶在大豆溶剂系统中能够合成特殊风味酯,对冷、酸和碱性条件均具有耐受性。同时,该酶在大豆油溶剂体系中对乳酸乙酯、丁酸丁酯和辛酸乙酯的合成表现出了显著的催化活性。这些优异特性促使其成为奶酪、酒精饮料及其他发酵食品加工的优质催化剂。

2.2海洋属
海洋微生物数量庞大,种类众多,主要生产蛋白酶[16]、核酸酶[17]、脂肪酶和多糖水解酶等。与陆地微生物相比,海洋微生物独特的遗传结构为脂质降解提供了优良条件。高盐、高压、低温和特殊光照条件下的海洋环境使海洋微生物产生的酶与来自陆地微生物的同源酶存在显著差异。近年来,对新特性酶的研究和市场需求不断增加,海洋微生物酶技术也随之兴起。然而,关于海洋微生物酶生产、表征和应用等方面的研究仍然较少[18]。
2007年,Zhang等[19]通过PCR获得了编码完整的脂肪酶基因序列,对短小芽孢杆菌B106海洋脂肪酶进行了基因克隆及生物信息学分析,并将其在基础培养基中培养并在大肠杆菌中发酵,得到的海洋脂肪酶在高盐浓度下表现出了较高的稳定性,在30~60℃之间具有高活性。Kiran等[20]利用来自海绵的内共生假单胞菌属MSI057生产得到了嗜冷碱性脂肪酶,并发现其对高盐度、pH和温度具有耐受性。Ramani等[18]从海滩沉积物中分离出了能够产生脂肪酶的微生物,用无菌海水对其进行连续稀释,再用人工海水琼脂进行分离,接着通过脂解活性进行筛选。在最佳条件下,海洋菌株每毫升发酵培养基能够产生1 980 U活性的脂肪酶,远高于其他微生物产生的脂肪酶量。因此,海洋生物源性脂肪酶对油脂水解的工业应用及相关海洋生物技术领域的探究展现出了巨大的应用潜力。
2.3动物、植物属
目前,对源于动物、植物的脂肪酶的研究较少。对动物属而言,脂肪酶主要存在于动物的特定细胞或肠道中,猪体内便是如此;对植物属则主要存在于种子中,其次是谷物、果实和叶子。植物脂肪酶因具有特异性、生产和纯化成本低,以及易于获得等优点而备受关注。在含油种子中,如蓖麻、花生、向日葵、黄瓜、棉花、玉米和番茄等,其贮藏组织仅含有碱性脂肪酶,且酶活性在发芽期间才会急剧增加。但在蓖麻中,休眠种子中也拥有活性脂肪酶,且其所具有的酸性和碱性脂肪酶在其他油料种子中并不常见。早在20世纪70年代,Huang等[21]就揭示了静止种子中存在酸性脂肪酶,且其活性会随辐射剂量的增加而降低,也就是玉米粒的辐照降低了脂肪酶的活性。当蓖麻种子进入成熟阶段后,脂肪酶活性会快速增强,蓖麻是唯一具有脂肪酶活性细胞生物学特性的种子。Suo等[22]则选择花生子叶的碱性脂肪酶展开进一步研究,但研究发现,脂肪酶活性并不存在于花生子叶中,而是存在于其颗粒中;同时,花生脂肪酶在碱性pH下具有最高活性,并主要存在于乙醛糖体中,还有少量存在于线粒体和膜组分中。该酶在底物特异性方面与蓖麻乙二醛酶相似。由于花生乙醛糖体脂肪酶不能水解甘油二酯和甘油三酯,因此甘油三酯的分解取决于细胞中其他部位的脂肪酶活性。
猪胰脂肪酶是最有前途、最具成本效益且用途最为广泛的酶之一,可催化各种生物转化反应[23],如水解、酯化和酯交换等。人或猪胰腺中的脂肪酶[24]在胃肠道中被称为“界面激活”性脂肪酶。与体内情况相比,猪胰脂肪酶和其他脂肪酶在体外通常会表现出低活性。一般研究猪胰腺脂肪酶会通过购买获得,也有研究者用拟南芥毛状根来生产人胃脂肪酶,或用富含脂肪酶的植物根部喂养动物使其分泌酸性胃液以释放活性脂肪酶[25]。
综上,微生物易于培养且容易进行基因改造,适合用于培养高稳定性、多样性和特异性的脂肪酶。海洋脂肪酶数量庞大,种类众多,对高盐、高温和高pH具有强耐受性,在新型脂肪酶培养方面显现出了巨大的潜力。对植物属脂肪酶而言,尽管其原料成本低,但局限性在于其贮藏组织仅含有碱性脂肪酶活性,且该活性在发芽期间会急剧增加。
3常见的固定化材料
3.1金属有机框架
金属有机框架(Metal Organic Framework,MOFs)又被称为多孔配位聚合物,由金属离子和有机配体组成[26],具有规则且可调节的孔隙结构与丰富的吸附位点。通过设计不同的有机配体和金属节点可以制备不同性能的MOFs,从而提高固定化酶的稳定性和催化性能。以MOFs为载体固定酶的方法包括两种,分别为一锅法和逐层封装法。前者将MOFs载体与酶放在同一环境下直接混合而成;后者则先合成MOFs,再将其用于固定酶。另外,也可将其固定化手段总结为三种方法,一是在MOFs外表面接枝活性物质;二是将酶通过孔隙扩散到预先形成的MOFs载体中;三是MOFs围绕活性物质组装的瓶中船方法,也被称为原位封装。目前,MOFs固定脂肪酶主要通过表面固定化,因为脂肪酶几乎无法进入大多数微孔MOFs中。以MOFs为载体固定酶及其固定化方法具体如表1所示。此外,脂肪酶和金属离子的相互作用会导致脂肪酶的构象发生变化(如酶活性位点的暴露),可能会降低其活化能。然而,相关研究发现,氨基酸及其衍生物对脂肪酶的催化活性有积极影响[27]。

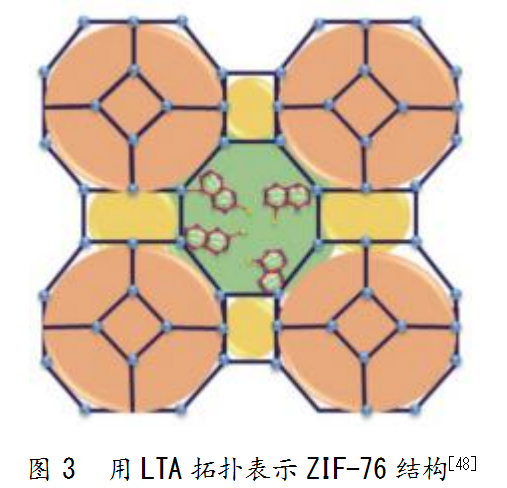
常见的MOFs类型有ZIF、UiO、MIL等。其中,沸石咪唑酯骨架(Zeolitic imidazolate framework,ZIF)[42]是一类与沸石拓扑同构的新型微孔材料,由四面体配位的过渡金属离子(Fe、Co、Cu、Zn)等组成,通过咪唑酯接头连接,其具体固定化方法如表1所示。常用的酶固定化载体有ZIF-67、ZIF-90、ZIF-7、MIL-53、MOF-177等。ZIF-67是最常用的沸石咪唑骨架形式之一,由钴阳离子(Co2+)和有机配体(二甲基咪唑)组成[43],其结构用LTA拓扑结构(Linde Type A,LTA)表示(见图3)。2012年,Taghizadeh等[32]在室温水溶液中合成了纳米级ZIF-67晶体,并发现其在高达350℃的温度下仍能保持高度稳定。ZIF-67晶体的可调节性极强,粒径从228 nm可调整到5μm。同时,在酶固定化中,ZIF-67固定化酶的耐酸碱性和热稳定性显著提高,且可重复使用。除此之外,ZIF-8、ZIF-7、ZIF-90、ZIF-22也是较为常用的载体。其中,ZIF-8由金属锌离子和2-甲基咪唑组成,在乙醇或水溶液中即可制得[42],具有超强的吸附能力和化学耐受性[44],被广泛应用于酶固定化,如葡萄糖氧化酶、过氧化物酶、葡糖淀粉酶和脂肪酶等。ZIF-7是通过桥接苯并咪唑阴离子和锌阳离子形成的孔径约为0.3 nm的方钠石(Sodalite,SOD)拓扑结构[45],具有很高的热稳定性和水热稳定性[46]。可见,大多数用于酶固定化的ZIF都由金属离子锌和咪唑酯连接而成。但也存在其他情况,如沸石咪唑盐ZIF-22通过共价连接剂三氨基丙基三乙氧基硅烷而沉积在多孔陶瓷载体上,从而表现出高氢选择性和热稳定性[47]。
MIL(Materials of Institut Lavoisier,MIL)型MOFs也是金属有机框架的常见类型。MIL类结构形态多样,常见的四种不同金属离子构建的结构如图4所示。其中,MIL-101(Cr)是由对苯二甲酸和三聚铬八面体簇形成的混合超四面体,是一种用于水净化的高容量吸附剂,表面积较大;同时,其出色的多孔结构也引起了诸多关注[49]。MIL-53(Fe)是一种铁基MOFs,表现出了极强的光催化还原Cr(VI)的能力[50],并具有无限FeO4(OH)2团簇、优异的可见光响应能力、无毒、稳定性强和成本低等优点。

UiO(University of Oslo)型MOFs材料由奥斯陆大学率先合成。对UiO类金属有机框架的相关研究多为将其杂化再应用。其中,UiO-66因具有对脂肪酶的强亲和力和多孔聚偏二氟乙烯的大空腔而表现出优异的固定化性能,且其所得固定化脂肪酶的热稳定性相对较高。Taghizadeh等[27]将脯氨酸成功接枝在UiO-66表面,形成了良好的表面形貌。该杂化UiO-66固定的假丝酵母脂肪酶可应用于酯交换,表现出了更高的催化活性、稳定性和可回收性。2016年,Gascón等[29]开发了可用于固定脂肪酶的磁性MOFs载体,并利用磁性Fe3O4纳米粒子通过原位水热法合成磁性MOFs,在MOFs表面表现出了大量胺基团和饱和磁化强度。同年,Yu等[52]制备了具有大中孔孔径的Cu-BTC分级多孔MOFs材料,并用其成功固定了枯草芽孢杆菌脂肪酶。
3.2介孔氧化硅材料
介孔氧化硅材料具有高度有序的2D六边形结构、孔径分布较宽、介孔形状多样、孔道结构有序、孔径分布单一且可调控,并且机械化学性能良好。其常被当作无机载体材料使用,可提供惰性环境,且大多具有透光性。特别是通过溶胶—凝胶反应产生的多孔氧化硅,具有良好的热弹性、耐高压性和对腐蚀性介质的高耐受性,可用作药物输送载体、纺织品防水涂层和酶载体。
氧化硅孔径的可调整性使其能够固定各种生物分子。功能化后的二氧化硅可以调整其表面性质(亲水性/疏水性)[53],具有较强的机械稳定性、大表面积、极低的毒性,以及对微生物攻击和有机溶剂的高耐受性等。此外,Bibi等[42]利用仿生硅化法生产的氧化硅材料具有优异的力学性能、层次结构、多种形貌和环境等。Wong等[54]证明了涂有由无定形油棕叶灰中提取的氧化硅的磁性纳米粒子固定假丝酵母脂肪酶所构成的Gl-A-SiO2-MNP有助于实现对反应混合物的回收再利用。
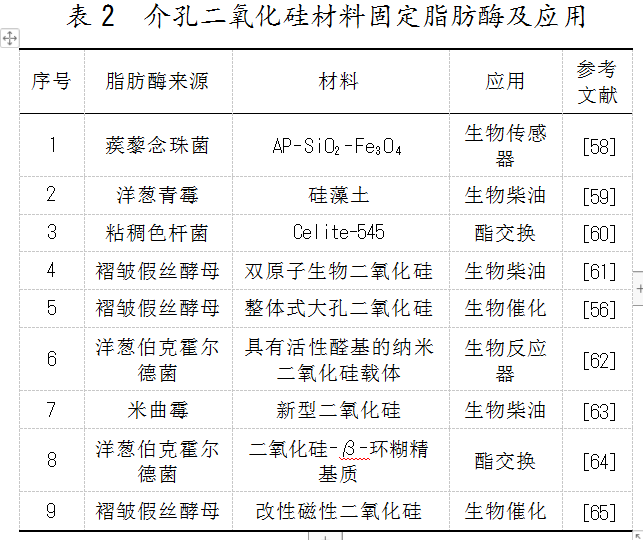
然而,氧化硅在酶固定化中一般需要对其结构进行二次修饰以改善酶浸出现象。如表2所示,介孔氧化硅基本需要通过添加沸石、聚乙烯醇、壳聚糖[55]、纤维素、聚合物等材料进行修饰后,再应用于脂肪酶固定化。Onoja等[53]将沸石嵌入氧化硅中,再用于酶封装,使固定化后的混合蛋白酶耐高温性更强,且在60℃、pH为9的条件下加热90 min后仍能保留较高的酶活性,且连续循环使用8次后仍能保持58%的残余活性。沸石/SiO2材料易于合成、比表面积大、结构惰性,且成本低。其惰性和高密度性,使其在生物催化反应结束后易于分离回收,可由此提高其经济价值。Lu等[56]以柱状环氧树脂大孔聚合物为模板制备了大孔氧化硅(Mesoporous Silica,MMS),通过研究发现,MMS具有两组界限分明、均匀连续的大孔通道,机械强度大,孔容和比表面积大。此外,聚多巴胺(Polydopamine,PDA)可以对MMS进行表面修饰,厚度约为50 nm,并且基于其表面化学性质和独特的大孔结构,PDA/MMS复合材料为提高固定化酶的催化活性提供了一种简单、经济有效的方法。Aghababaie等[57]通过复合聚丙烯腈和由SiO2包覆的Fe3O4纳米粒子制备了具有纳米级多孔结构的磁性空心复合珠,保留了纳米级通道,比空心珠具有更大的比表面积(27 m2/g)、更大的孔体积(0.09 cm3/g)和更好的饱和磁化强度值(9.8 emu/g)。Martin等[58]将Fe3O4 SiO2纳米颗粒涂到超滤膜表面,然后与3-氨基丙基乙氧基硅烷(3-aminopropyltriethoxysilane,PTS)发生反应,用于固定化酶,取得了较高的酶活性和固定化效率。与未改性的膜相比,活化纳米复合膜大大提高了其负载能力和酶的相对活性。
3.3凝胶
凝胶可分为水凝胶、干凝胶和气凝胶。其中,水凝胶是由大量水溶胀聚合物形成的三维网络结构,可由天然、合成生产或两种来源结合生产[66],还可以将水溶性聚合物或单体作为凝胶溶液,通过物理或化学交联聚合。在标准方法中,聚合反应由外部刺激引发,例如热、化学活化或辐射等。水凝胶性质独特,具有特定功能性、可逆性和生物相容性,能满足材料学和生物学要求[67]。凝胶的生成一般利用交联法或溶胶—凝胶法制备。Jo等[68]研究了一种果胶水凝胶膜,将CaCl2交联剂插入果胶溶液中,使Ca2+离子诱导果胶发生交联,得到无色、表面光滑、均匀的水凝胶膜,相较于纯果胶,其具有更多无定形结构,对于提高吸光度值具有非常重要的影响。Chen等[69]通过溶胶—凝胶转变制备了纤维素基磁性水凝胶微珠,并通过将纤维素、壳聚糖、角叉菜胶、木质素或淀粉混合改变微珠的表面特性。研究发现,在纤维素与卡拉胶混合后,纤维素微珠对结晶紫的吸附能力提高了1倍多;而纤维素与壳聚糖混合后,对甲基橙的吸附能力提高了2倍。气凝胶(aerogel)是指将水凝胶的内部液体介质转变为以空气为填充介质的纳米多孔材料。Park等[70]制备的甲壳素/氧化石墨烯(Chitosan/Graphene Oxide,Ch/GO)复合气凝胶珠呈现出了三维多孔结构。其氧化石墨烯与几丁质的结合体也具有高表面积和高机械强度。此外,干凝胶的应用也较为广泛。Pierre等[71]采用溶胶—凝胶法制备了二氧化钛干凝胶,并通过干凝胶分解形成了无定形的锐钛矿(Titanium Dioxide,TiO2)。除了二氧化钛之外,介孔二氧化硅材料也常被用于干凝胶的制作,通过加入壳聚糖、磁性氧化铁等进行修饰,形成具有不同功能的介孔材料。其二氧化硅气凝胶呈现出了随机的三维分子四面体网络[72]。Pai等[73]制备了由壳聚糖修饰的SiO2/TiO2磁性干凝胶。该材料具有介孔结构,易于磁回收,不仅可重复使用,还能保持抗菌活性。Milašinovi等[74]使用溶胶—凝胶法将Fe2O3纳米颗粒固定在SiO2干凝胶珠上。与块状Fe2O3相比,Fe2O3颗粒与二氧化硅载体结合具有良好的相互作用,能使Fe2O3纳米颗粒均匀分布在整个SiO2表面和介孔结构内。该催化剂在800℃下连续使用12 h仍能表现出良好的稳定性。
水凝胶能够为酶提供温和的条件以保护其免受恶劣环境影响[75]。与天然脂肪酶相比,固定在水凝胶中的脂肪酶显示出了高热稳定性、溶剂稳定性、储存稳定性和操作稳定性[76]。生物聚合物如壳聚糖、藻酸盐、琼脂糖和角叉菜胶等的水凝胶已被用作酶固定化的载体材料[77]。纤维素水凝胶珠在染料、金属离子吸附、药物递送和色谱等领域拥有巨大的潜在应用价值。其中,壳聚糖是制备水凝胶最常用的原料之一,是一种线性多糖,由D-氨基葡萄糖和N-乙酰基-D-氨基葡萄糖组成,是一种具有羟基和反应性氨基的低成本生物聚合物,已被用作各种酶(包括脂肪酶)固定过程中的载体[78]。此外,壳聚糖还能与其他生物聚合物结合。壳聚糖的氨基质子化基团(-NH3+)能与一些天然聚合物的阴离子基团通过离子的相互作用形成杂化水凝胶,如藻酸盐(羧酸根)和角叉菜胶(磺酸基)等,从而改善载体的机械性能。
在固定化及载体制备过程中,还可通过添加具有不同特性的材料来改善凝胶的性质。Park等[77]通过添加Fe3O4制备了磁性纤维素微球。固定在磁性纤维素微球上的脂肪酶可通过磁铁简单回收并重复使用。Pierre等[71]制备了纤维素/木质素复合水凝胶珠粒固定假丝酵母脂肪酶。固定化脂肪酶的催化活性和稳定性会随着纤维素/木质素珠中木质素含量的增加而增强。同时,纤维素/木质素水凝胶具有良好的生物相容性、生物可降解性和可控性,可在生物催化、生物医学和生物电子领域发挥更多的潜在作用。
3.4其他
有机杂化纳米材料作为酶固定化的新型纳米载体受到了广泛关注。2019年,Virto等[79]首次把纳米纤维作为酶固定化载体,采用静电纺丝技术优化合成了纳米纤维。纳米纤维具有非常强的酶固定化潜力,且具有许多功能和结构性优势,例如拥有合适的官能团、高孔隙率、结构中不同成分的可用性、生物相容性、生物可降解性、亲水性以及无毒性等。这些特性能够提供高酶载量。将酶置于纳米纤维的孔隙中,有助于保护酶的三维结构,还可增强酶对极端条件的抵抗力。此外,纳米复合材料,如磁性纳米粒子、介孔结构、纳米棒、纳米粒子、聚合物膜、有机/无机杂化物、聚合物/金属复合材料、静电纺纳米纤维等,显示出了原始的物理和化学性质,比表面积较大。早在1994年,Zahirinejad等[80]就将Cu3(PO4)2·3H2O矿物材料固定在溴化十六烷基三甲胺激活的米曲霉脂肪酶中,表现出了良好的热稳定性、储存稳定性和可重复使用性,并发现其具有生产高附加值脂肪酸的潜力。Datta等[81]将酶固定在有机载体纳米材料上,显著提高了其热稳定性和储存稳定性,也起到了防止金属离子干扰的作用。与宏观载体相比,有机纳米材料,尤其是有机—无机杂化物,具有较强的生物相容性,可显著改善固定化酶的动力学和热力学参数。
综上所述,介孔固定化材料仍是目前研究酶固定化的热门载体材料。与介孔二氧化硅的2D结构相比,金属有机框架的立体结构更胜一筹。金属有机框架具有多用途的结构,且具有可定制、可调节的孔隙结构和丰富的吸附位点。虽然目前用金属有机框固定脂肪酶的研究已经比较多,但仍可通过掺入其他材料(如多糖、聚合物和无机材料等)来创造新的骨架结构及性能或者将2D材料改造为立体结构,以达到更好的酶固定化效果。
4常用的脂肪酶固定化方法
4.1吸附法
吸附法通过离子相互作用、范德华力或偶极相互作用,将酶附着在不溶性载体的外表面上。固定化载体材料有无机化合物、合成聚合物和生物聚合物。当酶固定在外部载体上时,其扩散限制会明显减弱。吸附是常用的固定化技术,尽管其过程易于处理,但仍会受到制备条件的限制[82]。
通过物理吸附将假丝酵母脂肪酶有效固定在纤维素微球上,其脂肪酶的相对活性、热稳定性和pH稳定性均高于游离脂肪酶[77]。Soni等[83]通过吸附将洋葱伯克霍尔德菌脂肪酶固定在聚苯胺纳米纤维上,发现该固定化酶的活性是游离脂肪酶的6倍。Qin等[84]通过物理吸附将荧光假单胞菌脂肪酶固定在聚苯胺纳米纤维上,发现固定酶的活性是游离酶的8倍,且易于分离、可重复使用6次以上、可耐75℃以上的高温。Naseri等[85]将多孔聚丙烯酰胺水凝胶微球通过氢键作用吸附脂肪酶,其合成过程如图5所示。该作用下所得的脂肪酶多孔聚丙烯酰胺水凝胶微球(Large-Pore Polyacrylamide Hydrogel Microspheres,L-PHMs)与游离脂肪酶相比,具有更高的耐受温度和酸碱稳定性。重复使用20次后,L-PHMs仍可保持其原始活性的49%。Pinto等[86]通过物理吸附将洋葱假单胞菌脂肪酶固定在ZIF-8中,发现固定化酶在水解和酯交换反应系统中均能表现出良好的可重复使用性。

不同吸附方法对不同载体材料的作用效果有所不同。Nezhad等[87]将洋葱伯克霍尔德菌脂肪酶通过共价键和物理吸附固定在SBA-15介孔载体(Santa Barbara Amorphous,SBA)上,结果表明,约25%的脂肪酶能通过共价键固定在SBA-15中,15%的脂肪酶通过物理吸附结合,且后者制备的生物催化剂表现出了更好的催化活性。Qin等[84]通过吸附和共价键作用两种方法将经过表面活性剂处理的洋葱伯克霍尔德菌脂肪酶固定在碳纳米纤维表面。结果表明,通过吸附作用将脂肪酶固定在碳纳米纤维上的效果欠佳,固化效率仅为36%,而使用1-乙基-3-碳二亚胺/N-羟基琥珀酰亚胺的共价偶联表现出了更高的固定化效率,可达到56%。
4.2共价交联法
共价交联法基于载体的化学基团与酶的亲核基团形成共价键,使载体上的氨基、亚氨基、羟基、硫醇、胍基和咪唑基团与酶共价连接。主要载体有纤维素、琼脂糖、胶原蛋白、无机载体(如玻璃、二氧化硅、金、银的金属纳米颗粒等)。常用交联剂为戊二醛,其可使酶与载体的结合更加牢固,且酶不易脱落。尽管共价键具有不可逆性和高稳定性等优点,但共价交联法制备过程复杂,条件苛刻,容易导致酶失活,且其结合过程很大程度上会受到酶构象变化的限制。
共价交联法的常用载体主要有金属纳米材料、介孔氧化硅等,且不同载体材料会对共价交联固定化酶产生不同效果。例如,添加离子液体等修饰酶,可起到保护酶周围水合层的作用,或在混合载体制备过程中引起构象变化[88]。Martin等[58]将蒺藜念珠菌脂肪酶共价固定在Fe3O4 SiO2纳米复合膜上以增强底物的亲和力。Qian等[31]将脂肪酶共价固定在磁性金属有机框架MIL-100(Fe)中,固定化效率可达83%,相对活性为64%。将该固定化酶催化酯交换反应用于制备生物柴油,产率高达92%。Iik等[88]将洋葱伯克霍尔德菌脂肪酶共价结合固定在聚羟基丁酸-共-羟基戊酸和二氧化硅的新型混合载体中,发现该过程可以减少α-螺旋含量对脂肪酶活化界面的影响。Rajan等[89]将脂肪酶共价固定在异功能载体甲苯磺酰氯胺酸上,并将其应用于废弃煎炸油以生产生物柴油,发现其相对产率可达到20.3%,而游离酶的相对产率几乎为零。Wong等[54]将假丝酵母脂肪酶共价固定在油棕叶灰衍生的改性磁性二氧化硅上,发现该假丝酵母脂肪酶可获得74.6 U/g的活性。Cheng等[65]将假丝酵母脂肪酶通过共价相互作用固定在修饰后的Fe3O4上,发现其相应的酶活性可达到183 U/g。Jiao等[90]将来自洋葱伯克霍尔德菌的脂肪酶与戊二醛交联产生催化活性酶,发现其重复使用性高达10次。Abdulla等[91]将米曲霉ST11脂肪酶与牛血清白蛋白(Bovine Serum Albumin,BSA)结合制备磁性交联酶聚集体,其流程如图6所示。研究发现,最高的固定化脂肪酶活性为0.09 U/mg,恢复活性为82%,除此之外,与游离酶相比,该固定化脂肪酶的酸碱耐受性、热稳定性和储存稳定性均有所提高。

Chen等[36]通过表面吸附法和交联法两种方法分别制备了MOFs-脂肪酶,并对二者进行了比较分析。结果显示,通过表面吸附法制备的MOFs-脂肪酶的催化活性低,在催化2-(4-甲基苯基)丙酸水解时的最大产率仅为18%;而通过共价交联法制备的MOFs-脂肪酶的催化活性显著增强,产率为73%,是前者最大产率的4倍多。由此可知,共价键为脂肪酶固定在MOFs载体上提供了更强的交联作用,有助于使脂肪酶在催化过程中保持最佳构象。
4.3其他
目前可用于脂肪酶固定化的方法除了吸附法和共价交联法外,还有包埋法、复合法等。Park等[70]利用先吸附后交联的方法,通过吸附法和共价交联法将褶皱念珠菌脂肪酶固定在气凝胶珠上。研究发现,与游离脂肪酶相比,该固定化脂肪酶表现出了良好的热稳定性,循环5次后其活性仍可保持在初始活性的90%以上。Al-Mansouri等[92]通过交联固定化洋葱伯克霍尔德菌脂肪酶,再将其固定在藻酸盐和角叉菜胶的混合基质中。研究显示,该固定化脂肪酶可显著减少66%的酶泄漏,甚至表现出了更好的酯交换活性,从小桐树粗油中可获取100%的生物柴油产量。Cai等[93]通过包埋法将脂肪酶固定在ZIF-8中,发现虽然吸附法制备的固定化脂肪酶显示出了更高的活性,但包埋法制备的固定化脂肪酶稳定性更强,循环反应5次后仍可保持83%的活性,而相同条件下由吸附法制备的固定化脂肪酶仅能达到34%。Cai等[94]建立了一种新型的南极假丝酵母脂肪酶固定化方法。先将南极念珠菌脂肪酶B包埋在ZIF-8上,再通过物理吸附与大孔树脂结合得到固定化脂肪酶CALB-ZIF-8 D101。结果显示,其活性为38.4 U/mg,且与游离脂肪酶相比,固定化脂肪酶表现出了更好的热稳定性和有机溶剂耐受性;同时,其在油酸甲酯的合成方面也表现出了优异的可重复使用性,10个循环后,仍可保持84%的初始活性。除此之外,还有一种特殊的没有载体的固定化酶—交联酶聚集体(The cross-linked enzyme aggregates,CLEAs)。CLEAs是一种不需要载体,可直接通过酶分子相互聚集和交联反应固定化的聚集物,从而实现酶固定化技术。由于脂肪酶表面没有很多用于交联的赖氨酸基团,所以Paitaid等[95]采用带有氨基的离子液体(1-氨丙基-3-甲基咪唑溴化物,FIL)作为新型功能表面分子来修饰CRL(Candida rugosa lipase,CRL),从而形成了CRL-FIL-CLEAs酶催化剂。该材料重复使用5次后CRL-FIL-CLEAs的相对活性仍可达到51%,而未经FIL修饰的CRL-CLEAs的相对活性仅为22%。
综上,在选择固定化方法时,需要综合考虑固定化方法的特点、固定化载体的性质,以及固定化条件等因素来确定。在酶固定化过程中,还可针对现存问题,如酶泄漏、酶失活和不可重复使用等缺点加以改进。例如,对于介孔氧化硅固定脂肪酶,其材料性能虽好但存在较为严重的酶泄漏问题,可在其中适当添加一些聚合物来加以改善。同理,单一固定化方法或许不能达到所需效果,可尝试将不同固定化方法结合使用来探究新路径。
5总结与展望
本文针对脂肪酶固定化及其应用,从脂肪酶的来源、常用固定化载体的种类以及常见固定化方法等方面,综述了脂肪酶固定化常用载体及方法的研究进展。主要结论及展望如下。
(1)海洋资源十分丰富且环境复杂,海洋微生物对盐度、pH和温度的耐受性更强,未来可挖掘更多海洋资源来寻找可产生脂肪酶的微生物;
(2)引入金属离子、聚合物、壳聚糖和离子液体等修饰单一载体(如有金属有机框架、介孔氧化硅材料和凝胶等),使载体功能化,同时克服脂肪酶浸出现象,提高脂肪酶活性;
(3)提高载体的物理化学性能,如磁性、硬度、延展性、可塑性、弹性等,以提高固定化酶的重复使用性和催化性能。
参考文献
[1]KATSIMPOURAS C,STEPHANOPOULOS G.Enzymes in biotechnology:Critical platform technologies for bioprocess development[J].Current Opinion in Biotechnology.2021,69:91-102.
[2]RAFIEI S,TANGESTANINEJAD S,HORCAJADA P,et al.Efficient biodiesel production using a lipase ZIF-67 nanobioreactor[J].Chemical Engineering Journal.2018,334:1233-1241.
[3]SILVA AG,GUIDINI CZ.Lipases:sources,immobilization methods,and industrial applications[J].Applied Microbiology and Biotechnology.2019,103:7399-7423.
[4]BÔAS V,DE CASTRO HF.A review of synthesis of esters with aromatic,emulsifying,and lubricant properties by biotransformation using lipases[J].Biotechnology and Bioengineering.2021,119(3):725-742.
[5]SAMAR F,AMNA F,ASIA A,et al.Microbial lipase production:A deep insight into the recent advances of lipase production and purification techniques[J].Biotechnology and Applied Biochemistry,2020,68(3):445-458.
[6]NEMA A,PATNALA H S,MANDARI V,et al.Production and optimization of lipase using Aspergillus niger MTCC 872 by solid-state fermentation[J].Bulletin of the National Research Centre,2019,43(1):1-8.
[7]HADADI M,HABIBI A.Emphasis Type=ItalicCandida rugosa/Emphasis lipase immobilized on functionalized magnetic FeSubscript3/SubscriptOSubscript4/Subscript nanoparticles as a sustainable catalyst for production of natural epoxides[J].Chemical Papers,2019,73(8):1917-1929.
[8]COKUN G,ÇıPLAK Z,YıLDıZ N,et al.Immobilization of Candida antarctica Lipase on Nanomaterials and Investigation of the Enzyme Activity and Enantioselectivity[J].Applied Biochemistry and Biotechnology,2020,193(2): 1-16.
[9]WIDHYAHRINI K,HANDAYANI N,WAHYUNINGRUMD,et al.The synthesis of sulfonated polyethersulfone (SPES)and the preparation of its membranes as matrix in the immobilization of Candida antarctica lipase B(Cal-B [J].Polymer Bulletin,2019,77(7):1-14.
[10]BARTŁOMIEJ Z,AGATA F,EWA B.Screening of solvents for favoring hydrolytic activity of Candida antarctica Lipase B[J].Bioprocess and Biosystems Engineering,2020,43(4):605-613.
[11]MOSTAFA H,ASGHAR A K,BAGHER Y,et al.In silico and experimental characterization of chimeric Bacillus thermocatenulatus lipase with the complete conserved pentapeptide of Candida rugosa lipase[J]. Applied Biochemistry and Biotechnology,2013,169(3): 773-85.
[12]ZHONGBIAO T,XIANGQIAN L,HAO S,et al.Enhancing the methanol tolerance of Candida antarctica lipase B by saturation mutagenesis for biodiesel preparation[J].3 Biotech,2021,12(1):22-22.
[13]曾佳佳,陈静,陈振,等.复合微生物的筛选及其发酵秸秆的应用效果[J].中国酿造,2021,40(03):124-128.
[14]CHEN C,TIAN H,XING S,et al.Influence of different parameters on reverse micelle extraction combined with acetone precipitation to purify sn-1,3 extracellular lipase from Aspergillus niger GZUF36[J].Journal of Food Science and Technology.2019,56:2899-2908.
[15]CONG S,TIAN K,ZHANG X,et al.Synthesis of flavor esters by a novel lipase from Aspergillus niger in a soybean-solvent system[J].3 Biotech.2019,9:1-7.
[16]傅奇,林俊杰,庄峙厦,等.一株海洋来源蛋白酶产生菌Parengyodontium album HX2019006的鉴定及其发酵条件研究[J].食品与发酵工业.2020,46:185-190.
[17]杨梦莹,谢晨杰,李时勇,等.一株海洋来源铜绿假单胞菌Gxun-7角蛋白酶基因的克隆,表达及重组酶酶学性质[J].微生物学通报.2022,49:4629-4643.
[18]RAMANI K,SARANYA P,JAIN SC,et al.Lipase from marine strain using cooked sunflower oil waste:production optimization and application for hydrolysis and thermodynamic studies[J].Bioprocess and Biosystems
Engineering.2013,36:301-315.
[19]ZHANG H,ZHANG F,LI Z.Gene analysis,optimized production and property of marine lipase from Bacillus pumilus B106 associated with South China Sea sponge Halichondria rugosa[J].World Journal of Microbiology and Biotechnology.2009,25:1267-1274.
[20]KIRAN GS,SHANMUGHAPRIYA S,JAYALAKSHMI J,et al.Optimization of extracellular psychrophilic alkaline lipase produced by marine Pseudomonas sp.(MSI057)[J].Bioprocess and Biosystems Engineering.2008,31:483-492.
[21]THANKI R,PATEL K,PATEL R.Variation in lipase activities during germination(in dark)ofγ-irradiated castor-seeds[J].Lipids.1970,5:519-523.
[22]HUANG AH,MOREAU RA.Lipases in the storage tissues of peanut and other oil seeds during germination[J].Planta.1978,141:111-116.
[23]SUO H,XU L,XU C,CHEN H,et al.Enhancement ofcatalytic performance of porcine pancreatic lipaseimmobilized on functional ionic liquid modified Fe3O4-Chitosan nanocomposites[J].International Journalof Biological Macromolecules.2018,119:624-632.
[24]Zaitsev SY,Savina AA,Garnashevich LS,et al.Effect ofsome charged polymers on the activity of pancreatic porcine lipase[J].Bio Nano Science.2019,9:773-777.
[25]GUERINEAU F,MAI NT,BOITEL-CONTI M.Arabidopsis hairy roots producing high level of active human gastric lipase[J].Molecular Biotechnology.2020, 62:168-176.
[26]HU Y,DAI L,LIU D,et al Hydrophobic pore space constituted in macroporous ZIF-8 for lipase immobilizationgreatly improving lipase catalytic performance inbiodiesel preparation[J].Biotechnology for Biofuels.2020,13:1-9.
[27]CHENG Y,LAI O-M,TAN C-P,et al.Proline-Modified UIO-66 as Nanocarriers to Enhance Candida rugosa Lipase Catalytic Activity and Stability for Electrochemical Detection ofNitrofen[J].ACS Applied Materials&Interfaces.
2021,13:4146-4155.
[28]TAGHIZADEH T,AMERI A,TALEBIAN-KIAKALAIEHA,et al.Lipase zeolitic imidazolate framework ZIF-90:A highly stable and recyclable biocatalyst for thesynthesis of fruity banana flavour[J].International Journalof Biological Macromolecules.2021,166:1301-1311.
[29]SAMUI A,CHOWDHURI AR,MAHTO TK,et al.Fabrication of a magnetic nanoparticle embedded NH2-MIL-88B MOF hybrid for highly efficient covalent immobilization of lipase[J].RSC Advances,2016,6:66385-66393.
[30]GASC6N V,JIM魪NEZ MB,BLANCO RM,et al.Semi-crystalline Fe-BTC MOF material as an efficient support for enzyme immobilization[J].Catalysis Today,2018,304:119-126.
[31]XIE W,HUANG M.Enzymatic production of biodiesel using immobilized lipase on core-shell structured Fe3O4 MIL-100(Fe)composites[J].Catalysts,2019,9:850.
[32]QIAN J,SUN F,QIN L.Hydrothermal synthesis of zeolitic imidazolate framework-67(ZIF-67)nanocrystals[J].Materials Letters,2012,82:220-223.
[33]SCHLICHTE K,KRATZKE T,KASKEL S.Improved synthesis,thermal stability and catalytic properties of the metal-organic framework compound Cu3(BTC)2. Microporous and Mesoporous Materials[J].2004,73:81-88.
[34]NADAR SS,RATHOD VK.Encapsulation of lipase within metal-organic framework(MOF)with enhanced activity intensified under ultrasound[J].Enzyme and Microbial Technology,2018,108:11-20.
[35]AMERI A,ASADI F,SHAKIBAIE M,et al.Hydroxyapatite/Glycyrrhizin/Lithium-Based Metal Organic Framework(HA/GL/Li-MOF)Nanocomposite as Support for Immobilization of Thermomyces lanuginosus Lipase[J].Applied Biochemistry and Biotechnology,2022,194(5):1-27.
[36]CHEN J,SUN B,SUN C,et al.Immobilization of lipase AYS on UiO-66-NH2 metal-organic framework nanoparticles asa recyclable biocatalyst forester hydrolysis and kinetic resolution[J].Separation and Purification Technology,2020,251:117398.
[37]YUAN X,OU J,ZHANG P,et al.PEG-modified lipase immobilized onto NH2-MIL-53 MOF for efficient resolution of 4-fluoromandelic acid enantiomers[J].International Journal of Biological Macromolecules,2020,165:1793-1802.
[38]ZARE A,BORDBAR A-K,JAFARIAN F,et al.Candida rugosa lipase immobilization on various chemically modified Chromium terephthalate MIL-101[J].Journal of Molecular Liquids,2018,254:137-144.
[39]ZHU T,ZHAO X,YI M,et al.Ternary cross-linkedPVA-APTES-ZIF-90 membrane for enhanced ethanol dehydration performance[J].Advanced Composites and Hybrid Materials,2021,5(1):1-13.
[40]GASC6N-P魪REZ V,JIM魪NEZ MB,MOLINA A,et al.Efficient one-step immobilization of CaLB lipase over MOF support NH2-MIL-53(Al)[J].Catalysts,2020,10:918.
[41]ZARE A,BORDBAR A-K,RAZMJOU A,et al.The immobilization of Candida rugosa lipase on the modified polyethersulfone with MOF nanoparticles as an excellent performance bioreactor membrane[J].Journal of Biotechnology,2019,289:55-63.
[42]KHEIRKHAH R,BADOEI-DALFARD A,KARAMI Z.Encapsulation and biochemical characterization of Lipase on a silica-coated ZIF-8 /graphene oxide(GSLZIF)and its application on the biodiesel production[J].Journal of the Iranian Chemical Society,2022,19:71-83.
[43]BIBI S,PERVAIZ E,ALI M.Synthesis and applications of metal oxide derivatives of ZIF-67:a mini-review[J].Chemical Papers,2021,75:2253-2275.
[44]DAI H,YUAN X,JIANG L,et al.Recent advances on ZIF-8 composites for adsorption and photocatalytic wastewater pollutant removal:Fabrication,applications and perspective[J].Coordination Chemistry Reviews,2021,441:213985.
[45]LI Y,LIANG F,BUX H,et al.Zeolitic imidazolate framework ZIF-7 based molecular sieve membrane for hydrogen separation[J].Journal of Membrane Science,2010,354(1):48-54.
[46]HUANG A,DOU W,CARO JR.Steam-stable zeolitic imidazolate framework ZIF-90 membrane with hydrogen selectivity through covalent functionalization[J].Journal of the American Chemical Society,2010,132:15562-15564.
[47]HUANG A,BUX H,STEINBACH F,et al.Molecular sieve membrane with hydrogen permselectivity:ZIF 22 in LTA topology prepared with3 aminopropyltriethoxysilane as covalent linker[J].Angewandte Chemie,2010,122(29):5078-5081.
[48]PERALTA D,CHAPLAIS G,SIMON-MASSERON A,et al.Synthesis and adsorption properties ofZIF-76 isomorphs[J].Microporous and Mesoporous Materials,2012,153:1-7.
[49]HOU P,XING G,HAN D,et al.MIL-101(Cr)/graphene hybrid aerogel used as a highly effective adsorbent for wastewater purification[J].Journal of Porous Materials,2019,26:1607-1618.
[50] ZHOU N,TAN J,LI X,et al.Fabrication of Z-scheme Bi5O7I/MIL-53(Fe)hybrid with improved photocatalytic performance under visible light irradiation[J].Journal of Materials Science:Materials in Electronics,2020,31:4822-4835.
[51] HAMON L,SERRE C,DEVIC T,et al.Comparative study of hydrogen sulfide adsorption in the MIL-53(Al,Cr,Fe),MIL-47(V),MIL-100(Cr),and MIL-101(Cr)metal-organic frameworks at room temperature[J].Journal of the American Chemical Society,2009,131:8775-8777.
[52] CAO Y,WU Z,WANG T,et al.Immobilization of Bacillus subtilis lipase on a Cu-BTC based hierarchically porous metal organic framework material:a biocatalyst for esterification[J].Dalton transactions,2016,45:6998-7003.
[53] DO AN D,SEZER S,ULU A,et al.Preparation and Characterization of Amino-Functionalized Zeolite/SiO2 Materials for Trypsin Chymotrypsin Co-immobilization[J].Catalysis Letters,2021,151:2463-2477.
[54] ONOJA E,WAHAB RA.Robust magnetized oil palm leaves ash nanosilica composite as lipase support:Immobilization protocol and efficacy study[J].Applied Biochemistry and Biotechnology,2020,192:585-599.
[55] 邸学,田盛,魏巍,等.响应面法优化磁性壳状固定化脂肪酶制备工艺研究[J].食品安全质量检测学报,2022,13(19):6238-6246.
[56]CHENG W,LI Y,LI X,et al.Preparation and characterization of PDA/SiO2 nanofilm constructed macroporous monolith and its application in lipase immobilization[J].Journal of the Taiwan Institute of Chemical Engineers,2019,104:351-359.
[57] LU J,LI Y,ZHU H,et al.SiO2-Coated Fe3O4 Nanoparticle/Polyacrylonitrile Beads for One-Step Lipase Immobilization[J].ACS Applied Nano Materials,2021,4:7856-7869.
[58]AGHABABAIE M,BEHESHTI M,RAZMJOU A,et al.Covalent immobilization of Candida rugosa lipase on a novel functionalized Fe3O4 SiO2 dip-coated nanocomposite membrane[J].Food and Bioproducts Processing,2016,100:351-360.
[59]SHAH S,GUPTA MN.Lipase catalyzed preparation of biodiesel from Jatropha oil in a solvent free system[J].Process Biochemistry,2007,42:409-414.
[60]SHAH S,SHARMA S,GUPTA M.Biodiesel preparation by lipase-catalyzed transesterification of Jatropha oil[J].Energy&Fuels,2004,18:154-159.
[61]AC1KGOZ-ERKAYA I,BAYRAMOGLU G,AKBULUT A,et al.Immobilization of Candida rugosa Lipase on Magnetic Biosilica Particles:Hydrolysis and Transesterification Studies[J].Biotechnology and Bioprocess Engineering,2021,26:827-840.
[62]KUANG L,ZHANG Q,LI J,et al.Preparation of lipase electrospun SiO2 nanofiber membrane bioreactors and their targeted catalytic ability at the macroscopic oil water interface[J].Journal of Agricultural and Food Chemistry,2020,68:8362-8369.
[63]KUANG G,DU Y,LU S,et al.Silica lipase hybrid biocatalysts with superior activity by mimetic biomineralization in oil/water two-phase system for hydrolysis of soybean oil[J].LWT,2022,160:113333.
[64]MARTIN LS,CER6N AA,MOLINARI D,et al.Enhancement of lipase transesterification activity by immobilization onβcyclodextrin-based polymer[J].Journal of Sol-Gel Science and Technology,2019,91:92-100.
[65]WONG WKL,WAHAB RA,ONOJA E.Chemically modified nanoparticles from oil palm ash silica-coated magnetite as support for Candida rugosa lipase-catalysed hydrolysis:kinetic and thermodynamic studies[J].Chemical Papers,2020,74:1253-1265.
[66]Ruano JAM,de la Cruz CAT,Alzate CEO,Alzate CAC.Techno-economic analysis of chitosan-based hydrogels production[J].Polym Polym Compos,2018:1-22.
[67]DU H,SHI S,LIU W,et al.Processing and modification of hydrogel and its application in emerging contaminant adsorption and in catalyst immobilization:a review[J].Environmental Science and Pollution Research,2020,27:12967-12994.
[68]PAGAOVAJ,PL总KOA,PAPUOVA I,et al.Crystallization of TiO2 xerogel[J].Journal of Thermal Analysis and Calorimetry.2020,142:1643-1648.
[69]PARK S,OH Y,YUN J,et al.Cellulose/biopolymer/Fe3O4 hydrogel microbeads for dye and protein adsorption[J].Cellulose.2020,27:2757-2773.
[70]CHEN M,WU H,LI Z,et al.Synthesis of chitin/graphene oxide composite aerogel beads for lipase immobilization[J].Journal of Porous Materials,2020,27:549-554.
[71]PARK S,KIM SH,KIM JH,et al.Application of cellulose/lignin hydrogel beads as novel supports for immobilizing lipase[J].Journal of Molecular Catalysis B:Enzymatic,2015,119:33-39.
[72]PIERRE A.From random glass networks to random silica gel networks and their use as host for biocatalytic applications[J].Journal ofSol-Gel Science and Technology,2019,90:172-186.
[73]DEON M,MORAWSKI F,PASSAIA C,et al.Chitosan-stabilized gold nanoparticles supported on silica/titania magnetic xerogel applied as antibacterial system[J].Journal of Sol-Gel Science and Technology,2019,89:333-342.
[74]PAI RV,MORAJKAR R,GUMBER N,et al.Preparation of silica xerogel beads embedded with Fe2O3 nanoparticles and their characterization[J].Journal of Nanoparticle Research,2021,23:1-18.
[75]MILAŠINOVI N,MILOSAVLJEVI N,FILIPOVI J,etal.Efficient immobilization of lipase from Candida rugosa by entrapment into poly(N-isopropylacrylamide-co-itaconic acid)hydrogels under mild conditions[J].Polymer Bulletin,2012,69:347-361.
[76]BASRI M,SAMSUDIN S,AHMAD MB,et al.Lipase immobilized on poly(VP-co-HEMA)hydrogel for esterification reaction[J].Applied Biochemistry and Biotechnology,1999,81:205-217.
[77]JO S,PARK S,OH Y,HONG J,et al.Development of cellulose hydrogel microspheres for lipase immobilization[J].Biotechnology and Bioprocess Engineering,2019,24:145-154.
[78]FONSECA S D T,OLIVEIRA D F M U,OLIVEIRA D F C D M,et al.Immobilization of Amano lipase AK from Pseudomonas fluorescens on different types of chitosan-containing supports:use in the kinetic resolution of rac-indanol[J].Bioprocess and Biosystems Engineering,2021,44(4):1-8.
[79]I IK C,ARABACI G,DO AÇYI,et al.Synthesis and characterization of electrospun PVA/Zn2+metal composite nanofibers for lipase immobilization with effective thermal,pH stabilities and reusability[J].Materials Science an Engineering:C,2019,99:1226-1235.
[80]VIRTO MD,AGUD I,MONTERO S,et al.Hydrolysis of animal fats by immobilized Candida rugosa lipase[J].Enzyme and Microbial Technology,1994,16:61-65.
[81]ZAHIRINEJAD S,HEMMATI R,HOMAEI A,et al.Nano-organic supports for enzyme immobilization:scopes and perspectives[J].Colloids and Surfaces B:Biointerfaces,2021,204:111774.
[82]DATTA S,VEENA R,SAMUEL MS,et al.Immobilization of laccases and applications for the detection and remediation of pollutants:a review[J].Environmental Chemistry Letters,2021,19:521-538.
[83]SONI S,DWIVEDEE BP,BANERJEE UC.Tailoring a stable and recyclable nanobiocatalyst by immobilization of surfactant treated Burkholderia cepacia lipase on polyaniline nanofibers for biocatalytic application[J].International Journal of Biological Macromolecules,2020,161:573-586.
[84]SONI S,DWIVEDEE BP,BANERJEE UC.Facile fabrication of a recyclable nanobiocatalyst:immobilization of Burkholderia cepacia lipase on carbon nanofibers for the kinetic resolution of a racemic atenolol intermediate[J].RSC Advances,2018,8:27763-27774.
[85]QIN Z,FENG N,LI Y,et al.Hydrogen-bonded lipase-hydrogel microspheres for esterification application[J].Journal of Colloid and Interface Science,2022,606:1229-1238.
[86]NASERI M,PITZALIS F,CARUCCI C,et al.Lipase and laccase encapsulated on zeolite imidazolate framework: Enzyme activity and stability from voltammetric measurements[J].Chem Cat Chem,2018,10:5425-5433.
[87]PINTO FG,FERNANDES FR,CALDEIRA VP,et al.Influence of the Procedure to Immobilize Lipase on SBA-15 for Biodiesel Production from Palm Kernel Oil[J].Catalysis Letters,2021,151:2187-2196.
[88]MARTINS SR,ANDRADE S,FRICKS AT,et al.Ionic liquid synergistic effect between preparation of hybrid supports and immobilization of lipase applied to esters production[J].Journal ofThermal Analysis and Calorimetry,2020,147(2):1-14.
[89]NEZHAD MK,AGHAEI H.Tosylated cloisite as a new heterofunctional carrier for covalent immobilization of lipase and its utilization for production of biodiesel from waste frying oil[J].Renewable Energy,2021,164:876-888.
[90]RAJAN A,EMILIA ABRAHAM T.Studies on crystallization and cross-linking of lipase for biocatalysis[J].Bioprocess and Biosystems Engineering,2008,31:87-94.
[91]PAITAID P.Magnetic cross-linked enzyme aggregates of Aspergillus oryzae ST11 lipase using polyacrylonitrile coated magnetic nanoparticles for biodiesel production[J].Applied Biochemistry and Biotechnology,2020,190:1319-1332.
[92]ABDULLA R,RAVINDRA P.Cross-linked lipase in hybrid matrix for biodiesel production from crude Jatropha curcas oil.editor.^editors[J].Developments in sustainable chemical and bioprocess technology:Springer,2013:197-202.
[93]AL-MANSOURI R,DU W,AL-ZUHAIR S. Reaction-diffusion model to describe biodiesel production using lipase encapsulated in ZIF-8[J].Fuel,2022,311:122630.
[94]CAI X,ZHANG M,WEI W,et al.The immobilization of Candida antarctica lipase B by ZIF-8 encapsulation and macroporous resin adsorption:preparation and characterizations[J].Biotechnology Letters,2020,42:269-276.
[95]JIAOJIAO X,YAN Y,BIN Z,et al.Improved catalytic performance of carrier-free immobilized lipase by advanced cross-linked enzyme aggregates technology[J].Bioprocess and Biosystems Engineering,2022,45:147-158.










