雌二醇中残留溶剂测定方法的建立论文
2024-05-14 10:41:11 来源: 作者:liyuan
摘要:建立顶空气相色谱法,同时测定雌二醇中的残留溶剂甲醇和乙醇。采用以6%氰丙基和94%二甲基聚硅氧烷为固定相的毛细管柱作为色谱柱,用氢火焰离子化检测器检测。方法学验证结果表明:甲醇质量浓度为2.01~20.1μg/mL时残留溶剂线性关系良好(r=0.999 8),乙醇质量浓度为2.00~24.0μg/mL时残留溶剂线性关系良好(r=0.999 8);甲醇回收率分别为106.9%、102.2%、100.8%,乙醇回收率为104.3%、103.8%、105.9%。该方法专属性强、灵敏度高、准确性好,可用于雌二醇中
摘要:建立顶空气相色谱法,同时测定雌二醇中的残留溶剂甲醇和乙醇。采用以6%氰丙基和94%二甲基聚硅氧烷为固定相的毛细管柱作为色谱柱,用氢火焰离子化检测器检测。方法学验证结果表明:甲醇质量浓度为2.01~20.1μg/mL时残留溶剂线性关系良好(r=0.999 8),乙醇质量浓度为2.00~24.0μg/mL时残留溶剂线性关系良好(r=0.999 8);甲醇回收率分别为106.9%、102.2%、100.8%,乙醇回收率为104.3%、103.8%、105.9%。该方法专属性强、灵敏度高、准确性好,可用于雌二醇中残留溶剂的测定。
关键词:雌二醇;残留溶剂;气相色谱
雌二醇属于甾醇类激素,是反映人体健康状况的重要指标[1],广泛用于女性性功能疾病、更年期综合征[2]、骨质疏松[3]、纤维化[4]、神经细胞[5]等疾病的治疗,对于维护心血管系统[6]、预防射线、促进脂质代谢[7]非常有利。
残留溶剂是原料药制备工艺所不可避免的关键因素,若残留溶剂高于安全范围,其就会对人体造成危害。《中国药典》尚未收载对雌二醇残留溶剂的测定。雌二醇合成工艺复杂,其主要残留溶剂为甲醇和乙醇。根据残留溶剂指导原则,甲醇和乙醇分别属于二类溶剂和三类溶剂。二类溶剂为非遗传毒性致癌(动物实验)试剂或可能导致其他不可逆毒性(如神经毒性或致畸性)的试剂,三类溶液为对人体低毒的溶剂,二者应被限制使用[8-9]。由此可见,为了保证雌二醇制剂的安全性,建立对于雌二醇中残留溶剂的测定方法具有重要意义。

1仪器与试药
1.1仪器
Agilent 7890A型气相色谱仪;氢火焰离子化检测器(FID);Mettler XP205型电子分析天平。
1.2试药
甲醇(国药集团化学试剂有限公司,批号:20200105,纯度:99.5%),乙醇(国药集团化学试剂有限公司,批号:20200217,纯度:99.7%),二甲基亚砜(Merck,批号:K53179600,纯度:100%)。
2方法与结果
2.1色谱条件与系统适用性试验
色谱柱:采用以6%氰丙基和94%二甲基聚硅氧烷为固定相的毛细管柱;程序升温:初始温度40℃,保持10 min,以5℃/min的速率升温至200°C,保持5 min;运行55 min;进样器温度140°C;检测器温度250°C;定量环温度125°C;传输线温度150°C;载气为氦气;分流模式,分流流速约25 mL/min。顶空瓶平衡温度为80°C;平衡时间30 min;加压时间0.1 min;定量环填充时间0.2 min;定量环平衡时间0.05 min;进样时间1 min;振摇为低。
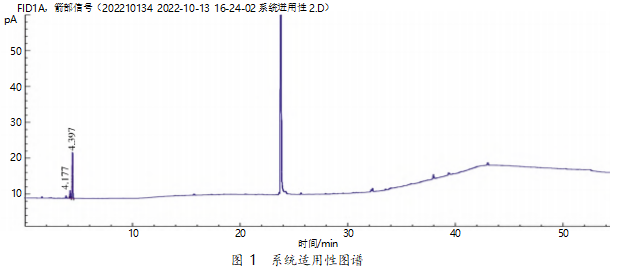
系统适用性试验:取系统适用性溶液进样,各组分色谱峰间的分离度均符合要求,甲醇和乙醇的分离度为2.14,色谱图见图1。
2.2溶液制备
2.2.1稀释剂
50%二甲基亚砜溶液(二甲基亚砜-水(1:1)溶液)
2.2.2对照品溶液
称取适量甲醇、乙醇,精密称定,用50%二甲基亚砜溶液定量稀释成每1 mL含20μg、200μg甲醇的混合对照品溶液,精密量取5 mL置于顶空瓶中,密封,即得。
2.2.3供试品溶液
取本品约50 mg,精密称定,置顶空瓶中,精密加入50%二甲基亚砜溶液5.0 mL溶解,密封,摇匀。
2.3方法学考察
2.3.1专属性考察
取2.2项下稀释剂(空白溶液)、对照品溶液和供试品溶液,分别精密量取5 mL置于顶空瓶中,密封,即得。结果表明,空白溶液在各溶剂出峰处未受干扰,证明该方法专属性良好。
2.3.2线性关系考察
精密量取甲醇、乙醇适量,制成甲醇含量200μg/mL、乙醇含量200μg/mL的对照品储备液。分别精密量取甲醇储备液1.0 mL、0.9 mL、0.8 mL、0.7 mL、0.5 mL、0.2 mL、0.1 mL,乙醇储备液1.2 mL、1.0 mL、0.8 mL、0.5 mL、0.4 mL、0.2 mL、0.1 mL,置于同一10 mL量瓶中,用50%二甲基亚砜溶液稀释至刻度,摇匀,分别作为线性①-⑦溶液。精密量取上述7个线性溶液,顶空进样,记录色谱图。以浓度对主峰面积作标准曲线,结果如表1。
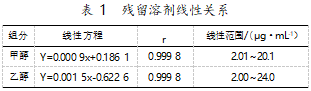
结果表明,甲醇质量浓度为2.01~20.1μg/mL时线性关系良好,乙醇质量浓度为2.00~24.0μg/mL时线性关系良好。
2.3.3重复性考察
取雌二醇原料药1批,参照2.2.2项下方法平行制备供试品溶液6份,按拟定条件测定。结果甲醇、乙醇均有检出,甲醇平均检出量为80 mg/L,SRSD为7.1%(n=6);乙醇平均检出量为290 mg/L,SRSD为5.0%(n=6)。表明该方法重复性良好。
2.3.4加样回收率考察
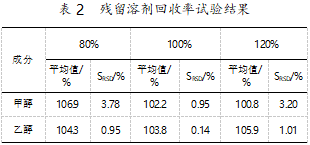
分别称取甲醇、乙醇适量,配制成甲醇质量浓度为2.01 mg/mL、乙醇质量浓度为20.05 mg/mL的混合储备液。精密称取残留溶剂量的原料药0.5 g,共9份,各置于顶空瓶中,分别精密加入上述混合储备液0.8 mL、0.8 mL、0.8 mL、1.0 mL、1.0 mL、1.0 mL、1.2 mL、1.2 mL、1.2 mL,制成80%、100%、120%的低、中、高浓度,顶空进样。结果见表2。
2.3.5检测限与定量限
精密量取对照品储备液适量,作系列稀释,甲醇、乙醇的检测限分别为0.002%、0.003%;甲醇、乙醇的定量限分别为0.000 5%、0.000 8%。
3讨论
目前,雌二醇在2020版《中国药典》中有所收载,但其残留溶剂检查项仍未被订入标准。本文通过一系列摸索,建立了有关雌二醇中残留溶剂甲醇、乙醇的气相分析方法,完善了雌二醇原料药的质量标准,更充分地保证了用药安全性。
根据ICH《Q3C(R8):杂质:残留溶剂》和《中国药典》中的控制标准[9],甲醇、乙醇的限度规定分别为0.3%和0.5%。通过对3批样品进行检测,甲醇和乙醇的检测结果均小于0.1%。方法学验证的试验结果表明,该方法的检测限及定量限在该浓度下的信噪比均符合要求,定量限小于报告限度的0.5倍(相当于供试品0.05%),线性关系良好,且能被准确检测,专属性强、灵敏度高、准确性好。因此该方法适用于雌二醇原料药中残留溶剂的测定。
溶剂二甲基亚砜的纯度达到了色谱纯及以上级别。由于甲醇、乙醇容易受溶剂中的杂质峰干扰,故要求二甲基亚砜的纯度要尽可能高。研究发现,分析纯二甲基亚砜在甲醇、乙醇附近存在杂质峰干扰,且与二甲基亚砜的分离度不足1.0;此外,受工艺限制,二甲基亚砜在甲醇峰附近也存在残留的干扰,导致测定结果存在偏差。在改用Merck公司色谱纯二甲基亚砜后,对甲醇、乙醇存在干扰的杂质峰均不明显,表明溶剂来源对该方法的测定影响较大。
参考文献
[1]王一恺.雌二醇偶联碱性磷酸酶工艺改进[J].生物化工,2022,8(2):1-6,11.
[2]钱彩英,赵俊红.17-β-雌二醇治疗更年期综合征[J].中国新药与临床杂志,2002(4):199-201.
[3]QUIGLEY ME,MARTIN PL,BURNIER AM,et al.Estrogen therapy arrests bone loss in elderly women[J].American Journal of Obstetrics&Gynecology,1987,156(6):1516-1523.
[4]李东,李兵顺,刘金星,等.雌二醇抗肝纤维化的实验研究[J].中华消化杂志,2002,(10):55-56.
[5]PICAZO O,AZCOITIA I,GARCIA-SEGURA LM.Neuroprotective and neurotoxic effects of estrogens[J].Brain Research,2003,990(1-2):20-27.
[6]付晓东,谈智,李永勇,等.17-β-雌二醇对血管内皮细胞增殖的影响[J].中山大学学报(医学科学版),2003(5):417-420.
[7]朱英坚.雌激素受体(ER)、雄激素受体(AR)与前列腺癌[J].国外医学.泌尿系统分册,2002(5):283-286.
[8]周海钧.药品注册的国际技术要求:质量部分[M].北京:人民卫生出版社,2006.
[9]国家药典委员会.中华人民共和国药典(四部)[M].北京:中国医药科技出版社,2020.










