“化学反应速率与反应限度”考点点击论文
2023-09-12 14:07:28 来源: 作者:xieshijia
摘要:通过举例说明化学反应速率与反应限度的考点,帮助学生在掌握此部分内容的同时,体会到化学反应是有快慢和限度的,初步发展学生的变化观念与平衡思想.
摘要:通过举例说明化学反应速率与反应限度的考点,帮助学生在掌握此部分内容的同时,体会到化学反应是有快慢和限度的,初步发展学生的变化观念与平衡思想.
关键词:化学反应速率;反应限度;考点;高中化学
考点一、化学反应速率的定义
例1下列关于化学反应速率的说法正确的是( ).
A.化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加
B.化学反应速率为0.8 mol·L-1·s-1是指1 s时某物质的浓度为0.8 mol·L-1
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象就越明显
解析固体或纯液体的浓度不变,不能用于表示化学反应速率,A项错误;化学反应速率为“0.8 mol·L-1·s-1”表示1 s内某物质的浓度增加或减少0.8 mol·L-1,B项错误;化学反应有的快,有的慢,则使用化学反应速率来定量表示化学反应进行的快慢,C项正确;反应速率快的现象不一定明显,如NaOH与HCl的反应,D项错误.
答案:C
点拨(1)化学反应速率指的是一段时间内的平均速率,而不是瞬时速率.
(2)同一反应可用不同物质来表示化学反应速率,数值可能不同,但意义相同,在表示化学反应速率时,应指明哪一种物质.
(3)一般不用固体或纯液体来表示化学反应速率.
考点二、化学反应速率的简单计算
例2反应4NH3(g)+5O2(g)⥫⥬4NO(g)+6H2 O(g),在5 L密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率为( ).

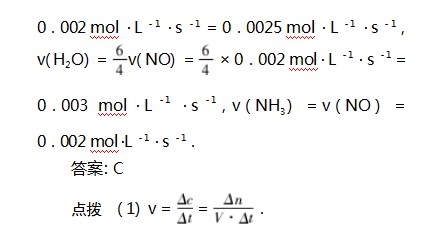
(2)同一化学反应用不同的物质表示化学反应速率,其化学反应速率之比等于化学方程式中化学计量数之比.
考点三、化学反应速率的比较
例3对于反应A(g)+3B(g)⥫⥬2C(g)+2D(g),下列分别表示不同条件下的反应速率,则反应速率大小关系正确的是( ).
①v(A)=0.01 mol·L-1·s-1
②v(B)=1.20 mol·L-1·min-1
③v(C)=2.40 mol·L-1·min-1
④v(D)=0.02 mol·L-1·s-1

点拨同一化学反应用不同物质表示的反应速率,在比较反应速率的大小时,不能只看数值的多少,而要进行一定的转化,具体比较方法如下:
(1)一统一:将化学反应速率的单位进行统一;
(2)二转化:将不同物质表示的化学反应速率转化成同一物质表示的化学反应速率,或分别除以相应物质的化学计量数;
(3)三比较:比较同一物质表示的化学反应速率或除以化学计量数之后的数值,数值越大,反应进行得越快.
考点四、“三行式”的应用
例4把0.3 mol X气体和0.4 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)=nZ(g)+6W(g),2 min末生成0.3 mol W.测得0~2 min内,Z的浓度变化表示的反应速率为0.05 mol·L-1·min-1,下列选项错误的是( ).
A.前2 min,Z的物质的量增加了0.2 mol
B.化学方程式中n的值是5
C.X的转化率约为66.7%
D.前2 min内用Y的浓度变化表示的反应速率为0.0625 mol·L-1·min-1
解析前2 min Z的物质的量增加了0.05 mol·L-1·min-1×2 min×2 L=0.2 mol,A项正确;列“三行式”如下:
4X(g)+5Y(g)=nZ(g)+6W(g)
起始(mol)0.3 0.4 0 0
变化(mol)0.2 0.25 0.2 0.3
2 min末(mol)0.1 0.15 0.2 0.3 n∶6=0.2 mol∶0.3 mol,解得n=4,B项错

点拨“三行式法”的解题步骤如下:
(1)写出有关反应的化学方程式;
(2)找出各物质的起始量、转化量、终了量,对反应物:起始量-转化量=终了量;对生成物:起始量+转化量=终了量;
(3)根据已知条件列方程计算:各组分的物质的量或浓度变化量之比等于化学方程式的化学计量数之比,也等于它们的反应速率之比.
考点五、影响化学反应速率的因素
例5对于在一个密闭容器中进行的反应C(s)+H2 O(g)⥫⥬CO(g)+H2(g),下列条件的改变对反应速率几乎没有影响的是( ).
①将容器的体积缩小一半
②增加CO的量
③增加C的量
④保持体积不变,充入N2
⑤升高反应体系的温度
⑥保持压强不变,充入N2
A.②③B.③④C.①⑥D.④⑥
解析①将容器的体积缩小一半,容器中气体压强增大,反应速率增大;②增加一氧化碳的量,物质的浓度增大,反应速率增大;③增加C的量,固体的浓度为定值,不影响反应速率;④保持体积不变,充入不参加反应的氮气,实际参加反应气体的浓度不变,反应速率不变;⑤升高反应体系的温度,反应速率增大;⑥保持压强不变,充入不参加反应的氮气,容器的体积增大,实际参加反应气体的浓度减小,反应速率减小.
答案:B
点拨(1)固体和纯液体的浓度是定值,改变它们的物质的量不影响反应速率.
(2)压强对反应速率的影响只适用于有气体参加的反应.①恒容时,充入“惰气”→总压强增大,但各气态物质的浓度不变→反应速率不变;②恒压时,充入“惰气”→体积增大→各气态物质的浓度减小→反应速率减小.
(3)催化剂具有专一性,只能针对特定的反应.通常不指明的情况下,催化剂都是指正催化剂.
考点六、控制变量法
例6某小组同学用相同质量的大理石(主要成分为CaCO3)与相同体积的盐酸反应,设计了表1所列4个实验,探究反应条件对化学反应速率的影响.下列说法不正确的是( ).
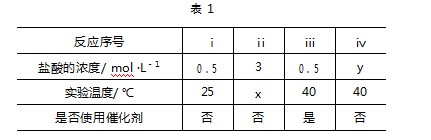
A.实验ⅰ、ⅱ研究浓度对反应速率的影响,x的值为25
B.实验ⅱ、ⅳ研究温度对反应速率的影响,y的值为3
C.实验ⅰ、ⅲ研究温度对反应速率的影响
D.仅通过以上四个实验,无法研究催化剂对反应速率的影响
解析若实验ⅰ、ⅱ研究浓度对反应速率的影响,根据控制变量法可知,盐酸的浓度不同,其他条件必须相同,则实验温度相同,即x=25,A项正确;若实验ⅱ、ⅳ研究温度对反应速率的影响,则实验温度不同,盐酸的浓度必须相同,即x≠40,y=3,B项正确;对比实验ⅰ、ⅲ可知,只有盐酸的浓度相同,有两个变量不同,实验温度、实验ⅲ加入了催化剂,根据控制变量法可知,实验ⅰ、ⅲ不能研究温度对反应速率的影响,C项错误;对比实验ⅰ与实验ⅲ可知,二者有两个变量不同(温度、催化剂);对比实验ⅲ与实验ⅱ可知,二者有3个变量不同(温度、浓度、催化剂);对比实验ⅲ与实验ⅳ可知,二者有2个变量不同(浓度、催化剂),根据控制变量法可知,仅通过以上四个实验无法研究催化剂对反应速率的影响,D项正确.
答案:C
点拨(1)控制变量时,只能改变一个条件,其它条件不能变化.
(2)保持溶液浓度不变时,应使混合后溶液的体积不变.
考点七、可逆反应
例7在一密闭容器中进行如下反应:2SO2(g)+O2(g)⥫⥬2SO3(g).已知反应过程中,某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能存在的数据是( ).
A.SO2为0.4 mol·L-1,O2为0.2 mol·L-1
B.SO3为0.4 mol·L-1
C.SO2、SO3均为0.15 mol·L-1
D.SO2为0.25 mol·L-1
解析可逆反应有限度,不能向左或向右完全转化.若SO2变为0.4 mol·L-1,O2变为0.2 mol·L-1,则SO3完全转化,A项不可能;若SO3变为0.4 mol·L-1,则SO2和O2完全转化,B项不可能;SO2、SO3的起始浓度相同,无论任何方法,均不可能使SO2、SO3浓度均减小为0.15 mol·L-1,C项不可能;若SO2变为0.25 mol·L-1,则反应逆向进行,消耗0.05 mol·L-1 SO3,0.05 mol·L-1<0.2 mol·L-1,D项可能.
答案:D
点拨(1)可逆反应中,正、逆反应必须在同一条件下进行.
(2)可逆反应达到平衡状态时,各物质一定共存,即任何物质的浓度不可能为0.
考点八、化学反应限度
例8下列关于化学反应限度的叙述中,正确的是( ).
A.任何化学反应的限度都相同
B.通过控制条件可以改变化学反应限度
C.一定条件下,延长反应时间可以改变化学反应限度
D.当一个化学反应在一定条件下达到最大限度时,反应速率也最大
解析化学反应不同,反应限度不相同,A项错误;化学平衡状态是在一定条件下达到的,当改变外界条件时,化学平衡状态可能改变,因此化学反应限度也会改变,B项正确;化学反应的限度与反应时间无关,C项错误;当化学反应在一定条件下达到限度时,正、逆反应速率相等,反应未停止,速率不一定是最大,D项错误.
答案:B
点拨(1)化学反应限度是在给定的条件下,可逆反应所能达到的最大程度.
(2)不同的可逆反应在给定条件下的反应限度不同;同一可逆反应在不同条件下(如温度、浓度、压强等)的反应限度不同.
考点九、化学平衡状态的判断
例9下列说法能说明反应2HI(g)⥫⥬H2(g)+I2(g)已达到平衡状态的是( ).
①单位时间内生成n mol H2的同时生成n mol HI
②一个H—H键断裂的同时有两个H—I键断裂
③c(HI)=c(I2)
④v(H2)=v(I2)=0.5v(HI)
⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1
⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧条件一定,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再发生变化
⑩温度和压强一定时,混合气体的密度不再发生变化
A.①②⑤⑨⑩B.②⑥⑨
C.②⑥⑨⑩D.全部
解析①物质的变化量之比不等于化学计量数之比,正、逆反应速率不等,反应未达到平衡状态,错误;②一个H-H键断裂的同时应有两个H-I键形成,故两个H-I键形成的同时有两个H-H键断裂,正、逆反应速率相等,反应达到平衡状态,正确;③未知起始投入量,不能说明反应达到平衡状态,错误;④未体现正与逆的关系,错误;⑤浓度比与化学计量数比相等不能说明浓度不变,故不能证明反应达到平衡,错误;⑥温度和体积一定时,生成物浓度不再变化,说明正逆反应速率相等,达到平衡状态,正确;⑦反应前后气体化学计量数和相同,容器压强始终不变,错误;⑧反应前后气体总质量不变,总物质的量也不变,相对分子质量一直不变,不能证明反应达到平衡,错误;⑨温度和体积一定时,混合气体颜色不再变化,说明c(I2)不再发生变化,反应达到平衡状态,正确;⑩温度和压强一定时,由于反应前后体积和气体的质量始终不变,则混合气体的密度始终不变,即密度不再变化不能说明反应达到平衡状态,错误.
答案:B
点拨利用压强、密度、相对分子质量等判断化学平衡时要“三看”:
(1)一看容器的体积是固定的还是可变的;
(2)二看反应中是否全为气体物质,即气体的质量是否守恒;
(3)三看反应前后气体的体积是否变化.总体原则是由“变”到“不变”即可判断.
考点十、化学反应速率和化学平衡图像分析
例10 500℃时,A、B、C三种气体在恒容密闭容器中发生反应,浓度随时间发生变化如图1所示.下列说法正确的是( ).
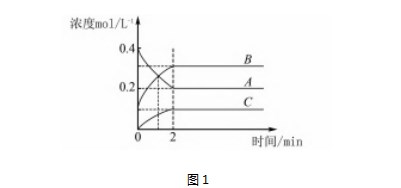
A.发生的反应可表示为2A═══2B+C
B.1 min时反应达到了该条件下的最大限度
C.前2 min内A的平均反应速率为0.05 mol·L-1·min-1
D.2 min时,容器内的压强不再变化
解析根据图像可知,反应进行到2 min时A的浓度减小0.4 mol·L-1-0.2 mol·L-1=0.2 mol·L-1,A是反应物,B浓度增加0.3 mol·L-1-0.1 mol·L-1=0.2 mol·L-1,C浓度增加0.1 mol·L-1,B和C是生成物,且是可逆反应,根据变化量之比是化学计量数之比可知发生的反应可表示为2A⥫⥬2B+C,A项错误;1 min时物质的浓度仍然在发生变化,反应没有达到该条件下的最大限度,B项错误;前2 min内v(A)=

(1)看清横坐标和纵坐标表示的意义;(2)弄清曲线的变化趋势;
(3)根据图中数据计算化学反应速率,分析条件对反应速率的影响,确定化学平衡状态.
参考文献:
[1]人民教育出版社,课程教材研究所,化学课程教材研究开发中心.普通高中课程标准实验教科书·化学[M].北京:人民教育出版社,2010.










