金属对反芳香性体系的稳定作用论文
2026-02-06 17:24:51 来源: 作者:xuling
摘要:以典型的反芳香性分子环丁二烯(C4H4)为例,其因4π电子符合4n规则而表现出高反应活性和结构不稳定性。
摘要:以典型的反芳香性分子环丁二烯(C4H4)为例,其因4π电子符合4n规则而表现出高反应活性和结构不稳定性。然而,当环丁二烯与过渡金属(如Fe、Cr)配位形成CbFe(CO)3等配合物时,金属的d轨道与配体的π轨道发生显著杂化,形成新的分子轨道体系。理论分析表明,CbFe片段中π电子重新分布为6个(符合4n+2规则),从而赋予其金属芳香性,表现为键长均一化和化学稳定性提升。这不仅深化了对芳香性概念的理解,也为金属有机化合物的功能化应用开辟了新途径。
关键词:反芳香性;金属芳香性;环丁二烯
0引言
在化学领域,芳香性的概念自提出以来,一直是众多科研人员研究的重点。最早,Kekulé提出芳香性概念,用于解释苯及其衍生物这类具有特殊化学稳定性的不饱和环状共轭体系。随后,Hückel提出著名的4n+2规则,即当π电子数为4n+2个且具有环电流的平面结构时,具有芳香性。而Breslow引入反芳香性概念[1],用于解释像环丁二烯这类具有4n个π电子化合物的不稳定性。此外,又相继提出了σ芳香性、δ芳香性和φ芳香性等芳香性概念[2],极大地扩充了芳香性的内涵。
环丁二烯是典型的反芳香性化合物,它具有环状共轭体系,4个碳原子通过π电子共轭形成理论上的平面四边形构型,其π电子数为4个,符合4n规则(n=1),属于反芳香性体系。这种特殊的电子结构使得环丁二烯极不稳定,只能存在于低温的惰性气体环境中。为了规避反芳香性带来的高能量,环丁二烯分子会发生扭曲,形成非平面结构,如矩形或双自由基形式,破坏完全共轭。受Jahn-Teller效应影响,分子对称性自发降低,从正方形变为矩形,以降低能量。因此,环丁二烯反应活性极高,极易发生二聚或加成反应(如与自身反应生成三环辛二烯)。
1979年,环丁二烯环配位的金属有机化合物的制备引起了科学界的广泛关注。其中,CbFe(CO)3尤为突出。在CbFe(CO)3中,环丁二烯呈现出键长均一化、稳定性增强等芳香性化合物才有的性质。为解释这一现象,Fenske提出了金属芳香性(Metalloaromaticity)概念,即:CbFe部分组成一个片段,在由Cb的π轨道与金属的d轨道形成的新分子轨道上存在4n+2个电子,因而具有芳香性。这一理论不仅成功解释了CbCr(CO)4和CbNi(CO)2等化合物的相关性质,而且通过与C6H6Cr(CO)3和Fe(C5H5)2比较,证实了其普适性。
1 CbFe(CO)3的金属芳香性
在分析CbFe(CO)3的金属芳香性时,先从Cb的分子轨道入手。由于σ键对整个体系的影响较小,故本研究主要考虑π体系。当Cb为D4h对称性时,其前线轨道有着特定的相互作用方式:能量最低的a2u轨道可与dz2形成σ键,两个eg轨道能与金属的dxz和dyz形成π键,能量最高的b1u轨道可与金属的dxy形成δ键,而金属的dx2-y2则不与Cb相互作用。需要注意的是,D4h对称性下的Cb为双自由基,两个单电子分布在eg轨道上,但单独存在的Cb因构型畸变,两个eg轨道并不相等,呈单线态。
再看具有C3v对称性的(CO)3。CO中最重要的轨道是给电子的5σ轨道和空的2π轨道。将3个CO按照C3v进行组合,5σ轨道形成a1+e,2π轨道形成a1+a2+2e,金属3d轨道变化为a1(dz2)+2e(dxy,dxz,dyz,d x2-y2)。根据三个羰基相对于金属的几何结构,e(dx2-y2,dxy)轨道主要与CO的2π相互作用e(dxz,dyz)主要与CO的5σ相互作用。
为深入分析CbFe(CO)3,Fenske将其拆解为两个部分:一是Cb与Fe重叠,二是CbFe作为整体与(CO)3重叠。通过对分子轨道的计算,将得到的分子轨道MO转化为由Fe轨道和Cb轨道组成的基。结果发现,金属的dx2-y2、dz2、dxy轨道与Cb环的作用力最小,形成占据轨道b1,a1(d)和b2(d)分子轨道。其中,金属成分占比超过90%,可视为由d轨道形成的非键轨道。Cb的eg轨道与3d形成e/e*轨道,金属和Cb在其中几乎各占50%,表明金属和配体之间电荷分配相等,形成标准的共价键[3]。剩下的Cb的a2u和b1u也成为非键轨道,分别是a1(Cb)和b2(Cb)轨道,如图1所示。仅考虑π体系时,a1(Cb)和e轨道上共填充了6个电子(Fe提供2个,Cb提供4个,Fe剩下的6个电子填充在由d轨道形成的非键轨道上),符合4n+2规则,从而具有“芳香性”。
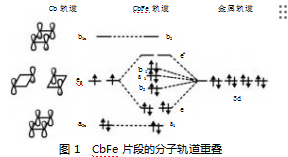
CbFe(CO)3的电子结构具有独特之处:一是Cb的eg能级与Fe的3d能级接近,能大量混合。二是Fe(0)具有8个价电子,不需要占用金属-环的反键轨道。三是羰基的几何结构有利于金属与CO形成良好的反馈π键。基于此理论,可以对另外两种Cb-金属配合物进行性质预测。
同样是18电子构型的化合物CbCr(CO)4和Cb-Ni(CO)2,其中,CbCr(CO)4已经实现了合成,但CbNi(CO)2不存在。先看d6构型的CbCr(CO)4,其Cb为方形,但它不像CbFe(CO)3那样发生Friedel-Crafts酰基化反应,这表明CbM的金属芳香性有所变化。原因在于,Cr的3d能级比Fe的3d能级高约2 eV,增强了M与CO形成的反馈π键。同时,减少了M与Cb的混合。而且,由于有4个CO,可排列成C4对称性构型,Cb的eg轨道必须与CO竞争dxz、dyz轨道,进而削弱了金属芳香性。
再分析CbNi(CO)2,实际上尚未合成出d10构型的CbM化合物。在d10体系中,额外的两个电子会占据e*反键轨道,极大地削弱金属环键。Ni(CO)4与trans-3,4-二氯-1,2,3,4-四甲基环丁二烯反应,得到的不是0价的羰基化合物,而是氯桥联的CbNi化合物。其中,Ni为+2价,为d8电子构型。
2 C6H6M体系的金属芳香性
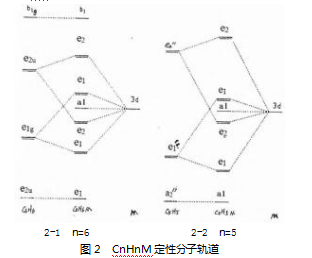
通过引入金属芳香性的概念来解释CpM和C6H6M体系。首先考虑C6H6M,计算发现,苯环的e1g可以向3d提供电子,空的e2g可以接受d轨道的电子,净效益为电子从3d轨道流向苯环的e2g,从而削弱了苯环的芳香性。事实上,C6H6Cr(CO)3的Friedel-Crafts酰基化反应并不容易进行,(C6H6)2Cr不发生任何芳香亲电反应,取代基效应也不会在苯环上进行传递,说明M大大破坏了苯环原有的芳香性。另外,金属环戊二烯配合物具有许多典型芳香族化合物的化学性质。例如,二茂铁具有丰富多样的有机化学性质。一般来说,Cp环比苯更容易发生亲电取代。在分析过程中需要同时考虑Cp和闭壳阴离子C5H5-。自由配体Cp的构型为(a2’)2(e1’)3,e1’为强的键,能量低于3d,因此,M-Cp的e1轨道被定域在环上,可以视为Cp-向金属填入电子。同样需要注意的是,Cp的e2’轨道要高于苯环的e2u轨道,当电子填入e2对于芳香性的破坏要小于苯环。根据上述分析,CpM更适合看作Cp-和M+的离子相互作用,表现为Cp-自身的芳香性,而不是CpM体系,如图2所示。
3结论
芳香性是化学中极具魅力且基础的概念,尽管科研人员已进行了大量研究,但该领域仍存在许多未知。许多反芳香性化合物由于自身不稳定,人们对其性质了解有限。开发更多稳定反芳香性化合物的方法,对于深入研究它们的性质至关重要。
本文梳理了金属有机化学领域中常见芳香环与金属的配位作用,解释了金属对Cb环具有特殊稳定作用的原因,把反芳香性的Cb环转化为具有芳香性的CbFe片段。CbFe(CO)3中的CbFe片段因Cb与Fe之间存在强共价键,使其π体系含有6个电子,具有金属芳香性,而苯环、Cp-等常见芳香环配体则不具备这种特性。这一研究成果拓展了人们对金属与芳环相互作用的认知,为后续相关研究提供了重要参考。
参考文献
[1]杨世柱,邢有权.环丁二烯的结构、性质及其制备[J].黑龙江大学自然科学学报,1984(2):75-85.
[2]黄宝磊,孙昊,李欣烨,等.芳香性概念的最新进展[J].大学化学,2021,36(8):32-40.
[3]朱少娇.不同复杂程度探究素材对高中生化学结构探究能力的影响:共价键[J].化学教育(中英文),2024,45(11):85-90.










