基于 β- 酮酸与异氰酸酯脱羧 - 亲核加成反应合成 β-酮酰胺的研究论文
2026-02-06 11:51:24 来源: 作者:xuling
摘要:以β-酮酸和异氰酸酯为原料,在室温下通过脱羧-亲核加成反应合成β-酮酰胺。对反应条件进行了优化,并探索了底物的适用范围。利用1H NMR、13C NMR对产物进行了结构确证。
摘要:以β-酮酸和异氰酸酯为原料,在室温下通过脱羧-亲核加成反应合成β-酮酰胺。对反应条件进行了优化,并探索了底物的适用范围。利用1H NMR、13C NMR对产物进行了结构确证。结果表明,在反应时间24 h、以乙酰丙酮铁为催化剂、二氯甲烷为溶剂的最优条件下,合成的β-酮酰胺产率在60%~90%之间。
关键词:β-酮酸;β-酮酰胺;铁催化剂;脱羧反应;异氰酸酯
0引言
在合成药物化学中,酰胺键的形成是构建药物骨架的核心步骤。作为强极性官能团,酰胺基团不仅通过氢键作用增强药物与靶蛋白的亲和力,其代谢稳定性更直接影响药效持久性[1-2]。文献研究表明,根据综合药物化学数据库的分析,约54%的经生物测试的化合物分子中含有至少一个酰胺键,而超过25%的已知药物结构中包含酰胺官能团。这些数据凸显了酰胺键在药物发现领域的核心地位,其独特的氢键形成能力和代谢稳定性使其成为药物化学家优先选用的优势结构单元(图1)[3-4]。
此外,美国化学会绿色化学研究所制药圆桌会议(ACS GCIPR)将酰胺合成列为制药行业前十大重点研究领域之一。值得注意的是,当前活性药物成分(API)制造中的酰胺偶联反应工艺在反应效率与可持续性方面存在显著不足[5]。
在酰胺的众多合成路径中,异氰酸酯作为高效酰胺前体已逐渐成为极具吸引力的策略,近年来引发了合成化学界的广泛研究兴趣。例如,在有机金属试剂存在下,异氰酸酯可通过碳碳键形成反应合成相应的酰胺类化合物[6]。
Matsuda课题组于2001年报道了该领域一项具有开创性的研究成果,他们开发了一种新型多组分氢氨基甲酰化反应,该反应创新性地采用异氰酸酯作为酰胺合成前体,并通过与氢硅烷及不饱和羰基化合物的协同作用,实现了结构多样的α-酯酰胺化合物库的快速构建,且反应收率优异[7]。
尽管早期在该领域已取得突破性进展,但从异氰酸酯出发合成羰基酰胺的方法探究,却长期处于停滞状态。
β-酮酸作为一种简单酮的烯醇等价物,已被广泛应用于脱羧转化反应中,常见的包括羟醛缩合反应和曼尼希反应等[8-9]。
鉴于酰胺骨架在合成化学与生物化学领域的关键作用,并受重要研究先例的启发,本文提出创新设想:以路易斯酸为催化剂,催化β-酮酸与异氰酸酯发生亲核加成反应,进而构建酮酰胺化合物。
1实验部分
1.1试剂与仪器
所有β-酮酸衍生物[9]和异氰酸酯均为已知化合物,直接购*使用或根据文献方法制备。
二氯甲烷、乙醚、乙腈、四氢呋喃、甲苯,AR,阿达马斯试剂有限公司;三氟甲磺酸锌、三氟甲磺酸钪、三氟甲磺酸铜、三氟甲磺酸钴、三氟甲磺酸镍、三氟甲磺酸铁,阿达马斯试剂有限公司。
Advance 300 MHz型核磁共振波谱仪,德国Bruker公司;ZF-6三用紫外分析仪,上海嘉鹏科技有限公司。
1.2β-酮酰胺的合成
以N-苄基-3-氧代-3-苯基丙酰胺(3aa)的合成为例。向10 mL反应管中加入3-氧代-3-苯基丙酸(1a)32.8 mg(0.2 mmol)、异氰酸苄酯(2a)41μL(0.3 mmol)、三氟甲磺酸镍7.1 mg(0.02 mmol,摩尔分数10%)、DCM 2 mL。在室温下反应24 h。反应结束后用油醚-乙酸乙酯[V(石油醚)∶V(乙酸乙酯)=5∶1]作为洗脱剂进行柱层析分离纯化旋蒸,得到白色固体3aa,产率为92%。1H NMR(300 MHz,CDCl3),δ:8.31-7.88(m,2 H),7.80-7.15(m,8H),4.64-4.43(m,2H),4.16-3.90(m,2H)。13C NMR(300MHz,CDCl3),δ:195.5,166.1,137.9,136.1,134.1,133.2,130.1,128.9,128.7,128.6,128.4,127.7,127.5,125.8,45.3,43.7。
N-苄基-3-(4-氯苯基)-3-氧代丙酰胺(3ba):淡黄色油状固体,产率为88%。1H NMR(300 MHz,CDCl3),δ:8.21-7.86(m,2H),7.61-7.05(m,7H),4.51(s,2H),4.00(s,2H)。13C NMR(300 MHz,CDCl3),δ:194.8,165.9,140.5,134.5,130.1,129.3,128.8,127.7,127.6,45.5,43.8。
N-苄基-3-(萘-2-基)-3-氧代丙酰胺(3ca):淡黄色固体,产率为83%。1H NMR(300 MHz,CDCl3),δ:8.54(s,1H),8.15-7.80(m,3H),7.70-7.49(m,2H),7.44-7.15(m,6H),4.53(s,2H),4.13(s,2H)。13C NMR(300 MHz,CDCl3),δ:195.9,166.0,138.0,136.0,133.5,132.4,131.0,129.9,129.1,128.8,128.7,127.8,127.7,127.5,127.1,123.6,45.5,43.7。
N1,N5-双苄基-3-氧代戊二酰胺(3da):淡黄色固体,产物为52%。1H NMR(300 MHz,CDCl3),δ:7.30-7.12(m,10 H),4.41(s,4H),3.39(s,4H)。13C NMR(300 MHz,CDCl3),δ:205.6,165.7,158.6,139.4,137.2,128.7,128.5,127.7,127.5,127.4,127.1,50.0,44.2,43.5,30.9。
N-环戊基-3-氧代-3-苯基丙酰胺(3ab):淡黄色油状液体,产率为65%。1H NMR(300 MHz,CDCl3),δ:8.08-7.70(m,2H),7.68-7.30(m,3H),4.38-4.12(m,1H),3.96(s,2H),2.18-1.13(m,8H)。13C NMR(300 MHz,CDCl3),δ:190.0,166.2,137.5,134.1,131.8,128.9,127.1,51.7,45.3,33.0,22.5。
2结果与讨论
使用3-氧代-3-苯基丙酸(1a)和异氰酸苄酯(2a)作为模型底物进行反应条件筛选,反应如式(1),结果见表1。由表1可知,不同种类的路易斯酸作为催化剂时,目标产物都能以较高的收率获得(序号1—6)。最终选择三氟甲磺酸钴作为的最优金属进行下一步筛选。在金属催化剂条件下发现,四氢呋喃、甲苯、乙腈、乙醚等有机溶剂下反应的产率较低(序号7-10)。以DCM为溶剂,目标产物3aa的产率最高。接下来我们对底物的用量进行了考察,当异氰酸酯过量时,反应能以更高的收率得到目标产物。而β-酮酸过量时会生成更多的脱羧副产物,反应体系较杂,收率并没有明显的提高(序号11—12)。
A.反应条件为1a(0.2 mmol),2a(0.2 mmol),催化剂用量(0.02 mmol,10%),溶剂2.0 mL,在室温下搅拌反应;B.分离产率;C.1a用量调整为0.3 mmol;D.2a用量调整为0.3 mmol。
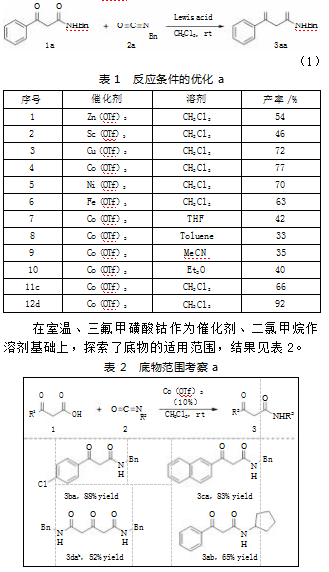
由表2可知,当β-酮酸上有对位吸电子取代基时,能与苄基异氰酸酯成功进行反应,得到的目标产物3ba产率良好(88%)。而稠环底物1c的反应产物3ca产率达到83%。值得注意的是,本文在尝试结构特殊的3-氧代戊二酸1d作为反应原料时,惊喜地发现反应仍然能发生并且以中等的收率得到目标产物3da(52%)。
在最佳条件下,除了对β-酮酸底物范围的拓展,本文还对异氰酸酯底物范围进行了考察,但异氰酸苯酯并不能参与该反应。而同样是烷基取代的异氰酸环戊酯2b则能以中等的收率发生转化,得到N-环戊基取代的β-酮酰胺产物3ab(65%)。
为了验证脱羧加成反应的可行性,本文将反应放大到克级。向50 mL圆底烧瓶中加入3-氧代戊二酸1c(10 mmol,1.46 g)、异氰酸苄酯2a(15 mmol,2.1 mL)、DCM 10 mL。在室温下反应24 h。反应结束后用石油醚-乙酸乙酯[V(石油醚)∶V(乙酸乙酯)=1∶1]作为洗脱剂进行柱层析分离纯化旋蒸,得到黄色油状固体3da,产率为60%。
3结论
本文首次实现了在室温下,以β-酮酸和异氰酸酯为原料,路易斯酸作催化剂,以二氯甲烷为溶剂,通过脱羧-亲核加成反应成功合成了一系列结构新颖的β-酮酰胺产物。在最优条件下最高产率可达92%。反应可放大到克级,底物适用范围较广,芳基、烷基底物均能在反应体系下兼容。该方法具有成本低廉,方法简单快捷,反应条件温和等优势。
参考文献
[1]Valeur E,Bradley M.Amide bond formation:beyond the myth of cou-pling reagents[J].Chem.Soc.Rev.2009,38:606-631.
[2]Pattabiraman V,Bode J,Rethinking amide bond synthesis[J].Nature,2011,480:471-479.
[3]Roughley S D,Jordan A M.The medicinal chemist’s toolbox:an anal-ysis of reactions used in the pursuit of drug candidates[J].J.Med.Chem.,2011,54:3451-3479.
[4]Dunetz J R,Magano J,Weisenburger G A.Large-scale applications of amide coupling reagents for the synthesis of pharmaceuticals[J].Org.Process Res.Dev.2016,20:140-177.
[5]Albericio F,El-Faham A.Choosing the right coupling reagent for peptides:A twenty-five-year journey[J].Org.Process Res.Dev.,2018,22:760-772.
[6]Serrano E,Martin R.Forging amides through metal-catalyzed c-c coupling with isocyanates[J].Eur.J.Org.Chem.2018,35:3051-3064.
[7]Muraoka T,Matsuda I,Itoh K.Rhodium-catalyzed formal hydrocar-bamoylation toward anα,β-unsaturated carbonyl compound using aryl isocyanate and hydrosilane[J].Organometallics 2001,20:4676-4682.
[8]Nakamura S.Catalytic enantioselective decarboxylative reactions using organocatalysts[J].Org.Biomol.Chem.,2014,12:394-405.
[9]Evans D A,Mito S,Seidel D.Scope and Mechanism of enantioselective michael additions of 1,3-dicarbonyl compounds to Nitroalkenes cat-alyzed by nickel(II)-diamine complexes[J].J.Am.Chem.Soc.2007,129:11583-11592.










