苦豆子乙醇部位生物碱的同步测定及其指纹图谱的构建论文
2025-10-29 11:00:46 来源: 作者:xuling
摘要:本实验建立的苦豆子乙醇部位生物碱含量测定的HPLC法,准确度高,稳定性好,构建的指纹图谱可用于苦豆子的质量评价。
摘要:目的:建立苦豆子乙醇部位HPLC指纹图谱及其生物碱含量同步测定的方法,为苦豆子质量控制提供实验依据。方法:建立同时测定金雀花碱、槐定碱、氧化苦参碱含量的HPLC法,并进行方法学验证,同时建立11批苦豆子乙醇部位指纹图谱,通过“2012版中药色谱指纹图谱相似度评价系统”分析不同批次间的相似度。结果:金雀花碱、槐定碱、氧化苦参碱分别在83~500、50~300、135~800μg/mL范围内,线性关系良好(R2≥0.999 2);精密度、重复性、稳定性RSD值均<2%,平均加标回收率在96%~100%,RSD值<2%,符合要求;测得11批苦豆子中金雀花碱、槐定碱、氧化苦参碱含量范围分别为1.85~2.99、2.21~4.85、3.22~10.65 mg/g。11批苦豆子乙醇部位HPLC指纹图谱共匹配出21个共有峰,指认出1号峰为金雀花碱、4号峰为槐定碱、8号峰为氧化苦参碱。通过相似度软件计算,S2—S11和对照指纹图谱的相似度范围为0.921~0.992,相似度较高,S1和对照指纹图谱对比,相似度较低,为0.85。结论:本实验建立的苦豆子乙醇部位生物碱含量测定的HPLC法,准确度高,稳定性好,构建的指纹图谱可用于苦豆子的质量评价。
关键词:苦豆子;乙醇部位;生物碱;指纹图谱
苦豆子(sophora alopecuroides L.)系豆科(legum-inosae)槐属(sophora linn)植物,因其根形似甘草,味苦又得名苦甘草,维吾尔用药中习称“布亚”[1]。苦豆子耐旱耐碱,我国主要分布于新疆、内蒙古、宁夏、甘肃等西北一带[2]。苦豆子始载于《神农本草经》,能安五脏,定志益精[3]。苦豆子全草皆可药用,含有生物碱、黄酮、挥发油等丰富次生代谢产物,其中生物碱含量最高[4-5],有抗菌[6]、抗炎[7]、保肝[8]、抗癌[9]等药理作用。通过查阅相关文献发现已有学者采用HPLC法测定苦豆子中生物碱,但由于各实验室环境差异及操作人员不同等因素,测定出的结果也不尽相同,因此需建立适用于本实验室条件的方法,为此本实验通过乙醇超声提取法提取其中总生物碱,建立HPLC法同时测定其中金雀花碱、槐定碱及氧化苦参碱,同时建立11批苦豆子乙醇部位指纹图谱,为苦豆子药材的合理利用提供实验依据。
1实验内容
1.1仪器、试剂与药材
高效液相色谱仪,LC-16,岛津;数控超声波清洗器,KQ500DE,频率40 KHz;旋转蒸发仪,R-1001VN;十万分之一电子天平,MS205DU;高速多功能粉碎机,JS-500A。
无水乙醇(AR);甲醇(GR);乙腈(GR);浓盐酸(AR);磷酸二氢钾(AR);三乙胺(AR);娃哈哈纯净水;金雀花碱,HPLC≥98.0,批号:DSTDJ002601,德斯特;槐定碱,HPLC≥98.0,批号:DSTDH001203,德斯特;氧化苦参碱,纯度≥98.0,批号:10260,诗丹德。
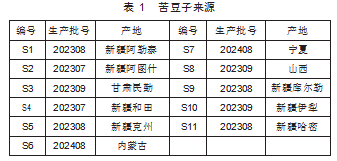
苦豆子来源见表1。
1.2溶液的制备
1.2.1混合对照品溶液的制备
分别精密称取对照品:金雀花碱0.012 60 g、槐定碱0.005 20 g、氧化苦参碱0.015 10 g,分别置于5 mL量瓶中,甲醇溶解并定容至刻度,得质量浓度分别为2 500、1 000、3 000μg/mL的对照品溶液。
将上对照品溶液分别加甲醇稀释成质量浓度为1 500、900、2 400μg/mL的溶液,再分别吸取200μL混匀,制备成质量浓度分别为500、300、800μg/mL的混合对照品溶液,2~8℃保存,备用。
1.2.2样品溶液的制备
称取苦豆子粉末约2 g,置于100 mL具塞锥形瓶中,加65%乙醇60 mL,30℃、500 W超声30 min,重复提取3次,2 000 r/min离心2 min,合并上清液,减压浓缩至无醇味,将浓缩液转移至100 mL量瓶中,甲醇定容至刻度,过膜,备用。
1.3色谱条件
岛津LC-16型高效液相色谱仪,SPD检测器,色谱柱Shim-Pack GIST C18(150 mm×4.6 mm,5μm),流动相为乙腈:0.05 mol/L KH2PO4(A)-0.05 mol/L KH2PO4(2 mL/L三乙胺)(B),梯度洗脱(0~4 min 92.8%B;4~7 min 92.8%~90.8%B;7~10 min 90.8%~90%B;10~15 min 90%~82%B;1 520 min 82%~75%B;20~30 min 75%~72%B;30~50 min 72%~57%B;50~55 min 57%~43%B),检测波长为210 nm,柱温为30℃,流速为1.0 mL/min,进样量为10μL。
1.4方法学考察
1.4.1专属性考察
分别取混合对照品溶液、样品溶液和阴性对照溶液(甲醇)适量,按“1.3”项下色谱条件进样分析,记录色谱图。
1.4.2线性与范围
分别吸取混合对照品溶液100、200、300、400、500μL,置于5个5 mLEP管中,分别加甲醇至600μL,得质量浓度为83、167、250、333、417μg/mL的系列金雀花碱对照品溶液;质量浓度为50、100、150、200、250μg/mL的系列槐定碱对照品溶液;质量浓度为135、268、401、534、667μg/mL的系列氧化苦参碱对照品溶液。按“1.3”项下色谱条件进样分析,记录峰面积。以系列对照品溶液质量浓度(ρ)为横坐标,峰面积(A)为纵坐标,绘制标准曲线,得线性回归方程和相关系数。
1.4.3精密度考察
取苦豆子样品(S11),制备样品溶液,根据“1.3”项下色谱条件连续进样6次,记录峰面积并计算RSD值。
1.4.4重复性考察
取苦豆子样品(S11),分别制备6份样品溶液,根据“1.3”项下色谱条件进样分析,记录峰面积并计算RSD值。
1.4.5稳定性考察
取苦豆子样品(S11),制备样品溶液,在室温下分别放置0、2、4、6、8、10、12、24、48 h后,根据“1.3”项下色谱条件进样分析,记录峰面积并计算RSD值。
1.4.6加标回收率考察
称取已知含量的苦豆子样品(S11)粉末约2 g,共6份,制备样品溶液,转移至100 mL量瓶中,定容前按照对照品量与样品中所含成分比例约为1∶1加入对照品,用甲醇定容至刻度,混匀,按“1.3”项下色谱条件进样分析,记录峰面积,将峰面积代入线性回归方程,分别计算金雀花碱、槐定碱、氧化苦参碱的含量,按照公式(1)求加标回收率,并计算RSD值。

式中:m加标后为加入对照品后测得值,mg;m加标前为加入对照品前测得值,mg;m对照品为对照品加入量,mg。
1.5苦豆子中生物碱的同步测定
取11批苦豆子样品,分别制备样品溶液,根据“1.3”项下色谱条件进样分析,记录峰面积,代入线性回归方程,计算各批苦豆子中金雀花碱、槐定碱及氧化苦参碱的含量。
1.6指纹图谱的构建
根据《中药指纹图谱研究技术》[10]要求,在最佳色谱条件下分别进样混合对照品溶液及11批样品溶液,记录色谱图。
2结果与讨论
2.1方法学考察结果
2.1.1专属性
按“1.4.1”项下操作,记录色谱图(图1)。
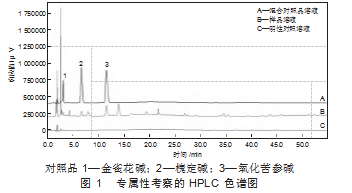
由图1知,样品溶液中金雀花碱、槐定碱、氧化苦参碱保留时间分别为3.07、6.42、11.58 min,与混合对照品保留时间一致,且阴性对照溶液无干扰,说明此方法专属性良好。
2.1.2线性与范围
按“1.4.2”项下操作,记录峰面积(A),制作标准曲线(表2)。
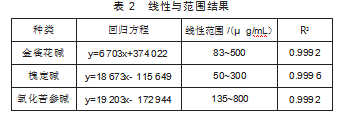
由表1知,金雀花碱、槐定碱、氧化苦参碱分别在83~500、50~300、135~800μg/mL质量浓度范围内,线性关系良好(R2≥0.999 2)。
2.1.3精密度
按“1.4.3”项下操作,记录峰面积(A),计算RSD值(表3)。
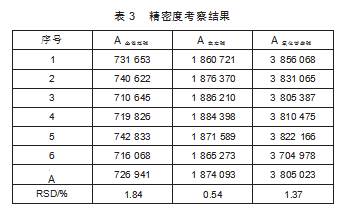
由表3知,精密度RSD值均小于2%,说明实验所用仪器精密度良好。
2.1.4重复性考察
按“1.4.4”项下操作,记录峰面积(A),计算RSD值(表4)。
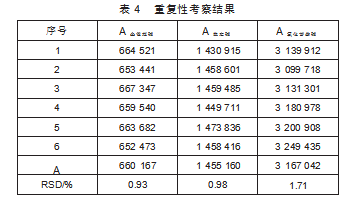
由表4知,重复性的RSD值均小于2%,说明实验重复性良好。
2.1.5稳定性考察
按“1.4.5”项下操作,记录峰面积(A),计算RSD值(表5)。
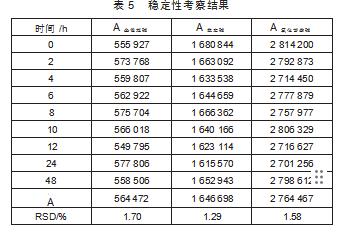
由表5知,稳定性RSD值均小于2%,说明3种生物碱在48 h内稳定性良好。
2.1.6加标回收率考察
按“1.4.6”项下操作,记录峰面积(A),计算RSD值(表6)。
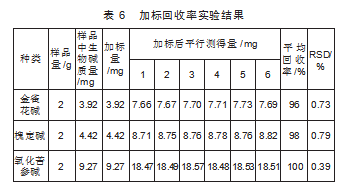
由表6知,3种生物碱的加标回收率均在96%~100%之间,RSD值均小于2%,说明方法准确度符合要求。
2.2苦豆子生物碱含量的同步测定
按“1.5”项下操作,计算各批苦豆子中生物碱含量(表7)。
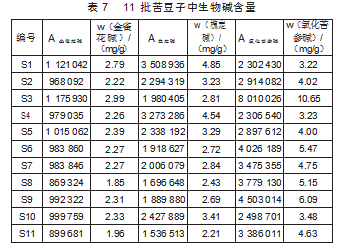
由表7知,甘肃产苦豆子中金雀花碱、氧化苦参碱明显高于其他产地,阿勒泰产苦豆子中苦参碱明显高于其他产地。
2.3指纹图谱研究
2.3.1指纹图谱构建
根据《中药指纹图谱研究技术》[10]要求,在最佳色谱条件下分别进样混合对照品溶液、11批样品溶液(编号同表1)、阴性对照溶液,记录HPLC色谱图(图1)。采用“中药色谱指纹图谱相似度评价系统”软件,以1号样品的色谱图为参照图谱,通过多点校正,自动匹配,以中位数法,生成苦豆子乙醇部位共有模式的对照指纹图谱,确定21个共有峰,可以构成指纹图谱的稳定的特征峰(图2)。通过与对照品图谱比对,指认1号峰为金雀花碱、4号峰为槐定碱、8号峰为氧化苦参碱。9号峰的峰面积最大且峰形稳定,将其设为参照峰(S)。将各色谱图中共有峰的保留时间与同一图谱中参照物峰的保留时间比较,计算各共有峰的相对保留时间,11批苦豆子的相对保留时间的RSD<2%,符合指纹图谱要求。
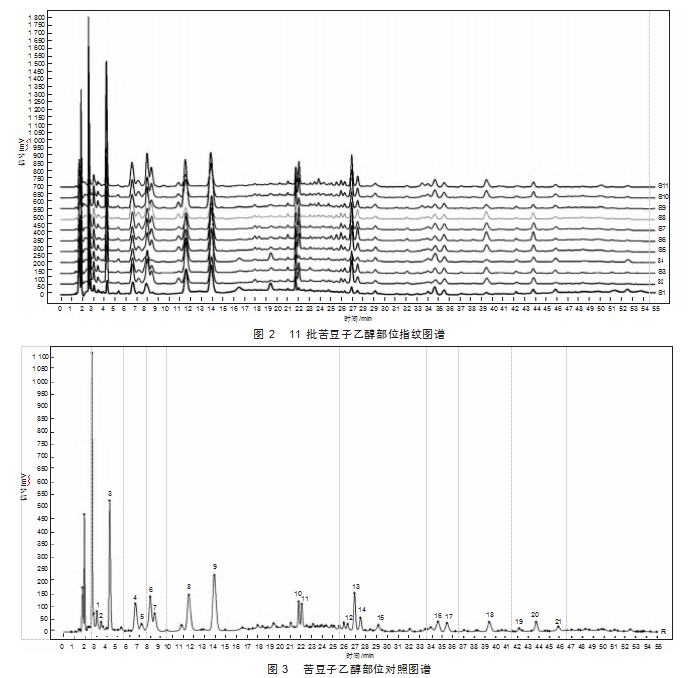
2.3.2共有峰和非共有峰的峰面积
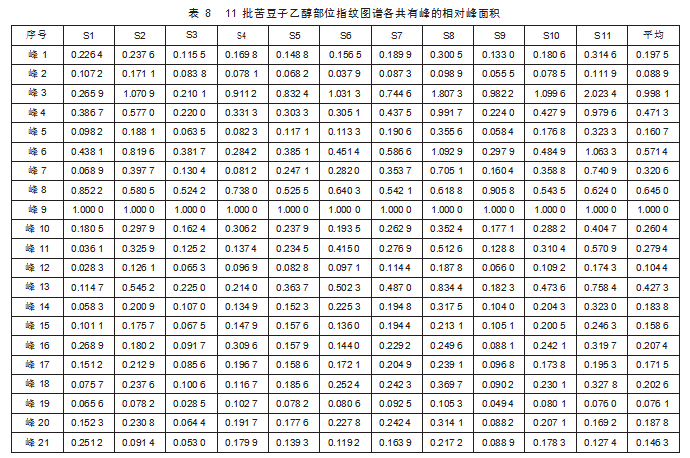
根据《中药指纹图谱研究技术》要求,中药材的供试品图谱中各共有峰面积的比值与指纹图谱各共有峰面积的比值比较,单峰面积占总峰面积≥20%的共有峰,其差值不得大于±20%;单峰面积占总峰面积≥10%,而小于20%的共有峰,其差值不得大于±25%;单峰面积占总峰面积<10%的共有峰,峰面积比值不作要求,但必须标定相对保留时间。苦豆子乙醇部位指纹图谱中3、8、9号峰占总峰面积的百分比分别为13.28%、10.89%和16.63%,其差值小于±25%,其他峰的单峰面积占总峰面积的百分比均小于10%。以9号峰为参照峰(S),计算其他各共有峰的相对峰面积(表8)。11批苦豆子乙醇部位指纹图谱各非共有峰面积占总峰面积百分比在4.66%~8.79%之间,小于10%,符合指纹图谱研究规定(表9)。
2.3.3 11批苦豆子乙醇部位指纹图谱相似度评价
采用“中药色谱指纹图谱相似度评价系统2012版”软件,设定1号指纹图谱为参照图谱,利用中位数法,设定保留时间误差在0.5min以内,对11批苦豆子乙醇部位指纹图谱进行相似度分析(表9)。
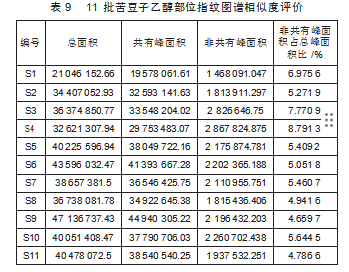
从表9知,S2—S11和对照指纹图谱的相似度范围为0.921~0.992,相似度较高,S1和对照指纹图谱对比,相似度较低,为0.85。
3讨论
在样品提取方法考察时,比较了不同提取溶剂(乙醇、三氯甲烷、乙酸乙酯)对样品指纹图谱的影响:
三氯甲烷提取时,色谱峰响应度最高,但色谱峰较少,且三氯甲烷毒性较大;乙醇提取时,色谱峰响应度低于三氯甲烷但高于乙酸乙酯,且指纹图谱色谱峰最多,因此,选择乙醇为提取溶剂。
本实验建立了一种快速、稳定的苦豆子质量评价和生物碱含量测定的方法,依据苦豆子乙醇部位指纹图谱,确定了21个共有峰,指认出3种生物碱,其余19个共有峰有待通过HPLC-MS/MS等手段进一步分析。同时测定了3种生物碱的含量,发现各产地间差异较大,可能与气候和采摘时间有关。后期还可以建立指纹图谱与药效之间的“谱-效”关系,明确质量标志物,确定反映苦豆子内在质量的评价方法。
参考文献
[1]宋萍,邓士豪,洪喜莲,等.苦豆子化学成分研究[J].华中师范大学学报(自然科学版),2023,57(3):386-392.
[2]苏永霞,郭蓉,李国中,等.苦豆子抗炎及资源化利用研究进展[J].中国野生植物资源,2020,29(10):67-73.
[3]Wang R Z,Deng Xx,Gao Qx,et al.Sophora alopecuroides L.An ethnopharmacological,phytochemical,and pharmacological review[J].J Ethnopharmacol,2020,248:112-172.
[4]李芳,刘学楠,魏彦明,等.苦豆子不同提取物的化学成分分析[J].中华中医药学刊,2023,41(12):45-52.
[5]李会玲,黄红艳,张路敏,等.苦豆子中黄酮类物质提取工艺优化及其体外生物活性研究[J].中国酿造,2022,41(2):216-221.
[6]王维,戴碧珊,梁玉梅.苦豆子总碱GC-MS分析及幽门螺杆菌抑菌活性实验研究[J].辽宁中医杂志,2024,51(12):136-141.
[7]李芳,白珊泽,牛淳,等.苦豆子对脂多糖诱导的RAW 264.7细胞炎症的抗炎作用和机制研究[J].天然产物研究与开发,2023,35(3):387-396.
[8]张东,董佳妮,谢华祎,等.苦豆子总碱对大鼠慢性酒精性肝损伤的保护作用研究[J].中国民族民间医药,2022,31(21):24-28.
[9]刘伟婷.基于分子印迹及分子对接双策略技术研究苦豆子中抗肿瘤活性成分[D].南昌:江西中医药大学,2019.
[10]周玉新,雷海明.中药指纹图谱研究技术[M]北京:化学工业出版社,2002:131.










