地榆不同溶剂提取物体外抗菌活性研究论文
2025-10-16 16:09:50 来源: 作者:xuling
摘要:以地榆乙醇、乙酸乙酯、石油醚提取物作为研究对象,对其进行抗菌活性的评价。以没食子酸作为对照品制作标准曲线,测定不用提取物中没食子酸的含量。
摘要:以地榆乙醇、乙酸乙酯、石油醚提取物作为研究对象,对其进行抗菌活性的评价。以没食子酸作为对照品制作标准曲线,测定不用提取物中没食子酸的含量。采用牛津杯法、二倍稀释法,测定最小抑菌浓度(MIC)、最小杀菌浓度(MBC),考察对大肠杆菌、金黄色葡萄球菌抗菌活性。乙醇、乙酸乙酯、石油醚溶剂提取物,浸膏得率分别是17.4%、47%、32.2%。标准曲线回归方程为Y=82.69X+0.072 4,R2=0.995,质量浓度在1.0~10.0μg/mL范围内,线性关系良好。乙醇、乙酸乙酯溶剂提取物对大肠杆菌、金黄色葡萄球菌表现出较强的抑菌效果,该方法简单可行,为后期地榆中成药的研发提供理论依据。
关键词:地榆;不同溶剂提取物;抗菌
地榆为蔷薇科植物地榆(Sanguisorba officinalis L.)或长叶地榆(Sanguisorba officinalis L.var.longifolia(Bert.)Yüet Li)的干燥根。归肝、大肠经,有凉血止血,解毒敛疮的功效。用于便血、痔血、血痢、崩漏、水火烫伤、痈肿疮毒[1]。地榆含有有鞣质类[2]、酚酸类[3]、黄酮类[4]、多糖类[5]及三萜类[6]等多种化学成分,具有抗菌[7]、抗肿瘤[8]、抗过敏[9]、抗炎[10]、止泻[11]、抗氧化[12]的作用。本实验以地榆提取物浸膏得率为评价指标,制备地榆提取物,以大肠杆菌和金黄色葡萄球菌为例,测定其最小抑菌浓度(MIC)和最小杀菌浓度(MBC),旨在为进一步制剂研发和临床应用提供科学依据,为临床治疗金黄色葡萄球菌与大肠杆菌所致疾病提供新的研究思路。
1实验内容
1.1仪器与试剂
干燥药材地榆,康美中药城;标准品没食子酸,上海源叶生物科技有限公司;乙醇,福晨化学试剂有限公司;乙酸乙酯,福晨化学试剂有限公司;石油醚,福晨化学试剂有限公司;无水碳酸钠,上海源叶生物科技有限公司;钨酸钠,天津市北联精细化学品开发有限公司。
紫外分光光度计,UV-19001,岛津仪器苏州有限公司;恒温水浴锅,HH-2,常州苏璃仪器有限公司;多功能粉碎机,DE-1000gB,浙江红景天工贸有限公司;电热恒温培养,HPX-9082MBE,上海博讯实业有限公司;净化工作台,CJ-2D,天津市泰斯特仪器有限公司。
1.2实验方法
1.2.1提取方法的确定
以乙醇作为溶剂,采用三种不同提取方法,根据浸膏得率的高低,确定提取方法。得率计算公式如式(1):

式中:Y浸膏为浸膏得率,%;m浸膏为浸膏质量,g;m药材为药材质量,g。
1)超声提取法:称取地榆粉末5 g,置于100 mL圆底烧瓶中,加入乙醇60 mL,浸渍1 h,超声提取2次,一次75 min,抽滤,合并两次提取液,浓缩至25 mL,蒸干,得粉末,备用。
2)煎煮法:称取地榆粉末5 g,置于100 mL圆底烧瓶中,加入乙醇60 mL,密封浸渍24 h,待乙醇溶液完全浸润地榆粉后,煎煮至沸腾,沸腾后继续煎煮1 h,抽滤,连续煎煮两次,合并两次提取液,浓缩至25 mL,蒸干,得粉末,备用。
3)回流提取法:称取地榆粉末5 g,置于200 mL圆底烧瓶中,加入乙醇150 mL,用恒温水浴锅进行加热回流提取,提取温度75℃,提取2次,每次1 h,抽滤,合并两次提取液,浓缩至25 mL,蒸干,得粉末,备用。
1.2.2不同溶剂提取物的制备
1)乙醇提取物制备:称取地榆粉末35 g,置于1 000 mL圆底烧瓶中,加入乙醇溶液875 mL,加热回流提取,温度75℃,提取2次,每次提取时间1 h,减压抽滤,合并两次提取液,浓缩至45 mL,蒸干,得粉末,备用。
2)乙酸乙酯提取物制备:称取地榆粉末35 g,置于1 000 mL圆底烧瓶中,加入乙酸乙酯875 mL,加热回流提取,提取温度70℃,提取2次,每次提取时间1 h,减压抽滤,合并两次提取液,浓缩至45 mL,蒸干,得粉末,备用。
3)石油醚提取物制备:称取地榆粉末35 g,置于1 000 mL圆底烧瓶中,加入石油醚875 mL,加热回流提取,提取温度60℃,提取2次,每次提取时间1 h,抽滤,合并两次提取液,浓缩至45 mL,蒸干,得粉末,备用。
1.2.3标准曲线的制作
1.2.3.1最大吸收波长的确定
精密吸取没食子酸对照品溶液0.5 mL,放置于25 mL棕色容量瓶中,加入磷铝钨酸试液1 mL,再加入蒸馏水11.5 mL,以质量分数29%碳酸钠溶液稀释至刻度,摇匀,放置30 min。以磷铝钨酸试液1 mL,蒸馏水12 mL,用29%碳酸钠溶液稀释至刻度为空白,于200~800 nm波长范围内扫描。
1.2.3.2线性关系考察
精密吸取对照品溶液0.5、1.0、2.0、3.0、4.0、5.0 mL,分别放置于25 mL棕色容量瓶中,分别加入磷铝钨酸试液1 mL,再分别加入蒸馏水11.5、11.0、10.0、9.0、8.0、7.0 mL,用质量分数29%碳酸钠溶液稀释至刻度摇匀,放置30 min。以磷铝钨酸试液1 mL,蒸馏水12 mL,用质量分数29%碳酸钠溶液稀释至刻度为空白。在761 nm波长处测定吸光度。以吸光度(Y)为纵坐标,浓度(X)为横坐标,绘制标准曲线。
1.2.4测定没食子酸的含量
用0.45μm的微孔滤膜将3种提取物过滤,置于10 mL容量瓶中,加入蒸馏水稀释至刻度摇匀,在761 nm处,测定吸光度。根据1.2.3得到的没食子酸标准曲线,计算没食子酸的质量分数。公式如式(2):

式中:ρ为样品溶液中没食子酸的质量浓度,μg/mL;n为样品溶液的稀释倍数;m为样品质量,g;V为样品溶液的体积,mL。
1.2.5抑菌实验
抑菌实验部分,每次抑菌实验需对镊子、牛津杯、枪头、涂布器、无菌离心管、蒸馏水等实验材料于121℃下高压灭菌1.5 h,备用。
1.2.5.1样品的制备
1)待测物的制备:分别用分析天平称量地榆乙醇、乙酸乙酯、石油醚粗提物1.00、0.1、0.01、0.001 g,放置于10 mL棕色容量瓶中,再分别用50%乙醇、石油醚定容至刻度摇匀,分别制得0.1、0.01、0.001、0.000 1 g/mL的提取物溶液,备用。
2)对照品的制备:用分析天平称量没食子酸对照品0.1、0.01、0.001 mg,放置于10 mL棕色容量瓶中用已高压蒸汽灭菌蒸馏水定容至刻度摇匀,制得0.01、0.001、0.000 1 mg/mL的溶液,备用。
1.2.5.2培养基的制备
先称取36 gM-H琼脂粉加入到锥形瓶后,再加入已高压蒸汽灭菌蒸馏水1 000 mL,放置于121℃下高压灭菌1.5 h,冷却15 min。
1.2.5.3培养平板的制备
在洁净工作台中,趁热将已灭过菌的培养液倒入培养皿中,依次向50个培养皿中倒入培养液,等待3 h凝固后备用。
1.2.5.4菌种活化
在洁净工作台中,用灭菌后的接种环将大肠杆菌、金黄色葡萄球菌,分别接种于营养琼脂培养基中,放置于37℃恒温培养箱中培养24 h,再使用灭菌后的接种环分别挑取大肠杆菌、金黄色葡萄球菌,分别接种于无菌肉汤中,放置于37℃恒温培养箱中培养24 h。
1.2.5.5菌液制备
将1.2.5.4活化的菌株分别移取1 mL,加入氯化钠9 mL,制成菌悬液,然后依次进行稀释使菌株浓度达到107 CFU/mL,备用。
1.2.5.6抑菌活性实验
1.2.5.6.1初步测定抗菌活性
1)标准品测定抗菌活性:抗菌活性的测定采用牛津杯法。取制备好的培养平板,吸取200μL菌悬液加入其中,用涂布器把菌液均匀涂布,制成带菌平皿,用无菌镊子夹取已高压蒸汽灭菌的牛津杯,轻轻平置于已涂布菌液的培养皿表面,每个培养皿划分4部分放置4个牛津杯,用无菌移液枪分别移取200μL标准品到牛津杯中,将培养皿缓慢移入恒温培养箱,37℃培养24 h。
2)不同提取物测定抗菌活性:抗菌活性的测定采用牛津杯法。取制备好的培养平板,吸取200μL菌悬液加入其中,用涂布器把菌液均匀涂布,制成带菌平皿,用无菌镊子夹取已高压蒸汽灭菌的牛津杯,轻轻平置于已涂布菌液的培养皿表面,每个培养皿划分5部分放置6个牛津杯,用无菌移液枪分别移取200μL提取液到牛津杯中,将培养皿缓慢移入恒温培养箱,37℃培养24 h。
抗菌实验判断标准:取出培养24 h后的平板,观察各平板牛津杯附近有无抑菌圈,并通过测量抑菌圈的直径作为评判标准,当抑菌圈的直径大于20 mm代表高度敏感,抑菌圈直径在15~20 mm之间代表中度敏感,抑菌圈直径小于15 mm为低度敏感,无抑菌圈代表不敏感。
1.2.5.6.2最小抑菌浓度实验
最小抑菌浓度(MIC)的测定采用二倍稀释法。将0.10 g/mL粗提液分别稀释成质量浓度为100、50、25、12.5、6.25、3.13、1.56、0.78、0.39、0.19 mg/mL,分别量取1 mL置于2 mL的营养肉汤无菌离心管中,再加入稀释好的菌悬液200μL,于37℃恒温箱中培养12 h。将离心管逐一对光观察,以肉眼可见澄清、透明的最低浓度判为最低抑菌浓度(MIC)。
1.2.5.6.3最小杀菌浓度实验
无菌操作下,从无肉眼可见澄清、透明的无菌离心管中接种于M-H平板上,经37℃培养18~24 h后观察,最小杀菌浓度(MBC)为菌落数小于5个的最小稀释度。
1.2.6化学成分鉴别实验
分别取乙醇、乙酸乙酯、石油醚提取物检查皂苷类、多糖类黄酮类、鞣质类化学成分。
2实验结果
2.1确定提取方法
采用煎煮法、加热回流法、超声提取法三种提取方法对地榆进行提取,通过公式(1)计算浸膏得率,结果如表1所示,表明浸膏得率高低顺序为:加热回流法>超声提取法>煎煮法,因此确定提取方法是加热回流法。
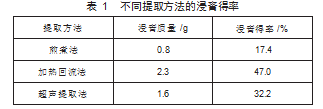
2.2不同溶剂提取物的制备
分别选用乙醇、乙酸乙酯、石油醚三种溶剂,用加热回流法对地榆进行提取得到浸膏,三种浸膏得率结果如表2所示。结果表明,乙醇提取物浸膏得率最高,浸膏得率为40.61%。
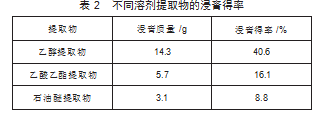
2.3标准曲线的绘制
2.3.1最大吸收波长的确定
参照1.2.3.2项下的方法操作,在200~800 nm波长范围内扫描全波长,测得最大吸收波长为761 nm。
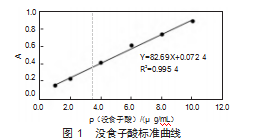
2.3.2线性关系考察
参照1.2.3.2项下的方法操作,经线性回归,结果见图1。得回归方程为Y=82.69X+0.072 4,R2=0.995。结果表明,1.0~10.0μg/mL范围内,线性关系良好。
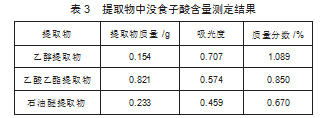
2.4测定没食子酸的含量
参照1.2.4项下测定不同溶剂提取物中没食子酸的质量分数通过公式(2)计算。结果由表3所示,乙醇溶剂提取的没食子酸含量较高。
2.5抑菌实验
2.5.1初步评价抗菌活性
2.5.1.1标准品的抗菌实验
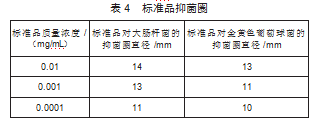
参照1.2.5.1项下的方法操作,可得到不同浓度的标准品抑菌圈。测量抑菌圈,根据判断标准评价效果,由表4所示,0.01 mg/mL抗菌能力最强。
2.5.1.2不同提取物的抗菌实验
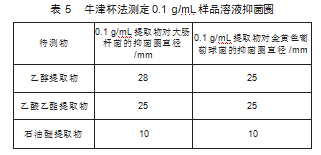
1)参照1.2.5.1项下的方法操作,可以得到不同溶剂提取物的抑菌圈,结果如表5所示,乙醇提取物表现出最强的抗菌效果。
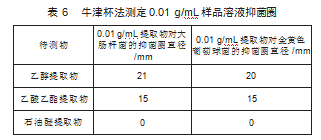
2)参照1.2.5.1项下的方法操作,可得到不同溶剂提取物的抑菌圈,结果如表6所示,乙醇提取物对0.01 g/mL的大肠杆菌、金黄色葡萄球菌抗菌效果非常显著。
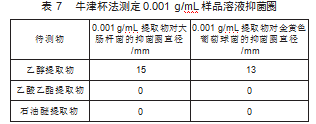
3)参照1.2.5.1项下的方法操作,可得到不同溶剂提取物的抑菌圈直径,结果如表7所示,乙醇提取物对0.001 g/mL的大肠杆菌、金黄色葡萄球菌有抗菌效果。
2.5.2最小抑菌浓度测定
参照1.2.5.3项下的方法操作,分别对大肠杆菌、金黄色葡萄球菌最小抑菌浓度进行实验测定,结果如表8所示,乙醇提取物对大肠杆菌、金黄色葡萄球菌MIC值分别是0.39、0.78 mg/mL。
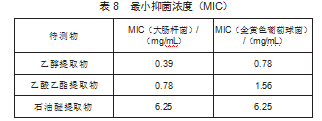
2.5.3最小杀菌浓度测定
参照1.2.5.3项下的方法操,分别对大肠杆菌、金黄色葡萄球菌最小杀菌浓度进行实验测定,结果如表9所示,乙醇提取物对大肠杆菌、金黄色葡萄球菌MBC值分别是0.19、0.39 mg/mL。
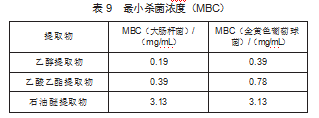
2.6化学成分鉴别
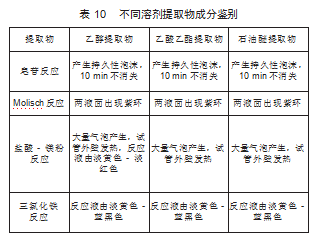
对3种提取物进行理化鉴别,结果如表10所示。结果表明,3种提取物中皂苷、Molisch、三氯化铁反应都呈阳性,盐酸镁粉反应乙醇提取物呈阳性。
3结论
选用超声提取法、加热回流法、煎煮法以浸膏得率为评价依据,结果表明,3种不同提取方法的浸膏得率分别为17.4%、47%、32.2%。测定不同溶剂地榆提取物对大肠杆菌、金黄色葡萄球菌的抑菌作用,以抑菌圈直径为评价依据,结果表明,乙醇提取物抗菌效果较好。测定不同溶剂地榆提取物的最小抑菌浓度(MIC)、最小杀菌浓度(MBC),结果表明,大肠杆菌和金黄色葡萄球菌乙醇地榆提取物的抑菌效果最明显。为进一步地榆乙醇溶剂提取物进行分离纯化测定抑菌活性提供参考依据。
参考文献
[1]国家药典委员会.《中国药典》(一部)[M].北京:中国医药科技出版社,2020.
[2]吴龙龙,徐昊阳,张刘强,等.地榆化学成分及药理作用研究进展[J].世界科学技术-中医药现化,2022,24(1):360-378.
[3]王泽宇,王丽娜,邱玲,等.2017.地榆中酚酸类化学成分的分离与鉴定[J].中国实验方剂学杂志,2017(8):82-85.
[4]程东亮,曹小平,邹佩秀,等.1995.中药地榆黄酮等成分的分离与鉴定[J].中草药,1995(11):570-571.
[5]陈凯立.地榆多糖的分离纯化及性能研究[D].吉林:北华大学,2016.
[6]张培元,赵焕新,白虹.地榆中三萜及其皂苷类成分的化学结构和核磁波谱特征[J].齐鲁药事,2001(3):42-45.
[7]贺涛涛.地榆提取物制备工艺及抑菌作用研究[D].陕西:西北农林科技大学,2020.
[8]韩康,包永睿,王帅,等.中药地榆对肝癌HepG2细胞的抑制作用及机制研究[J].辽宁中医药大学学报,2019,21(5):30-32.
[9]黄丽,冯志臣,韦保耀,等.地榆与桂枝抗过敏作用的研究[J].食品科技,2007(6):135-138.
[10]耿玲,杨国堂,张旭强,等.紫地榆提取物对慢性溃疡性结肠炎大鼠的治疗作用[J].中药新药与临床药理,2019,30(6):653-658.
[11]曾万玲,宋杰云,岑燕飞,等.地榆水煎液抗实验性腹泻及其他药理作用研究[J].贵阳中医学院学报,1992(4):55-57.
[12]王森业,殷博迪,王玉宁,等.不同方法提取地榆总三萜含量的比较及其抗氧化活性研究[J].食品研究与开发,2019,40(6):111-115.










