一次性使用注射器用活塞的生物相容性评估论文
2025-04-29 15:52:24 来源: 作者:xuling
摘要:文章参考YY/T 0243-2016《一次性使用注射器用活塞》,对6种一次性使用注射器用活塞的热原、溶血与急性全身毒性等生物相容性项目展开测评,以期为其安全性提供依据。
摘要:文章参考YY/T 0243-2016《一次性使用注射器用活塞》,对6种一次性使用注射器用活塞的热原、溶血与急性全身毒性等生物相容性项目展开测评,以期为其安全性提供依据。结果显示,6种一次性使用注射器用活塞在热原、溶血、急性毒性方面均符合规定,表明6种一次性使用注射器用活塞均具有良好的生物相容性。
关键词:一次性使用注射器用活塞;生物相容性;实验动物
一次性使用注射器是目前我国临床上使用广泛的Ⅲ类医疗器械,在使用时会与人体血液直接接触,发生复杂的反应过程。因此,其安全性受到了监管部门的重视[1]。一次性使用注射器用活塞作为注射器中的重要配件,因其制作过程中会引入各类辅助剂及所用原辅料中未脱除完全的残量杂质,需要充分评估其潜在的生物相容性风险[2]。热原试验、溶血试验以及急性毒性试验作为重要的生物相容性评价方法,得到了广泛应用。药品使用,尤其是注射剂中,必须严格控制热原。因此,一次性使用注射器用活塞的热原也应进行评价。在溶血试验中,血浆血红蛋白量升高,提示红细胞膜在与器械的接触中会因某种因素出现破裂,且可用溶血率评价其破裂程度;急性毒性试验则可通过观察急性期内实验动物的毒性反应和死亡情况,判定其生物相容性。本文依据行业标准YY/T 0243-2016[3]《一次性使用注射器用活塞》,对3家企业送检的6种一次性使用注射器用活塞进行了热原、溶血和急性全身毒性试验,以评价其生物相容性,为一次性使用注射器用活塞的质量控制提供参考。
1材料与方法
1.1实验材料
1.1.1供试品
一次性使用无菌注射器用活塞1 mL,一次性使用无菌注射器用活塞5 mL,分别由3个厂家生产提供(记为A、B、C厂),共6批。供试品编号分别记为A 1、B1、C1和A 5、B5、C5。
1.1.2材料、试剂
氯化钠注射液:批号S200229E22,济民健康管理股份有限公司;乙醇:批号20200316,永华化学股份有限公司;一次性使用无菌注射器1 mL(带针):批号20201221,浙江灵洋医疗器械有限公司;一次性使用无菌注射器5 mL(带针):批号190511,浙江灵洋医疗器械有限公司;白凡士林:批号200701,南昌华鑫医药化工有限公司。
1.1.3实验动物
新西兰兔,雌性无孕,体重大于1.7 kg;SPF级小鼠,雌雄各半,体重18~22 g,均由杭州医学院实验动物中心提供。实验动物生产许可证号:SCXK(浙)2019-0002。饲养环境:温度21~25℃;相对湿度35%~70%。
1.1.4仪器
电子天平,DT100,常熟市双杰测试仪器厂;电子秤,DS-788B,上海寺冈电子有限公司;电热恒温鼓风干燥箱,DHG-9076A,上海精宏实验设备有限公司;高压蒸汽灭菌器,SX-500,TOMY(日本);高精度恒温水浴锅,CORIO CD-13,优莱博技术(北京)有限公司;双光束紫外可见分光光度计,UV-2550,日本岛津公司;智能热原仪,ZRY-2D,天大天发科技有限公司;屏障环境,使用许可证为:SYXK(浙)2020-0004;生化培养箱,IPP400PLUS,德国美墨尔特有限公司。
1.2方法按YY/T 0243-2016进行试验
1.2.1热原试验
根据GB/T 16886.12-2017标准的要求,为了评估医疗器械或材料的热原反应性,采用了一套严格的方法来进行热原检查。首先,选取30 g供试品,并将其置于已经经过处理以去除任何可能存在的热原物质的锥形瓶中。接着,向该锥形瓶中加入150 mL的氯化钠注射液,确保液体充分覆盖供试品,以便模拟实际临床应用中的接触条件。随后,将装有供试品和氯化钠溶液的锥形瓶放置于恒温培养箱内,在37℃的条件下保持24 h。这一过程旨在让潜在的热原物质有足够的时间释放到溶液中。在上述预处理完成后,依据《中国药典》(2020年版)四部通则1142“热原检查法”进行具体的实验操作。选择健康的新西兰白兔作为实验动物模型,共选取了三只。每只兔子的体重都得到了精确测量,以确保按照10 mL/kg的标准计算出正确的供试液注射剂量。通过兔耳缘静脉途径进行注射。注射后,为了监测可能出现的发热反应,每隔30 min对每只兔子的体温进行一次测量,并详细记录下来,总共进行六次测量,分别是在注射后的0、30、60、90、120和150 min。通过对比注射前的正常体温与注射后的最高体温,可以计算出每只兔子的体温升高值。根据标准规定,单个兔子的最大允许体温升高不得超过0.6℃;同时,三只兔子的体温升高总和也不得超过1.3℃。
1.2.2溶血试验
试验前,取健康新西兰兔1只,通过心脏采血20 mL,加入质量浓度为20 g/L的草酸钾溶液1 mL,制得新鲜抗凝兔血。取新鲜抗凝兔血16 mL,加入氯化钠注射液20 mL稀释,制得稀释兔血。供试品组取3支试管,按照GB/T 16886.12-2017规定,选择0.2 g/mL的浸提比例,每管称取样品5 g,加入10 mL氯化钠注射液。阴性对照组取3支试管,每管加入氯化钠注射液10 mL;阳性对照组取3支试管,每管加入纯化水10 mL。将所有试管放入恒温水浴锅中37℃保温30 min;每支试管中加入0.2 mL稀释兔血,轻轻混匀,置于37℃水浴中继续保温60 min。取出管内液体倒入离心管,离心力设为800 g,离心5 min。吸取离心管内上清液移入比色皿内,按照紫外-可见分光光度法(通则0401),于545 nm波长处测定吸光度。供试品组和对照组吸光度均取3管的平均值,并按照以下公式计算溶血率:溶血率=(供试品组吸光度-阴性对照组吸光度)/(阳性对照组吸光度-阴性对照组吸光度)×100%。溶血率应小于5%。
1.2.3急性全身毒性试验
将与供试液接触的所有器具置于压力蒸汽灭菌器内121℃保持30 min。按照GB/T 16886.12规定,取本品8 g、4 g为一组,置于灭菌后的锥形瓶中,分别加入20 mL氯化钠注射液和20 mL玉米胚芽油,放入恒温培养箱中,37℃保持72 h,制得供试液。取同批号氯化钠注射液和玉米胚芽油在相同条件下制得对照液。取SPF级小鼠20只。其中,5只尾静脉注射氯化钠注射液供试液;5只尾静脉注射氯化钠注射液对照液;5只腹腔注射玉米胚芽油供试液;5只腹腔注射玉米胚芽油对照液。注射速度为0.1 mL/s,注射剂量为50 mL/kg。注射后,观察小鼠的即时反应,并分别在4、24、48、72 h观察并记录供试组和对照组小鼠的一般状态、毒性表现和死亡数;在72 h时,称量小鼠体重。
2结果
2.1热原试验
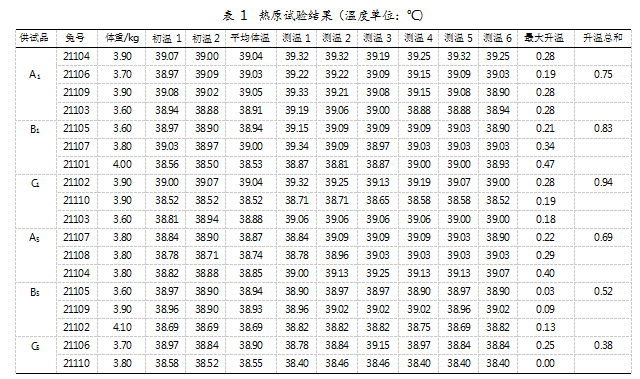
热原试验结果如表1所示。试验中的所有家兔体温的最大升温均未超过0.6℃,且每份供试品3只家兔的体温升高总和均低于1.3℃。结果表明,6个供试品均无致热作用,符合安全性要求。
2.2溶血试验
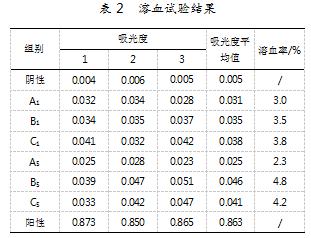
溶血试验结果如表2所示。结果显示,6个供试品的溶血率均低于5%,符合安全性要求。
2.3急性全身毒性试验
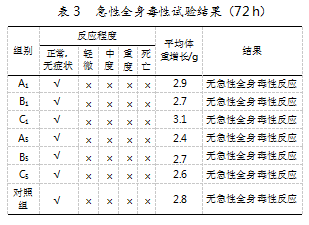
研究发现,在72 h观察期内,供试组及对照组的小鼠均未死亡。临床观察,所有小鼠未出现衰竭、发绀、震颤、呼吸困难,以及腹部刺激等症状。同时,小鼠体重普遍增加,未出现下降。结果表明,6个供试品均无急性全身毒性作用,符合安全性要求。具体结果如表3所示。
3讨论
本研究严格遵循了YY/T 0243-2016《一次性使用注射器活塞》以及GB/T 14233.2-2005《医用输液、输血、注射器具检验方法第2部分:生物学试验方法》所规定的相应实验方法,针对来自三个不同制造商的两种规格(即1 mL和5 mL)的一次性使用注射器用活塞进行了全面而深入的生物安全性评估。通过一系列严格的测试程序,所有样品均达到了标准要求,这意味着这些厂家生产的一次性使用注射器用活塞作为医疗设备的一部分,在临床应用中是安全可靠的。特别值得注意的是溶血试验的结果。根据表2的数据,参与测试的所有样本的溶血率都控制在了小于5%的安全范围内,这符合国家标准的要求。然而,观察到溶血率的数值普遍接近规定的上限,特别是编号为B5的样品,其溶血率达到了4.8%,几乎触及了5%的最大允许值。这一结果提示在实际应用中需要对这类产品保持警惕,并考虑对其进行进一步优化,以确保更高的安全边际。为了更深入地理解温度和时间对溶血率的影响,笔者调整了1.2.2溶血试验中的条件,将原本设定为“将所有试管放入恒温水浴锅中37℃保持30 min”的步骤延长至60 min。经过这样的修改后重新进行溶血试验,结果显示所有供试品的溶血率都有不同程度的上升,尤其显著的是,B5样品的溶血率已经超过了5%的标准限制。这表明延长处理时间可能会增加材料与血液成分之间的反应,进而影响产品的生物相容性[5]。
考虑到当前预灌装注射器作为一种新型药品包装形式正在迅速发展,如果要将其作为此类系统的配套组件使用,制造商必须更加注重辅助剂及原辅料残留杂质的控制,同时致力于生产工艺的改进,以保证最终产品的高质量和高安全性。对于预灌装注射器而言,其设计初衷是为了提高给药效率和便利性,但必须确保任何可能与药物直接接触的部件不会对患者造成额外风险。因此,持续的质量监控和技术革新将是保障这类创新医疗器械安全性和有效性的关键因素。
参考文献
[1]张世明,陶树清.评价医疗器械体外细胞毒性的常用方法概述[J].现代医学,2020,48(1):146-150.
[2]赵鹏,邢丽娜,刘文博,等.医疗器械生物相容性评价:现状、进展与趋势[J].中国医疗器械信息,2021,27(11):1-4.
[3]国家食品药品监督管理总局.一次性使用注射器用活塞:YY/T 0243-2016[S].中国:国家食品药品监督管理总局,2016.
[4]国家药典委员会.中华人民共和国药典:四部[M].北京:中国医药科技出版社,2020.
[5]陈明,徐世伦,施万臣,等.预灌封注射器及其橡胶活塞的发展现状及展望[J].医疗装备,2022,35(5):187-189.










