食品中大肠埃希氏菌O157∶H7/NM能力验证结果分析与讨论论文
2025-04-25 13:43:03 来源: 作者:xujingjing
摘要:为评估实验室对食品中大肠埃希氏菌O157:H7/NM的检测能力,保证日常检测工作的准确性,本实验室参加了大连海关技术中心组织的PTC-T623食品大肠埃希氏菌O157:H7/NM的能力验证计划。实验室采用GB 4789.36-2016第一法常规培养法进行检测分离,通过全自动荧光免疫分析仪进行快速筛检,利用全自动微生物鉴定系统进行生化鉴定,并运用实时荧光定量PCR仪对测试结果进行验证。结果显示,样品编号015检出大肠埃希氏菌O157:H7,而编号046未检出。该结果与组织方一致,确保了实验室的检测能力。
摘要:为评估实验室对食品中大肠埃希氏菌O157:H7/NM的检测能力,保证日常检测工作的准确性,本实验室参加了大连海关技术中心组织的PTC-T623食品大肠埃希氏菌O157:H7/NM的能力验证计划。实验室采用GB 4789.36-2016第一法常规培养法进行检测分离,通过全自动荧光免疫分析仪进行快速筛检,利用全自动微生物鉴定系统进行生化鉴定,并运用实时荧光定量PCR仪对测试结果进行验证。结果显示,样品编号015检出大肠埃希氏菌O157:H7,而编号046未检出。该结果与组织方一致,确保了实验室的检测能力。
关键词:能力验证;大肠埃希氏菌O157:H7/NM;分离鉴定
大肠埃希氏菌O157:H7作为肠出血性大肠杆菌(EHEC)的代表性菌株,可产生大量类志贺氏毒素,不仅会造成腹泻和出血性肠炎,还可能引起溶血性尿毒综合征、血栓性血小板减少性紫癜等严重并发症[1]。2018年,美国32州因生菜污染E.coli O157:H7暴发疫情,导致172人食物中毒[2]。研究发现,牛肉、生奶、鸡肉及其制品、蔬菜、水果及制品等品类,均可引起食源性E.coli O157:H7污染[3]。2021年颁布的《食品安全国家标准预包装食品中致病菌限量》(GB 29921-2021)明确规定,致泻大肠埃希氏菌在肉制品、即食果蔬制品中均不得检出[4]。
为评估当前实验室对大肠埃希氏菌O157:H7/NM的检测能力,本实验室参加了大连海关技术中心组织的PTC-T623食品大肠埃希氏菌O157:H7/NM的能力验证。研究过程采用GB 4789.36-2016第一法常规培养法进行检测分离,通过全自动荧光免疫分析仪进行快速筛检,利用全自动微生物鉴定系统进行生化鉴定,并运用荧光定量PCR仪对测试结果进行验证。
1材料与方法
1.1样品来源
样品由大连海关技术中心提供,编号为015和046,为大肠埃希氏菌O157:H7/NM定性样品。样品均采用真空西林瓶密闭包装。
1.2培养基与试剂
磷酸盐缓冲液(PBS);改良EC肉汤(mEC+n);改良山梨醇麦康凯琼脂(CT-SMAC);月桂基硫酸盐胰蛋白胨肉汤-MUG(LST-MUG);三糖铁琼脂(TSI)。上述琼脂均购自北京陆桥技术股份有限公司。
O157显色培养基(法国科玛嘉);ECPT试剂盒(法国生物梅里埃);VITEK®2 GN鉴定卡(法国生物梅里埃);O157:H7诊断血清(宁波天润生物药业有限公司);细菌基因组DNA提取试剂盒(天根生化科技有限公司);大肠埃希氏菌O157核酸检测试剂盒(北京美正生物科技有限公司)。
1.3仪器与设备
生物培养箱(BD115德国Binder);全自动荧光免疫分析仪(mini VIDAS ECPT法国生物梅里埃);全自动微生物鉴定系统(VITEK®2 COMPACT法国生物梅里埃);荧光定量PCR仪(ABI7500美国Life technology);高速低温冷冻离心机(5415R德国Eppendorf);超微量核酸蛋白分析仪(英国BioDrop);生物安全柜(西班牙泰事达)。
1.4标准菌株
大肠埃希氏菌O157:H7 CICC10907;大肠埃希氏菌ATCC25922。
1.5方法
依据能力验证作业指导书及GB 4789.36-2016《食品安全国家标准食品微生物学检验大肠埃希氏菌O157:H7/NM检验》进行检测[5]。
1.5.1样品前处理
按照作业指导书要求,在无菌条件下遵循无菌操作开启西林瓶,并立即加入4 mL稀释液再水化;溶解后吸入无菌瓶,反复用余下稀释液清洗西林瓶内壁(包括胶塞)。回收清洗液共计25 mL,作为待测原液备用。
1.5.2增菌
吸取25 mL待检样品015、046分别加入225 mL的mEC+n肉汤中,混匀,36℃培养24 h。阴阳性对照随行实验。
1.5.3平板分离、快速筛检
取增菌后的mEC+n肉汤,划线接种至CT-SMAC平板和O157显色培养基上,36℃培养24 h。
分别吸取增菌液1 mL放入100℃水浴锅中加热10 min,冷却至室温,吸取500μL样液加入ECPT试剂条样本孔中,利用mini VIDAS ECPT进行快速筛检。
1.5.4生化鉴定
挑取CT-SMAC平板和O157显色培养基上的可疑菌落,接种至TSI琼脂上,同时接种到LST-MUG肉汤中,36℃培养24 h;挑取可疑菌落,利用营养琼脂分纯,36℃培养24 h;开展血清学试验,使用O157:H7诊断血清作凝集试验;使用全自动微生物鉴定系统(VITEK®2 COAAPACT)卡进行生化鉴定。
1.5.5实时荧光定量PCR法
根据细菌基因组DNA提取试剂盒说明书,对样品015、046增菌液进行DNA提取,采用大肠埃希氏菌O157核酸检测试剂盒(PCR-探针法)实时开展荧光PCR检测。反应参数:95℃5 min;95℃15 s、60℃30 s,45个循环,反应体系25μL。结果判断:Ct值≥40为阴性;Ct值≤35为阳性。质量控制:空白对照无扩增曲线(或Ct值>40),且阳性对照在相应的检测通道有标准的S型扩增曲线。
2结果与分析
2.1 mini VIDAS ECPT快速筛检结果
经过ECPT试剂条45 min的快速筛选,样品015筛检为阳性;样品046为阴性。
2.2平板菌落形态及初步生化结果
CT-SMAC平板上,样品015呈现无色半透明中心深褐色菌落,样品046未生长;O157显色培养基上,样品015呈现紫色典型菌落形态,样品046为非典型蓝色菌落;三糖铁琼脂上2份样品的斜面和底层均产酸变黄,产气且不产硫化氢;LST-MUG荧光反应结果显示,样品015无荧光产生,样品046有荧光。生化结果具体如表1所示。
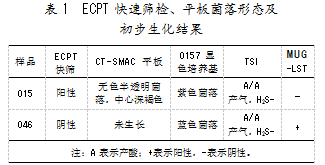
根据平板菌落形态及初步生化反应,排除样品046为大肠埃希氏菌O157:H7的可能,对样品015作进一步生化鉴定。
2.3血清学凝集试验
在营养琼脂平板上挑取纯培养菌落,用O157:H7诊断血清作玻片凝集试验。
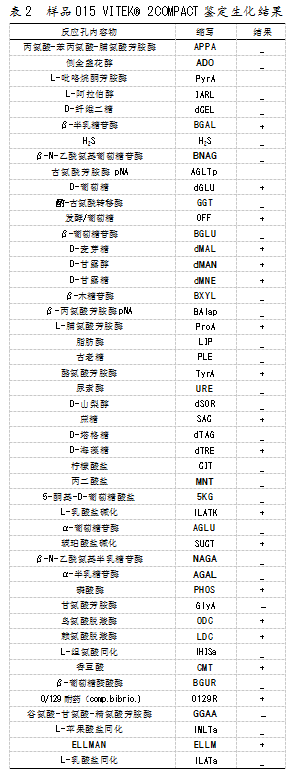
2.4 VITEK®2 COMPACT鉴定
经GN卡上机鉴定,样品O15鉴定编码为0405611150546211,鉴定概率为99%,鉴定为大肠埃希氏菌O157。生化结果如表2所示。
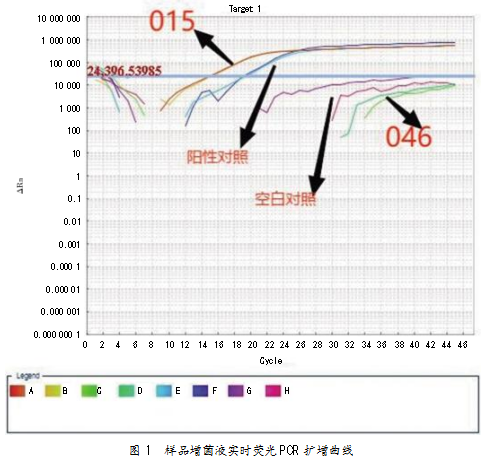
2.5实时荧光PCR检测结果
样品扩增曲线和Ct值显示,样品015的Ct值为15.66<35,结果为阳性,表明样品015中含有大肠埃希氏菌O157;样品046检测结果为阴性。扩增曲线如图1所示。
3结论与讨论
试验结果显示,样品015为大肠埃希氏菌O157阳性样品;样品046为阴性样品。样品015在CT-SMAC和O157显色培养基上均呈现出典型菌落特征,同时TSI、LST-MUG生化结果、血清学试验结果均符合大肠埃希氏菌O157生物学特性。经VITEK®2 COMPACT生化鉴定,样品015为大肠埃希氏菌O157。样品046在CT-SMAC平板上未生长、O157显色培养基上未出现典型菌落,且LST-MUG生化反应为阳性,排除了该菌是O157的可能。这一结果与实时荧光定量PCR增菌液扩增、mini VIDAS ECPT快速筛检结果相印证,同时也与组织方一致,结果满意。
能力验证作为实验室质量控制的一项重要手段,是实验室内部质量控制的有效补充,能有效验证实验室检测过程的可靠性和结果的准确性,是实验室综合实力的体现[6]。开展能力验证活动对于提升检验能力水平、加深对标准的理解、规范操作程序、提高工作质量具有积极的作用和意义[7]。
实验在生物二级实验室中进行。接收样品时,须在生物安全柜中打开快递包装,查看样品是否破损,如有问题及时跟组织方联系沟通。样品在确认无误后,应立即置于2~6℃条件下保存,并在规定时间内完成测试。能力验证样品为含有待测菌的冻干粉,需要采用西林瓶密闭包装。此时,西林瓶中为高真空状态,开启时务必缓慢进行,以防压力瞬间侵入导致冻干粉末外溢。冻干粉为一个样品单元,是不可分割的整体,切勿只取其中一部分冻干粉作为测试样品。有条件的实验室可在2个生物安全柜内开启样品,或者开启一个样品后做消毒处理再开启另一个,以防止交叉污染,最大程度地保证结果的准确性。
mini VIDAS ECPT大肠埃希氏菌O157分析,是在自动VIDAS仪器上进行双抗体夹心酶联荧光免疫分析(ELFA)的方法[8]。该法能快速识别样品中是否含有大肠埃希氏菌O157,且整个分析过程仅需45 min,具备灵敏度高、特异性强、检测速度快等优点[9]。该法曾作为2008版国家标准第三法全自动酶联荧光免疫分析仪筛选法用于检测食品中的大肠埃希氏菌O157∶H7/NM[10],直至2016年标准变更,才被筛除。
LST-MUG荧光检测作为区分鉴定大肠埃希氏菌O157∶H7/NM和普通大肠埃希氏菌的关键性指标,阴阳性判断尤为重要。在日常检测工作中,试管洗刷所使用的洗洁精中可能含有荧光增白剂,如果清洗不净,可能会导致试管内外壁出现荧光假象,造成假阳性。因此,建议在配制该类试剂前,务必使用纯水对试管进行多次超声清洗。此外,在试验过程中,建议设立阳性对照、阴性对照、空白对照协助诊断。尤其在出现阴性和弱阳性的临界点时,需要准确把握,不要误判。
实时荧光定量PCR技术,是针对大肠埃希氏菌O157特异性基因设计引物和探针的检测方法。在PCR扩增过程中,与模板结合的探针会被Taq酶分解产生荧光信号,同时荧光定量PCR仪可根据检测到的荧光信号绘制实时扩增曲线,从而实现对大肠埃希氏菌O157在核酸水平上的定性检测。该技术具有灵敏度高、特异性强等特点,能使大肠埃希氏菌O157的检测更加准确、快速[11-12]。
食品中大肠埃希氏菌O157∶H7/NM能力验证结果分析与讨论
摘要:为评估实验室对食品中大肠埃希氏菌O157:H7/NM的检测能力,保证日常检测工作的准确性,本实验室参加了大连海关技术中心组织的PTC-T623食品大肠埃希氏菌O157:H7/NM的能力验证计划。实验室采用GB 4789.36-2016第一法常规培养法进行检测分离,通过全自动荧光免疫分析仪进行快速筛检,利用全自动微生物鉴定系统进行生化鉴定,并运用实时荧光定量PCR仪对测试结果进行验证。结果显示,样品编号015检出大肠埃希氏菌O157:H7,而编号046未检出。该结果与组织方一致,确保了实验室的检测能力。
关键词:能力验证;大肠埃希氏菌O157:H7/NM;分离鉴定
大肠埃希氏菌O157:H7作为肠出血性大肠杆菌(EHEC)的代表性菌株,可产生大量类志贺氏毒素,不仅会造成腹泻和出血性肠炎,还可能引起溶血性尿毒综合征、血栓性血小板减少性紫癜等严重并发症[1]。2018年,美国32州因生菜污染E.coli O157:H7暴发疫情,导致172人食物中毒[2]。研究发现,牛肉、生奶、鸡肉及其制品、蔬菜、水果及制品等品类,均可引起食源性E.coli O157:H7污染[3]。2021年颁布的《食品安全国家标准预包装食品中致病菌限量》(GB 29921-2021)明确规定,致泻大肠埃希氏菌在肉制品、即食果蔬制品中均不得检出[4]。
为评估当前实验室对大肠埃希氏菌O157:H7/NM的检测能力,本实验室参加了大连海关技术中心组织的PTC-T623食品大肠埃希氏菌O157:H7/NM的能力验证。研究过程采用GB 4789.36-2016第一法常规培养法进行检测分离,通过全自动荧光免疫分析仪进行快速筛检,利用全自动微生物鉴定系统进行生化鉴定,并运用荧光定量PCR仪对测试结果进行验证。
1材料与方法
1.1样品来源
样品由大连海关技术中心提供,编号为015和046,为大肠埃希氏菌O157:H7/NM定性样品。样品均采用真空西林瓶密闭包装。
1.2培养基与试剂
磷酸盐缓冲液(PBS);改良EC肉汤(mEC+n);改良山梨醇麦康凯琼脂(CT-SMAC);月桂基硫酸盐胰蛋白胨肉汤-MUG(LST-MUG);三糖铁琼脂(TSI)。上述琼脂均购自北京陆桥技术股份有限公司。
O157显色培养基(法国科玛嘉);ECPT试剂盒(法国生物梅里埃);VITEK®2 GN鉴定卡(法国生物梅里埃);O157:H7诊断血清(宁波天润生物药业有限公司);细菌基因组DNA提取试剂盒(天根生化科技有限公司);大肠埃希氏菌O157核酸检测试剂盒(北京美正生物科技有限公司)。
1.3仪器与设备
生物培养箱(BD115德国Binder);全自动荧光免疫分析仪(mini VIDAS ECPT法国生物梅里埃);全自动微生物鉴定系统(VITEK®2 COMPACT法国生物梅里埃);荧光定量PCR仪(ABI7500美国Life technology);高速低温冷冻离心机(5415R德国Eppendorf);超微量核酸蛋白分析仪(英国BioDrop);生物安全柜(西班牙泰事达)。
1.4标准菌株
大肠埃希氏菌O157:H7 CICC10907;大肠埃希氏菌ATCC25922。
1.5方法
依据能力验证作业指导书及GB 4789.36-2016《食品安全国家标准食品微生物学检验大肠埃希氏菌O157:H7/NM检验》进行检测[5]。
1.5.1样品前处理
按照作业指导书要求,在无菌条件下遵循无菌操作开启西林瓶,并立即加入4 mL稀释液再水化;溶解后吸入无菌瓶,反复用余下稀释液清洗西林瓶内壁(包括胶塞)。回收清洗液共计25 mL,作为待测原液备用。
1.5.2增菌
吸取25 mL待检样品015、046分别加入225 mL的mEC+n肉汤中,混匀,36℃培养24 h。阴阳性对照随行实验。
1.5.3平板分离、快速筛检
取增菌后的mEC+n肉汤,划线接种至CT-SMAC平板和O157显色培养基上,36℃培养24 h。
分别吸取增菌液1 mL放入100℃水浴锅中加热10 min,冷却至室温,吸取500μL样液加入ECPT试剂条样本孔中,利用mini VIDAS ECPT进行快速筛检。
1.5.4生化鉴定
挑取CT-SMAC平板和O157显色培养基上的可疑菌落,接种至TSI琼脂上,同时接种到LST-MUG肉汤中,36℃培养24 h;挑取可疑菌落,利用营养琼脂分纯,36℃培养24 h;开展血清学试验,使用O157:H7诊断血清作凝集试验;使用全自动微生物鉴定系统(VITEK®2 COAAPACT)卡进行生化鉴定。
1.5.5实时荧光定量PCR法
根据细菌基因组DNA提取试剂盒说明书,对样品015、046增菌液进行DNA提取,采用大肠埃希氏菌O157核酸检测试剂盒(PCR-探针法)实时开展荧光PCR检测。反应参数:95℃5 min;95℃15 s、60℃30 s,45个循环,反应体系25μL。结果判断:Ct值≥40为阴性;Ct值≤35为阳性。质量控制:空白对照无扩增曲线(或Ct值>40),且阳性对照在相应的检测通道有标准的S型扩增曲线。
2结果与分析
2.1 mini VIDAS ECPT快速筛检结果
经过ECPT试剂条45 min的快速筛选,样品
015筛检为阳性;样品046为阴性。
2.2平板菌落形态及初步生化结果
CT-SMAC平板上,样品015呈现无色半透明中心深褐色菌落,样品046未生长;O157显色培养基上,样品015呈现紫色典型菌落形态,样品046为非典型蓝色菌落;三糖铁琼脂上2份样品的斜面和底层均产酸变黄,产气且不产硫化氢;LST-MUG荧光反应结果显示,样品015无荧光产生,样品046有荧光。生化结果具体如表1所示。
根据平板菌落形态及初步生化反应,排除样品046为大肠埃希氏菌O157:H7的可能,对样品015作进一步生化鉴定。
2.3血清学凝集试验
在营养琼脂平板上挑取纯培养菌落,用O157:H7诊断血清作玻片凝集试验。
2.4 VITEK®2 COMPACT鉴定
经GN卡上机鉴定,样品O15鉴定编码为0405611150546211,鉴定概率为99%,鉴定为大肠埃希氏菌O157。生化结果如表2所示。
2.5实时荧光PCR检测结果
样品扩增曲线和Ct值显示,样品015的Ct值为15.66<35,结果为阳性,表明样品015中含有大肠埃希氏菌O157;样品046检测结果为阴性。扩增曲线如图1所示。
3结论与讨论
试验结果显示,样品015为大肠埃希氏菌O157阳性样品;样品046为阴性样品。样品015在CT-SMAC和O157显色培养基上均呈现出典型菌落特征,同时TSI、LST-MUG生化结果、血清学试验结果均符合大肠埃希氏菌O157生物学特性。经VITEK®2 COMPACT生化鉴定,样品015为大肠埃希氏菌O157。样品046在CT-SMAC平板上未生长、O157显色培养基上未出现典型菌落,且LST-MUG生化反应为阳性,排除了该菌是O157的可能。这一结果与实时荧光定量PCR增菌液扩增、mini VIDAS ECPT快速筛检结果相印证,同时也与组织方一致,结果满意。
能力验证作为实验室质量控制的一项重要手段,是实验室内部质量控制的有效补充,能有效验证实验室检测过程的可靠性和结果的准确性,是实验室综合实力的体现[6]。开展能力验证活动对于提升检验能力水平、加深对标准的理解、规范操作程序、提高工作质量具有积极的作用和意义[7]。
实验在生物二级实验室中进行。接收样品时,须在生物安全柜中打开快递包装,查看样品是否破损,如有问题及时跟组织方联系沟通。样品在确认无误后,应立即置于2~6℃条件下保存,并在规定时间内完成测试。能力验证样品为含有待测菌的冻干粉,需要采用西林瓶密闭包装。此时,西林瓶中为高真空状态,开启时务必缓慢进行,以防压力瞬间侵入导致冻干粉末外溢。冻干粉为一个样品单元,是不可分割的整体,切勿只取其中一部分冻干粉作为测试样品。有条件的实验室可在2个生物安全柜内开启样品,或者开启一个样品后做消毒处理再开启另一个,以防止交叉污染,最大程度地保证结果的准确性。
mini VIDAS ECPT大肠埃希氏菌O157分析,是在自动VIDAS仪器上进行双抗体夹心酶联荧光免疫分析(ELFA)的方法[8]。该法能快速识别样品中是否含有大肠埃希氏菌O157,且整个分析过程仅需45 min,具备灵敏度高、特异性强、检测速度快等优点[9]。该法曾作为2008版国家标准第三法全自动酶联荧光免疫分析仪筛选法用于检测食品中的大肠埃希氏菌O157∶H7/NM[10],直至2016年标准变更,才被筛除。
LST-MUG荧光检测作为区分鉴定大肠埃希氏菌O157∶H7/NM和普通大肠埃希氏菌的关键性指标,阴阳性判断尤为重要。在日常检测工作中,试管洗刷所使用的洗洁精中可能含有荧光增白剂,如果清洗不净,可能会导致试管内外壁出现荧光假象,造成假阳性。因此,建议在配制该类试剂前,务必使用纯水对试管进行多次超声清洗。此外,在试验过程中,建议设立阳性对照、阴性对照、空白对照协助诊断。尤其在出现阴性和弱阳性的临界点时,需要准确把握,不要误判。
实时荧光定量PCR技术,是针对大肠埃希氏菌O157特异性基因设计引物和探针的检测方法。在PCR扩增过程中,与模板结合的探针会被Taq酶分解产生荧光信号,同时荧光定量PCR仪可根据检测到的荧光信号绘制实时扩增曲线,从而实现对大肠埃希氏菌O157在核酸水平上的定性检测。该技术具有灵敏度高、特异性强等特点,能使大肠埃希氏菌O157的检测更加准确、快速[11-12]。
参考文献
[1]王玥,邵琳,李乾学,等.适配体结合量子点技术同时检测金黄色葡萄球菌和大肠埃希氏菌O157∶H7方法[J].食品科学,2021,42(8):305-312.
[2]宋春宏,顾文佳,葛宇.水培蔬菜营养液微生物变化对蔬菜微生物污染风险的影响[J].上海农业学报,2022,38(5):107-112.
[3]赖则冰,张淑红,朱雪梅,等.肉类及蔬菜食品中EHEC O157污染分布及分型研究[J].现代食品科技,2014,30(9):290-296.
[4]中华人民共和国国家卫生健康委员会,国家市场监督管理总局.食品安全国家标准预包装食品中致病菌限量:GB 29921-2021[S].北京:中国标准出版社,2021.
[5]国家卫生和计划生育委员会,国家食品药品监督管理总局.食品安全国家标准食品微生物学检验大肠埃希氏菌O157:H7/NM检验:GB 4789.36-2016[S].北京:中国标准出版社,2016.
[6]CNAS-GL002能力验证结果的统计处理和能力评价指南[S].北京:中国合格评定国家认可委员会,2018.
[7]吉彦莉,郭勇峰,王敬辉,等.食品微生物学检测能力验证分析[J].公共卫生与预防医学,2015,26(3):110-112.
[8]林赛君.三种食源性致病菌酶联免疫荧光法的分析研究[D].杭州:浙江工业大学,2007.
[9]叶毅飞,胡健声,朱声涛.应用全自动荧光酶联免疫法检测肉类中的大肠杆菌O157[J].畜牧兽医科技信息,2016(8):27.
[10]中华人民共和国卫生部,中国国家标准化管理委员会.食品卫生微生物学检验大肠埃希氏菌O157∶H7/NM检验:GB/T 4789.36-2008[S].北京:中国标准出版社,2008.
[11]张微,姚笛,侯婷婷,等.乳中大肠杆菌O157∶H7的荧光定量PCR检测方法的建立[J].中国乳品工业,2015,43(7):52-54.
[12]樊杰,伏小平.O157∶H7型大肠杆菌荧光定量PCR检测方法的建立[J].中国兽医科学,2008(1):15-19.










