嗜热链球菌 S-3 高密度生长培养基优化论文
2025-03-20 14:23:35 来源: 作者:xuling
摘要:嗜热链球菌一般可用于发酵食品的生产环节。基于此,文章对传统的LM17培养基进行了优化,通过改良碳源、氮源以及无机盐种类、含量等,实现了嗜热链球菌S-3的高密度生长,满足了工业发酵要求。
摘要:嗜热链球菌一般可用于发酵食品的生产环节。基于此,文章对传统的LM17培养基进行了优化,通过改良碳源、氮源以及无机盐种类、含量等,实现了嗜热链球菌S-3的高密度生长,满足了工业发酵要求。研究通过比较乳糖、半乳糖、葡萄糖、蔗糖、果糖等碳源,确定最优碳源为乳糖;酵母浸粉为固定氮源,将其与牛肉浸粉、大豆蛋白胨和酵母浸粉分别复配,发现酵母浸粉与牛肉浸粉复配是最佳搭配。文章构建了嗜热链球菌S-3全基因尺度代谢网络模型,以预测尿素替代β-磷酸甘油二钠的效果。验证结果显示,尿素能显著提高嗜热链球菌S-3的生长速率。最终改良培养基中的物质包括:10 g/L乳糖、10 g/L酵母浸粉、15 g/L牛肉浸粉、3 g/L食品级尿素、1.1 g/L MgSO4·7H2O。为研究最优配制比例,对各因素进行了单因素优化及正交实验。实验结果表明,当乳糖15 g/L、牛肉浸粉15 g/L、酵母浸粉11 g/L、尿素4 g/L、MgSO4·7H2O 1 g/L时,发酵效果最优,放大培养后的OD600已由优化前的4提高至5。
关键词:嗜热链球菌;培养基优化;高密度发酵
嗜热链球菌(Streptococcus thermophilus)是目前研究最深入、应用最广泛的益生菌之一,已被熟练应用于乳制品、食品添加剂等领域[1]。嗜热链球菌可促进乳糖快速发酵,显著改善发酵产品的风味,通常被用于与其他乳酸菌协同发酵,是一种重要的商业发酵剂[2]。在当前的食品应用领域,嗜热链球菌面临巨大的市场需求量[3],市场价值已超过百亿,具有极高的商业价值,而作为发酵剂,进行高密度发酵技术与条件的研究也十分重要[4]。研究嗜热链球菌的高密度发酵、获得高生物量菌体、突破发酵剂高密度发酵和制备,有利于深化嗜热链球菌在食品等行业的应用[5]。
高密度发酵(High density culture)是乳酸菌发酵剂高效制备的关键核心技术[6]。该方法需要通过一定的培养技术和装置来提高菌体发酵密度,减小培养体积,缩短生产周期,从而达到提高特定产物比生产速率的目的[7]。尽管Letort等[8]已对嗜热链球菌指数生长最小化学培养基进行了优化,但其最大生物量仅达到108 CFU/mL,且培养基成本相对较高。本实验采用改良培养基方法进行高密度发酵并以OD600值为测量指标,优化得到了一种适宜高密度发酵且能降低成本的培养基,为工厂生产提供了有效参考。
1材料与试剂
1.1菌种和细胞
嗜热链球菌S-3,保存在上海理工大学健康科学与工程学院食品生物技术研究所,保藏号为CGMCC No.12098。
1.2材料与试剂
乳糖,分析纯,购自上海源叶生物科技股份有限公司;胰蛋白胨,分析纯,购自赛默飞世尔科技公司;酵母浸粉,分析纯,购自赛默飞世尔科技公司;β-磷酸甘油二钠,分析纯,购自上海源叶生物科技股份有限公司;MgSO4·7H2O,分析纯,购自上海泰坦科技股份有限公司;大豆蛋白胨,生化纯,购自北京陆桥技术股份有限公司;牛肉浸粉,生化纯,购自北京陆桥技术股份有限公司;尿素,分析纯,购自生工生物工程(上海)股份有限公司。
LM17固体培养基的制备:胰蛋白胨5 g/L、牛肉浸粉5 g/L、β-磷酸甘油二钠19 g/L、大豆蛋白胨5 g/L、酵母浸出粉2.5 g/L、乳糖20 g/L、琼脂20 g/L,加蒸馏水1 000 mL混合,于115℃灭菌20 min。
LM17液体培养基的制备:胰蛋白胨5 g/L、牛肉浸粉5 g/L、β-磷酸甘油二钠19 g/L、大豆蛋白胨5 g/L、酵母浸出粉2.5 g/L,加蒸馏水900 mL混合,于115℃下灭菌20 min;乳糖20 g/L加蒸馏水100 mL,于121℃灭菌15 min。灭菌处理后,将两份样品在超净台内无菌条件下混合均匀。
1.3试剂和仪器
高压蒸汽灭菌锅,购自日本Hirayama公司;PX-150B-Z生化培养箱,购自上海博迅实业有限公司医疗设备厂;Spectra Max i3x型酶标仪,购自美国Molecular Devices公司;Bioscreen C全自动生长曲线分析仪,购自芬兰OyGrowth公司;超纯水机Mli-Q型,购自美国Millipore公司;数控超声波清洗器,购自昆山市超声仪器有限公司;Bugbox DG250厌氧培养箱,购自英国Ruskinn公司。
1.4实验方法
1.4.1菌株活化方法
从-80℃冰箱中取出冷藏的嗜热链球菌S-3并待其恢复至室温后,在超净工作台上接种至10μL的LM17固体培养基中,置于37℃恒温箱内培养24 h。挑取单菌落接种至LM17液体培养基中,放置在37℃恒温培养箱内培养12 h,活化两代后以3%的接种量接种至LM17液体培养基中,放置在37℃恒温培养箱内培养12 h。制备3份种子液用于后续实验。
1.4.2菌株生长测定
稀释种子液在酶标仪中测得OD600为0.34后,以3%的接种量接种至生长曲线板上,且每份种子液设置3个平行对照,同时每种培养基设置3个平行对照。使用生长曲线仪在37℃条件下每隔30 min测定其OD600,共测定24 h的OD600。以时间为横坐标,利用Graphpad Prism 8软件绘制生长曲线图。
1.5营养物质单因素优化方法
碳源优化[9-10]:以LM17培养基为基础骨架,将LM17的乳糖分别替换成质量分数为2%的乳糖、半乳糖、葡萄糖、蔗糖、果糖;参考液体LM17的制备方法进行配制,灭菌后分别接种3%活化后的嗜热链球菌S-3,并于37℃恒温培养24 h。根据其OD600确定最优碳源后,分别添加质量分数为1%、2%、3%、4%、5%的最优碳源,并在灭菌后分别接种嗜热链球菌S-3,在相同条件下培养24 h后测定OD600。
氮源优化:以LM17培养基为基础骨架,选取7.5 g/L酵母浸粉作为固定氮源,并将其与10 g/L牛肉浸粉、大豆蛋白胨、胰蛋白胨和酵母浸粉分别复配;参考液体LM17制备方法进行配制,灭菌后分别接种3%活化后的嗜热链球菌S-3,于37℃条件下恒温培养24 h,测定OD600。根据其OD600确定最优氮源后,分别添加质量分数为0.75%、1.00%、1.25%、1.50%、1.75%、2.00%的OD600最优氮源,并在灭菌后分别接种嗜热链球菌S-3,在相同条件下培养24 h后测定OD600。
酵母浸粉优化:以LM17培养基为骨架,分别将0.25%、0.50%、0.75%、1.00%、1.25%、1.50%的酵母浸粉添加至培养基中;参考液体LM17制备方法进行配制,并在灭菌后分别接种嗜热链球菌S-3,相同条件下培养24 h后测定OD600。
尿素优化:以LM17培养基为骨架,分别将0.1%、0.3%、0.5%、0.7%、0.9%、1.1%、1.3%、1.5%的尿素添加至培养基中;参考液体LM17制备方法进行配制,并在灭菌后分别接种嗜热链球菌S-3,相同条件下培养24 h后测定OD600。
MgSO4·7H2O优化:以LM17培养基为骨架,分别将质量分数为0.01%、0.03%、0.05%、0.07%、0.09%、0.11%、0.13%、0.15%的尿素添加至培养基中;参考液体LM17制备方法进行配制,并在灭菌后分别接种嗜热链球菌S-3,在相同条件下培养24 h后测定OD600[11-12]。
1.6发酵培养基优化正交实验
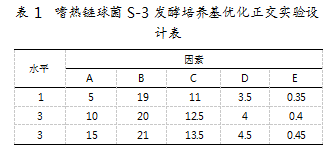
1.6.1正交实验设计表
根据发酵培养基单因素优化试验结果,设计五因素三水平正交试验,以优化LM17发酵培养基[13],研究因素A(乳糖)、因素B(牛肉浸粉)、因素C(酵母浸粉)、因素D(尿素)、因素E(MgSO4·7H2O)的不同配制比例对嗜热链球菌S-3的影响。正交试验设计如表1所示。
1.6.2正交实验设计培养基配制和验证实验
正交实验设计液体培养基的制备步骤如下。
1)将培养基的原料分为X相、Y相、Z相。其中,X相为乳糖;Y相为牛肉浸粉、酵母浸粉;Z相为尿素、MgSO4·7H2O;
2)将X相、Y相分开配制,即每1 L超纯水分成两份:一份溶X相;另一份溶Y相。在不锈钢压力蒸汽灭菌器中115℃灭菌20 min后,冷却至室温;
3)根据配制培养基质量浓度称取对应的尿素、MgSO4·7H2O样品,在超净台中将X、Y相混合后,溶解Z相并用0.22μm的滤头过滤两次得到嗜热链球菌所用的LM17改良培养基。
根据发酵培养基优化结果开展S-3发酵实验,并将其与原始培养基进行对比,对改良培养基进行验证[14]。
2结果与分析
2.1碳源种类和含量对S-3发酵的影响
2.1.1碳源种类对S-3生长的影响
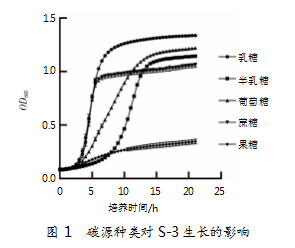
以LM17培养基为基础骨架,对其碳源进行替换,所得结果如图1所示。数据显示,当用乳糖、半乳糖、葡萄糖、蔗糖和果糖替代LM17培养基的碳源时,乳糖组生长速率显著高于半乳糖组、葡萄糖组、蔗糖和果糖组;乳糖组的平台期OD600也显著高于半乳糖组、葡萄糖组、蔗糖组和果糖组。系统分析发现,乳糖组综合生长情况最好。因此,确定乳糖为嗜热链球菌S-3的最优碳源。
2.1.2最优碳源不同含量对S-3发酵的影响
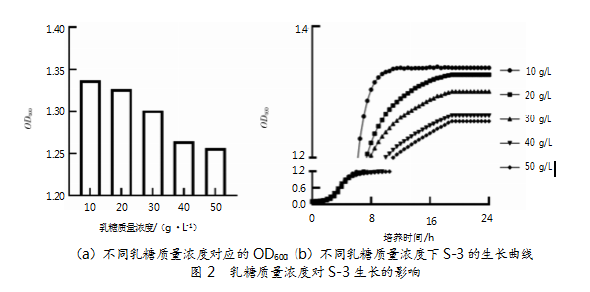
以LM17培养基为基础骨架,向其中添加不同质量分数的乳糖,测得24 h的OD600,并制成生长曲线。结果如图2所示。数据显示,在乳糖添加量高于10 g/L后,嗜热链球菌S-3的OD600值随乳糖添加量增大而减小。方差分析结果,乳糖添加量对嗜热链球菌的OD600值具有显著影响(P<0.05)。由此可见,嗜热链球菌S-3可利用乳糖作为碳源进行生长代谢,但当乳糖添加量达到一定值时,菌体利用率会到达极限,继续添加并不会对其生长提供帮助[15]。因此,确定乳糖的最佳添加量为10 g/L,此时嗜热链球菌S-3的OD600值为1.33。
2.2氮源种类和质量浓度对S-3发酵的影响
2.2.1氮源种类对S-3发酵的影响
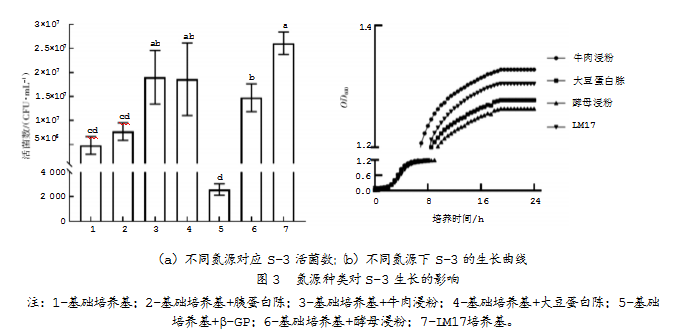
在基础培养基中加入相同含量、不同种类的氮源及β-磷酸甘油二钠,测得培养24 h后的活菌数和OD600。单因素方差分析采用SPSS软件;均数比较采用Tukey检验,适用于样本量相等的多个处理组;P<0.05表示差异具有统计学意义,显著性结果用字母abcd表示:相同字母的组间差异不显著,而差异字母的组间差异显著。氮源种类对S-3生长的影响结果如图3所示。数据显示,除牛肉浸粉组和大豆蛋白胨组外,其余组都与LM17组活菌数具有显著差异。测量并绘制牛肉浸粉组、大豆蛋白胨组、酵母浸粉组的生长曲线,发现利用牛肉浸粉作为培养基氮源时,生长速率略高于大豆蛋白胨、酵母浸粉、LM17培养基,OD600最高,表明嗜热链球菌S-3生长最好。因此,经过综合分析,确定牛肉浸粉为嗜热链球菌S-3的最优氮源。
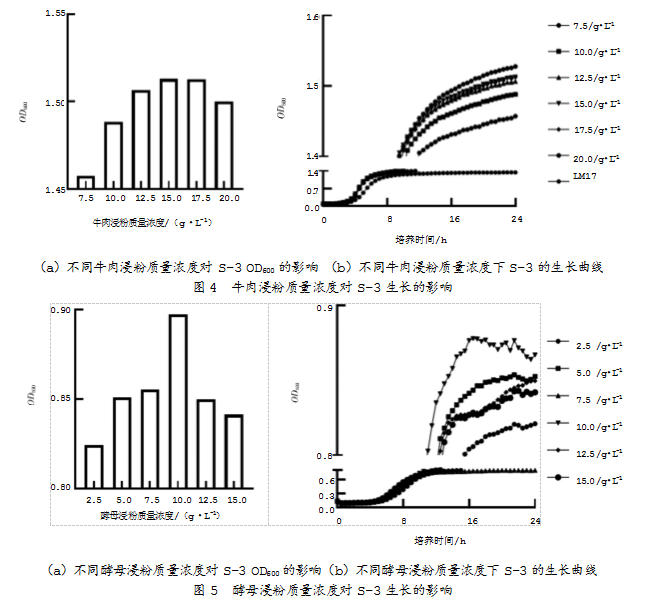
2.2.2牛肉浸粉质量浓度对S-3的影响
以LM17培养基为基础骨架,向其中添加不同质量分数的牛肉浸粉,并测得其生长曲线,如图4所示。数据显示,当牛肉浸粉质量浓度为15 g/L时,嗜热链球菌S-3的OD600值最高,此时牛肉浸粉作为氮源适宜该菌株的生长,OD600为1.51;当牛肉浸粉质量浓度大于15 g/L时,OD600开始下降,说明过多的牛肉浸粉反而会产生一定的底物抑制作用,从而限制菌株生长。最终确定,牛肉浸粉的最佳质量浓度为15 g/L。
2.2.3酵母浸粉含量S-3的影响
以LM17培养基为基础骨架,向其中添加不同质量分数的酵母浸粉,测得生长曲线,如图5所示。数据显示,当酵母浸粉添加量为10 g/L时,嗜热链球菌S-3的OD600值最高,此时菌株的生长状况最佳,OD600为0.89;当酵母浸粉添加量大于10 g/L时,氮源利用效率降低。因此,确定酵母浸粉的最佳质量分数为10 g/L。
2.3尿素含量对S-3的影响
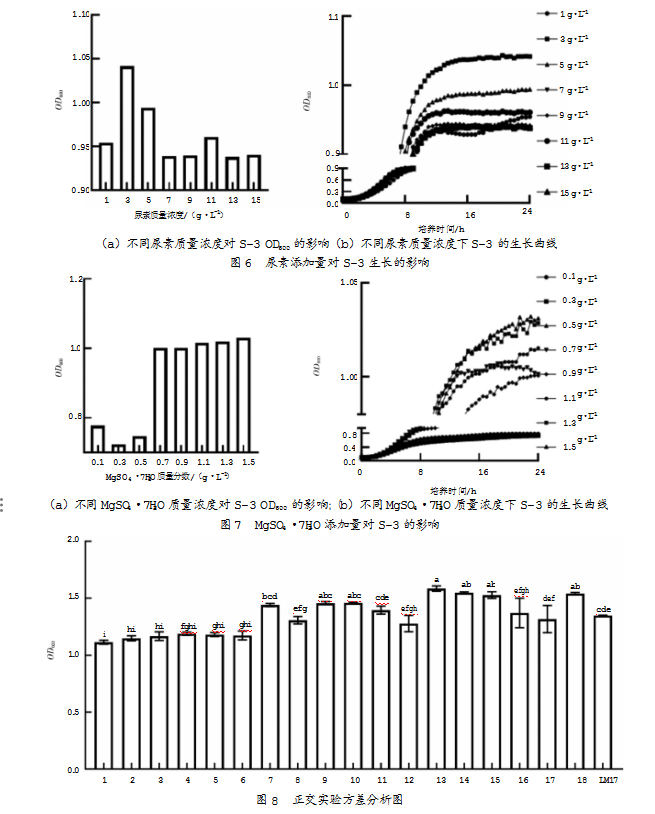
以LM17培养基为基础骨架,向其中添加不同质量分数的尿素,测得生长曲线,如图6所示。数据显示,当尿素添加量为3 g/L时,嗜热链球菌S-3的OD600值最高,此时菌株生长状况最佳,OD600为1.04;当尿素添加量大于3 g/L时,尿素利用效率降低。因此,确定所添加尿素的最佳质量浓度为3 g/L。
2.4 MgSO4·7H2O含量对S-3的影响
以LM17培养基为基础骨架,向其中添加不同质量浓度的MgSO4·7H2O,测得生长曲线,如图7所示。数据显示,当MgSO4·7H2O的质量浓度为1.1 g/L时,嗜热链球菌S-3的OD600值最高,此时菌株的生长状况最佳,OD600为1.01;当MgSO4·7H2O质量浓度大于1.1 g/L时,MgSO4·7H2O的OD600呈先下降后提高的趋势。综合考虑成本等因素,最终所添加确定MgSO4·7H2O的最佳质量浓度为1.1 g/L。
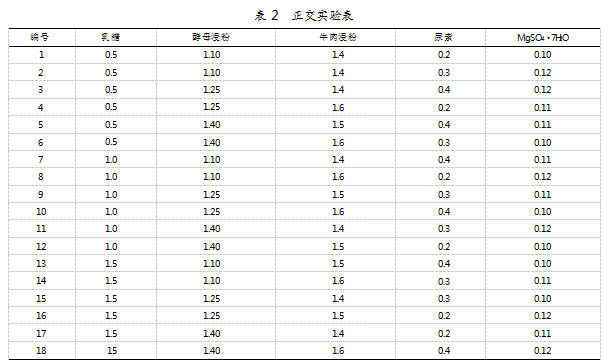
2.5正交实验
根据单因素实验结果设计五因素三水平正交实验,具体如表2所示。单因素方差分析采用SPSS软件进行;均数比较采用Tukey检验,适用于样本量相等的多个处理组;P<0.05表示差异具有统计学意义,显著性结果用字母abcdefghi表示:具有相同字母的组间差异性不显著,而差异字母的组间差异性显著。研究发现,13、14、15、18号培养基均与LM17培养基差异显著。其中,13号培养基经优化后嗜热链球菌S-3的最终OD600值由原来的1.35提升至1.59,具有显著差异(P<0.05)。具体如图8所示。
3结论
文章采用单因素和正交试验对嗜热链球菌S-3的发酵培养基LM17进行了优化,通过实验,用尿素替代了β-磷酸甘油二钠,并对LM17培养基的各组分含量进行了优化,最终确定最佳发酵培养基例为乳糖15 g/L、牛肉浸粉15 g/L、酵母浸粉11 g/L、尿素4 g/L、MgSO4·7H2O 1 g/L。此外,还对优化结果进行了验证,优化后的OD600值由原来的1.35提升至1.59,提高了17.8%,发酵水平显著提升,放大培养后结果依旧成立,且培养基成本也显著下降。改良培养基为后续嗜热链球菌S-3的高密度发酵应用奠定了可靠的基础。
参考文献
[1]SONG X,HOU C,YANG Y,et al.Effects of different carbon sources on metabolic profiles of carbohydrates in Streptococcus thermophilus during fermentation[J].Journal of the Science of Food and Agriculture,2022,102(11):4820-4829.
[2]GASSER C,GARAULT P,CHERVAUX C,et al.Co-utilization of saccharides in mixtures:Moving toward a new understanding of carbon metabolism in Streptococcus thermophilus[J].Food Microbiol,2022,107:104080.
[3]AKTAS H,覶ETIN B.Multidimensional evaluation of techno-functional properties ofyoghurt bacteria[J].Int Dairy J,2024,148.
[4]CHEN L,ALCAZAR J,YANG T,et al.Optimized cultural conditions of functional yogurt for Y-aminobutyric acid augmentation using response surface methodology[J].Journal of Dairy Science,2018,101(12):10685-93.
[5]DEGEEST B,MOZZI F,DE VUYST L.Effect of medium composition and temperature and pH changes on exopolysa-ccharide yields and stability during Streptococcus ther-mophilus LY03 fermentations[J].International J Food Microbiol,2002,79(3):161-174.
[6]刘继业.直投式乳酸菌发酵剂制备技术的研究及其应用[D].泰安:山东农业大学,2017.
[7]ABELN FEXIX,CHUCK CHRISTOPHER J.Achieving a high-density oleaginous yeast culture:Comparison of four processing strategies using Metschnikowia pulcherrima[J].Biotechnol ogy and Bioeng Ineering,2019,116(12):3200-3214.
[8]LETORT C,JUILLARD V.Development of A minimal chemically-defined Medium for the Exponential Growth of Streptococcus Thermophilus[J].Journal of Applied Microbiology,2001,91(6):1023-1029.
[9]李学朋,白红兵,韩杨.L-赖氨酸发酵培养基的响应面优化[J].发酵科技通讯,2019,48(4):214-219.
[10]衡利冰,夏永军,艾连中,等.植物乳杆菌AR307发酵培养基优化研究[J].工业微生物,2024,54(1):81-6.
[11]董安利.乳酸乳球菌乳酸亚种BL19的高密度培养研究[D].呼和浩特:内蒙古农业大学,2019.
[12]范佳硕,杨鑫,陈博,等.植物乳杆菌发酵培养基优化及工艺开发[J].发酵科技通讯,2020,49(1):21-26.
[13]白长胜.禽用乳酸菌SR1发酵条件优化[J].发酵科技通讯,2022,51(1):15-18.
[14]李娜,杨江华,韦宇拓.植物乳杆菌ZJ316高密度发酵条件优化[J].中国酿造,2021,40(5):43-8.
[15]YU P,LI N,GENG M,et al.Short communication:Lactose utilization of Streptococcus Thermophilus andEorrelations withβ-galactosidaseand Urease[J].Journal of Dairy SCIENCE,2020,103(1):166-171.










