根皮素包合物对 ARPE-19 细胞损伤的保护效果的研究论文
2025-03-06 15:54:52 来源: 作者:xuling
摘要:为探究根皮素(Phloretin,Ph)及根皮素/羟丙基-β-环糊精包合物(Ph/HBC-IC)对甲基乙二醛(MGO)诱导的人视网膜色素上皮细胞(ARPE-19)损伤的保护效果,文章采用冷冻干燥法制备得到Ph/HBC-IC,并利用傅里叶红外光谱(FTIR)、扫描电镜(SEM)、X射线衍射(XRD)等技术对包合物进行表征。
摘要:为探究根皮素(Phloretin,Ph)及根皮素/羟丙基-β-环糊精包合物(Ph/HBC-IC)对甲基乙二醛(MGO)诱导的人视网膜色素上皮细胞(ARPE-19)损伤的保护效果,文章采用冷冻干燥法制备得到Ph/HBC-IC,并利用傅里叶红外光谱(FTIR)、扫描电镜(SEM)、X射线衍射(XRD)等技术对包合物进行表征;通过CCK-8法检测细胞活力,筛选得到MGO诱导ARPE-19细胞损伤的最佳质量分数、Ph及Ph/HBC-IC的最佳干预质量分数,并考察了Ph及Ph/HBC-IC对MGO诱导ARPE-19细胞损伤的保护效果。研究结果显示,上述三种表征方式均能直接或间接证明包合物的形成;建立细胞损伤模型的最佳浓度是1 mmol/L MGO,且Ph及Ph/HBC-IC在0~15 mg/L的质量浓度范围内对细胞存活率没有显著影响。进一步研究表明,诱导的ARPE-19细胞经15 mg/L Ph及Ph/HBC-IC预处理后,细胞存活率分别提高了20.4%和28.67%,证实了Ph及Ph/HBC-IC对MGO诱导的细胞损伤具有保护作用,且Ph/HBC-IC对细胞的保护效果更好。研究结果为Ph及Ph/HBC-IC在相关领域的开发应用提供了科学依据。
关键词:根皮素;包合物;甲基乙二醛;人视网膜上皮细胞(ARPE-19);保护效果
近些年,“抗糖”一词频繁出现在大众视野中。中老年糖尿病患者人数不断攀升且呈现发病年轻化趋势,患病人群不得不时刻关注抗糖以维持自身的健康水平。同时,中青年人群也开始意识到了抗糖的重要性,期望达到抗衰老的效果。人体在长时间处于高浓度还原糖环境中时,还原糖会与蛋白质反应生成有毒的中间化合物,如甲基乙二醛(MGO)和乙二醛(GO)等。这些中间产物一旦形成,不仅会对细胞产生毒性,还会进一步诱导晚期糖基化终产物(AGEs)的形成[1]。AGEs的形成是一个复杂的生物化学过程,可能会加剧细胞损伤,进而危害人体健康。相关研究表明,糖尿病、自然衰老和慢性炎症等情况会促进AGEs的形成和积累[2-4],而AGEs积累会加剧眼睛、肾脏及血管等部位的糖尿病并发症[1]。研究发现,通过捕获MGO和GO,能够限制AGEs的形成,减轻其对细胞的毒性,可作为长期有效预防糖尿病并发症的基础和途径[5]。
根皮素(Phloretin,Ph)是一种天然黄酮类化合物,主要存在于人类经常食用的多汁水果或蔬菜的果皮和根皮中。该种物质具有多种生物活性,包括抗氧化[6-8]、抗菌[9-10]、抗炎[11-12]等。相关研究表明,根皮素能够抑制胰腺癌[13]、乳腺癌[14]、口腔癌[15]等癌细胞的生长。此外,其在提高胰岛素敏感性[16]、调节葡萄糖稳态[17]、缓解糖尿病[18]等方面也展现出了一定的潜力。然而,根皮素的不稳定性及其较差的水溶性限制了其在食品、药品、化妆品等领域的开发利用。为克服相关局限性,现有研究者探索了多种方法及策略。其中,环糊精包合物因能有效改善生物活性化合物的溶解度、稳定性、渗透性而备受关注。特别是羟丙基-β-环糊精(2-Hydroxypropyl-β-cyclodextrin,HBC),因具有更高的水溶性、更低的毒性、更强的络合能力[19]而被优先考虑。相关研究也证实了通过HP-β-CD包合Ph形成根皮素/羟丙基-β-环糊精包合物(Phloretin/2-Hydroxypropyl-β-cyclodextrin in-clusion complex,Ph/HBC-IC),不仅能显著提升Ph的水溶性,还能进一步增强其抗氧化性能[20]。
Ph及Ph/HBC-IC在多个领域展现出了较大的应用潜力,但目前尚未有关于Ph/HBC-IC对细胞的固有毒性,及其对MGO诱导的ARPE-19细胞损伤的保护效果等方面的研究报道。为此,文章成功制备了Ph/HBC-IC,并对其进行了表征,利用CCK-8法探索了Ph及Ph/HBC-IC对细胞的固有毒性,并重点考察了其对MGO诱导ARPE-19细胞损伤的保护效果。研究结果将为Ph及Ph/HBC-IC的安全性和有效性评估提供重要的科学依据。
1材料与方法
1.1材料与试剂
根皮素(纯度≥98%),西安洛神生物科技有限公司;羟丙基-β-环糊精、无水乙醇、甲基乙二醛、二甲基亚砜,均购自上海泰坦科技股份有限公司;ARPE-19细胞株,上海誉弛生物科技有限公司;DMEM/F12(1∶1)培养基、青-链霉素混合液(100×)、CCK-8试剂盒、PBS缓冲液,均购自北京兰杰柯科技有限公司;四季青胎牛血清,浙江天杭生物科技股份有限公司;GIBCO胰蛋白酶,美国Thermo Fisher公司。
1.2仪器与设备
PB303-S/FACT电子天平,美国Mettler Toledo公司;XM-400ULF超声波清洗仪,小美超声仪器;DF-101Z集热式磁力搅拌器,上海析牛莱伯仪器有限公司;Scientz-25T真空冻干机,宁波新芝生物科技股份有限公司;JSM-IT500HR扫描电子显微镜,日本JEOL公司;Nicolet iS50傅里叶红外光谱仪,美国Thermo Fisher公司;D8 ADVANCE X射线衍射仪,德国布鲁克;LRH-70生化培养箱,上海一恒科学仪器有限公司;SW-CT-2D超净工作台,苏州净化公司;SpectraMaxM2酶标仪,美国Molecular De-vices公司;Centrifuge 5424离心机,德国Eppendort公司。
1.3试验方法
1.3.1包合物的制备方法
采用冷冻干燥法制备包合物。先称取适量HBC溶于30 mL去离子水中,再将适量Ph溶于5 mL无水乙醇中,边超声处理边搅拌直至完全溶解。将Ph-无水乙醇溶液缓慢滴加到HBC水溶液中,并持续超声20 min;将混合液转移至磁力搅拌器上,30℃搅拌3 h,完毕后自然冷却至室温,进行过滤处理,并将滤液放置在-20℃环境中冷冻48 h。最后放入冷冻干燥机中进行干燥处理,干燥至恒重,得到松散的包合物粉末。
1.3.2包合物的表征
1.3.2.1 FTIR分析
取适量Ph、HBC、物理混合物以及Ph/HBC-IC,并将其分别与KBr混合、压片。处理完成后,放入红外光谱仪中,在4 000~400 cm-1扫描范围内进行红外光谱测定。
1.3.2.2 SEM分析
取适量Ph、HBC、物理混合物以及Ph/HBC-IC,将其处理均匀后分别涂布于导电胶上,随后放入喷金仪中喷金使其具有导电性,并将喷金处理后的样品放入SEM中,通过调节相应参数来观察样品的形貌。
1.3.2.3 XRD分析
采用Cu-Kα射线,在管电压40 kV、管电流40 mA的条件下对Ph、HBC、物理混合物以及Ph/HBC-IC展开XRD分析。所有样品均在2θ的衍射范围内进行测量,范围为10~50 o,扫描速率为4 o/min。
1.3.3细胞培养
将ARPE-19细胞置于DMEM/F12(1∶1)培养基(含10%胎牛血清、1%青-链霉素混合液)中培养,并在37℃、5%CO2的培养箱中孵育,每2 d更换一次培养液,待细胞汇合度达到70%~80%时,进行传代培养。传代比例为1∶3,取对数生长期细胞开展后续实验。
1.3.4 MGO诱导ARPE-19细胞损伤最适质量浓度的确定
设置实验组和对照组,将ARPE-19细胞按照每孔约1×104个细胞的密度接种于96孔板中,且每组均设置3个复孔。将细胞置于培养箱中培养24 h后,弃去完全培养基。对照组仅加入无血清培养基;实验组则加入用无血清培养基稀释的不同质量分数的MGO溶液。继续培养24 h后,弃去培养基。随后,以换液的形式向每孔中加入用无血清培养基稀释的10%CCK-8溶液,并设置仅含有CCK-8试剂的空白对照组。将孔板放入培养箱中反应约1 h,并使用酶标仪在450 nm波长下测定各孔的吸光度值。细胞存活率的计算如式(1)所示。
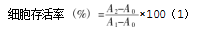
式中:A0为空白组的吸光度值,即仅含有培养基及CCK-8时的吸光度值;A1为对照组的吸光度值,即未经化合物处理的细胞的吸光度值;A2为实验组的吸光度值,即经过不同质量分数化合物处理的细胞的吸光度值。
1.3.5 Ph、HBC及Ph/HBC-IC对ARPE-19细胞的毒性作用
设置实验组和对照组,将ARPE-19细胞按照每孔约1×104个细胞的密度接种于96孔板中,且每组均设置3个复孔。将细胞置于培养箱中培养24 h后,弃去完全培养基。对照组仅加入无血清培养基;实验组则加入用无血清培养基稀释的不同质量浓度的Ph、HBC及Ph/HBC-IC溶液(稀释前可用少量二甲基亚砜溶解)。继续培养24 h后,弃去培养基。随后,以换液的形式向每孔中加入用无血清培养基稀释的10%CCK-8溶液,并设置仅含有CCK-8试剂的空白对照组。将孔板放入培养箱中反应约1 h,并使用酶标仪在450 nm波长下测定各孔的吸光度值。根据公式(1)计算细胞存活率。
1.3.6 Ph及Ph/HBC-IC对ARPE-19细胞的保护作用
设置实验组、对照组和模型组,将ARPE-19细胞按照每孔约1×104个细胞的密度接种于96孔板中,且每组均设置3个复孔。将细胞置于培养箱中培养24 h后,弃去完全培养基。对照组仅加入无血清培养基;模型组仅加入1 mmol/L的MGO溶液;将实验组细胞用不同质量分数的化合物孵育3 h后与1 mmol/L的MGO共处理,继续培养24 h后,弃去培养基。随后,以换液的形式向每孔中加入用无血清培养基稀释的10%CCK-8溶液,并设置仅含有CCK-8试剂的空白对照组。将孔板放入培养箱中反应约1 h,并使用酶标仪在450 nm波长处测定各孔的吸光度值。根据公式(1)计算细胞存活率。
2结果与分析
2.1包合物的表征
2.1.1 FTIR结果分析
红外光谱法主要通过吸收峰的波长、强度来判断分子中存在的基团,是表征常用的方法之一。Ph、HBC、物理混合物及Ph/HBC-IC的红外光谱图如图1所示。
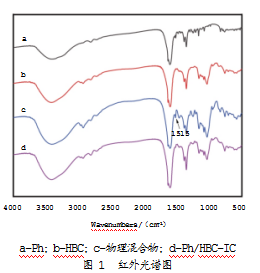
由Ph红外光谱图可知,在1 515 cm-1、1 529 cm-1处出现的是苯环伸缩振动吸收峰;1 605 cm-1、1 630 cm-1处出现的是C=C、C=O的拉伸振动吸收。通过HP-β-CD的光谱图可以观察到,在1 030 cm-1、1 084 cm-1、1 156 cm-1处有很强的吸收峰,这与C-O的拉伸振动有关;1 629 cm-1处出现了H-O-H弯曲振动峰;2 935 cm-1吸收峰与C-H伸缩振动有关;3 415 cm-1处出现的是-OH振动吸收峰。
物理混合物的光谱图只是单个组分吸收光谱的叠加,与HBC的光谱图十分相似。这是因为HBC与Ph分子的吸收在大部分光谱区域都是重叠的,同时Ph/HBC-IC光谱图也与HBC的光谱图基本一致。此外,通过物理混合物光谱图还可以看到,1 515 cm-1处有芳香环的特征峰,而此峰在Ph/HBC-IC的光谱图中并不存在。上述结果表明,Ph被包埋在HBC分子的空腔内,并形成了包合物。
2.1.2 SEM结果分析
通过扫描电子显微镜观察物质微观形貌,能够辅助表征包合物的形成。Ph、HBC、物理混合物及Ph/HBC-IC的SEM结果如图2所示。

从图2a可以看出,Ph的形态是不规则、呈细长条状的晶体结构;从图2b观察到,HP-β-CD呈现出了具有不同大小空腔结构的球形颗粒形态;通过图2c可以观察到大小不一的块状结构且有刺条状的Ph及部分破碎HBC的存在;图2d中Ph/HBC-IC呈现出小且均匀的团状晶体结构,且与Ph及HBC的表观存在显著差异。由此可以推断,这两种物质之间产生包和作用形成了包合物。
2.1.3 XRD结果分析
XRD是表征包合物一种常用的研究方法。Ph、HBC、物理混合物及Ph/HBC-IC的XRD图谱如图3所示。
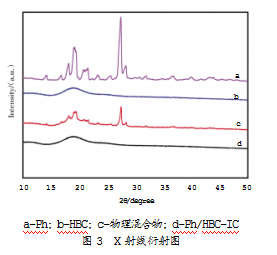
从XRD图谱可以看出,a-Ph在18.08、19.18、27.41、28.29的衍射角处出现了几个尖峰,表明其是以结晶态存在的;b-HBC的衍射峰仅为一条宽峰,缺乏结晶峰,表现出了无定形结构形式;c-物理混合物既具有HBC无定形的结构特征,又有Ph的结晶峰,这可能是两个样品的叠加,没有产生新的晶体;与此相反,d-Ph/HBC-IC的XRD图谱与HBC的XRD图谱基本一致,没有任何与Ph相对应的衍射峰,表明Ph已被成功包埋到了HBC空腔中,失去了结晶度。上述结果在一定程度上证实了包合物的形成。
2.2 MGO诱导ARPE-19细胞损伤最适浓度的选择
为验证Ph及Ph/HBC-IC对ARPE-19细胞的保护作用,需要先筛选出MGO造成细胞损伤的最适质量分数。不同质量分数MGO对ARPE-19细胞存活率的影响具体如图4所示。

数据显示,细胞经不同浓度的MGO处理24 h后,细胞存活率随MGO浓度升高而呈现出了下降趋势。当MGO浓度为1 mmol/L时,细胞存活率从对照组的101%±1.86%下降至62.55%±1.73%,表明此时的MGO浓度对细胞造成了中度损伤。因此,选择1 mmol/L的MGO浓度开展后续实验。
2.3 Ph、HBC及Ph/HBC-IC对ARPE-19细胞的毒性作用
为筛选出适合后续实验的Ph及Ph/HBC-IC质量分数,需要评估其对ARPE-19细胞的固有毒性。将细胞用不同质量分数的Ph、HBC及Ph/HBC-IC进行处理,并测定相应的细胞存活率,以确定不会对细胞产生显著影响的质量浓度范围。不同质量浓度Ph、HBC及Ph/HBC-IC对ARPE-19细胞存活率的影响具体如图5所示。
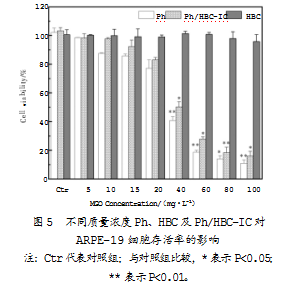
结果表明,HBC在5~100 mg/L质量浓度范围内无细胞毒性;与未经处理的对照组细胞相比,用质量浓度5、10、15 mg/L的Ph及Ph/HBC-IC处理对ARPE-19细胞存活率没有显著影响,表明在这些质量分数范围内,Ph及Ph/HBC-IC对细胞没有明显的毒性。随着质量分数不断提高,细胞存活率逐渐下降;当Ph和Ph/HBC-IC的质量浓度达到100 mg/L时,细胞存活率分别下降至10.96%±2.42%和15.88%±3.34%,意味着高质量浓度的Ph及Ph/HBC-IC对ARPE-19细胞具有显著毒性。因此,Ph及Ph/HBC-IC适合在0~20 mg/L的质量浓度范围内使用,且不必担心其固有的毒性作用。此外,还观察到在同一质量浓度下,Ph/HBC-IC对细胞的固有毒性要小于Ph,这与现有研究的结果相似[21,22]。推测其原因,可能是通过将Ph包裹在HBC的空腔内,可减少Ph在细胞外或细胞膜上的非特异性结合和相互作用,从而降低Ph对细胞的潜在损害。
2.4 Ph及Ph/HBC-IC对MGO诱导的ARPE-19细胞损伤的保护作用
根据上述实验结果,选择1 mmol/L的MGO与5、10、15 mg/L 3个质量浓度的Ph及Ph/HBC-IC开展后续实验。Ph及Ph/HBC-IC对MGO损伤ARPE-19细胞存活率的影响如图6所示。
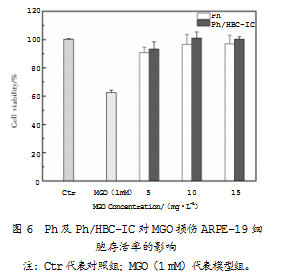
数据显示,与对照组相比,单独使用1 mmol/L的MGO进行细胞处理后,细胞存活率显著降低,由原来的100%下降至62.55%±1.73%,而若先将细胞用5、10、15 mg/L质量浓度的Ph及Ph/HBC-IC进行预处理,再与1 mmol/L的MGO共同处理,细胞存活率得到了显著提升。特别是当Ph及Ph/HBC-IC质量浓度达到15 mg/L时,细胞存活率较模型对照组分别提高到了82.95%±2.43%和91.22%±4.12%;与模型组相比,细胞存活率分别提高了20.4%和28.67%。上述结果表明,Ph及Ph/HBC-IC预处理降低了MGO对ARPE-19细胞的毒性。这是因为在一定条件下,Ph及Ph/HBC-IC能够快速捕获MGO[23],从而对ARPE-19细胞起到保护作用。值得注意的是,如图所示,Ph/HBC-IC对细胞的保护作用在一定程度上要强于Ph。究其原因,其一,相关研究表明,MGO是通过升高ARPE-19细胞的氧化应激水平来引起细胞损伤的[24],而Ph/HBC-IC的抗氧化活性显著强于Ph[20],从而使Ph/HBC-IC对细胞具有更好的保护作用;其二,包合物在一定条件下可能会解离成Ph和HBC。其中,Ph能够捕获MGO,同时HBC也能对MGO起到一定的包合作用。两种情况叠加,可以增强Ph/HBC-IC对细胞的保护作用。查阅相关国内外文献,并未发现对该种情况的研究探讨。因此,后续或可合理设计一系列试验来验证这一猜想正确与否。
3结论
文章采用冷冻干燥法制备得到了Ph/HBC-IC,并利用FTIR、SEM、XRD等手段对包合物进行表征,证实了包合物的形成。同时,通过CCK-8法检测细胞活力,成功构建了MGO诱导的ARPE-19细胞损伤模型,并评估了Ph及Ph/HBC-IC对细胞的固有毒性。结果显示,经包合的Ph的固有毒性显著低于Ph。根据上述结果,文章进一步探讨并证实了Ph及Ph/HBC-IC对MGO诱导的细胞损伤均具有明显的保护效果,且Ph/HBC-IC对细胞的保护效果要强于Ph本身。这一结论为Ph/HBC-IC的安全使用提供了可靠的数据支持,也为其作为抗糖药物及护肤品原料的开发和应用提供了更多可能性。
然而,文章仅对Ph及Ph/HBC-IC的保护效果进行了初步判断与探讨,尚未深入研究其具体的细胞保护机制。未来研究还需进一步围绕其作用机制展开探索,从而为扩大其应用范围提供全面的理论依据。
参考文献
[1]HEGAB Z,GIBBONS S,NEYSES L,et al.Role of ad-vanced glycation end products in cardiovascular disease[J].World Journal of Cardiology,2012,4(4):90-102.
[2]YAN S F,RAMASAMY R,SCHMIDT AM.The receptor for advanced glycation endproducts(RAGE)and cardio-vascular disease[J].Expert Reviews in Molecular Medicine,2009,11:e9.
[3]CHARNEY D I,WALTON D F,CHEUNG A K.Atherosclerosis in chronic renal failure[J].Curr Opin Nephrol Hypertens,1993,2(6):876-882.
[4]FARHEY Y,HESS E V.Accelerated atherosclerosis and coronary disease in SLE[J].Lupus,1997,6(7):572-577.
[5]RAHBAR S.Novel inhibitors of glycation and AGE for-mation[J].Cell Biochem Biophys,2007,48(2-3):147-157.
[6]REZK B M,HAAENEN G R M M,WIM J F VAN DER VIJGH,et al.The antioxidant activity of phloretin:the disclosure of a new antioxidant pharmacophore in flavonoids[J].Biochemical and Biophysical Research Commu nica-tions,2002,295(1):9-13.
[7]ZUO A R,YU Y Y,SHU Q L,et al.Hepatoprotective ef-fects and antioxidant,antityrosinase activities of phloretin and phloretin isonicotinyl hydrazone[J].Journal of the Chinese Medical Association,2014,77(6):290-301.
[8]李慧灵,周金林,卢宇靖,等.酶法催化柚皮苷制备根皮素及其抗氧化活性分析[J].现代食品科技,2020,36(12):69-76.
[9]PARK A,JEEONG H-H,LEE C-S,et al.The inhibitory effect of phloretin on the formation of Escherichia coli O157:H7 biofilm in a microfluidic system[J].Bio-Chip Journal,2012,6(3):299-305.
[10]刘娟.根皮素对光滑念珠菌的抗真菌活性及毒力因子作用的研究[D].石家庄:河北医科大学,2023.
[11]SUN Y S,LI W,LIU Z B.Preparative isolation,quantifi-cation and antioxidant activity of dihydrochalcones from Sweet Tea(Lithocarpus polystachyus Rehd.)[J].J Chromatogr B,2015,1002:372-378.
[12]李潭,孙一涵,李国峰.根皮素对脂多糖诱导的RAW264.7细胞的体外抗炎作用机制[J].中国免疫学杂志,2021,37(7):812-818.
[13]RUAN Q Q,WEN C M,JIN G H,et al.Phloretin-in-duced STAT3 inhibition suppresses pancreatic cancer growth and progression via enhancing Nrf2 activity[J].Phytomedicine,2023,118:154990.
[14]CHEN M,GOWD V,WANG M F,et al.The apple di-hydrochalcone phloretin suppresses growth and improves chemosensitivity of breast cancer cells via inhibition of cytoprotective autophagy[J].Food Function,2021,12(1):177-190.
[15]MARIADOSS A V A,VINAYAGAM R,SENTHILKU-MAR V,et al.Phloretin loaded chitosan nanoparticles augments the pH-dependent mitochondrial-mediated in-trinsic apoptosis in human oral cancer cells[J].Interna-tional Journal of Biological Macromolecules,2019,130:997-1008.
[16]KUMAR S,SINHA K,SHARMA R,et al.Phloretin and phloridzin improve insulin sensitivity and enhance glu- cose uptake by subverting PPARgamma/Cdk5 interaction in differentiated adipocytes[J].Experimental Cell Re-search,2019,383(1):111480.
[17]SHU G,LU N S,ZHU X T,et al.Phloretin promotes adipocyte differentiation in vitro and improves glucose homeostasis in vitro[J].The Journal of Nutritional Bio-chemistry,2014,25(12):1296-1308.
[18]XIA Y,FENG H,LI Z W,et al.Low-dose phloretin al-leviates diabetic atherosclerosis through endothelial KLF2 restoration[J].Bioscience,Biotechnology,and Biochem-istry,2020,84(4):815-823.
[19]GOULD S,SCOTT R C.2-Hydroxypropyl-β-cyclodex-trin(HP-β-CD):a toxicology review[J].Food and Chem-ical Toxicology,2005,43(10):1451-1459.
[20]WEI Y Q,ZHANG J,AMJAD HUSSAIN MEMON,et al.Molecular model and in vitro antioxidant activity of a water-soluble and stable phloretin/hydroxypropyl-β-cy-clodextrin inclusion complex[J].Journal of Molecular Liq-uids,2017,236:68-75.
[21]LI F J,YANG W X,KONG L G,et al.Host-guest in-clusion systems of podophyllotoxin withβ-cyclodextrin derivatives for low cytotoxicity[J].Journal of Drug Deliv-ery Science and Technology,2019,54:101280.
[22]姜兴粲,李冰,张继瑜.沙拉沙星/β-环糊精包合物的制备表征和细胞毒性研究[J].黑龙江畜牧兽医,2020,(24):129-133,177.
[23]SHAO X,BAI N S,HE K,et al.Apple Polyphenols,Phloretin and Phloridzin:New Trapping Agents of Reac-tive Dicarbonyl Species[J].Chemical Research in Toxi-cology,2008,21(10):2042-2050.
[24]周云丰,李琳,葛争艳等.黄芪甲苷对甲基乙二醛诱导的人视网膜色素上皮细胞损伤的保护作用研究[J].中国药理学通报,2017,33(7):915-921.










