穿心莲内酯纳米脂质载体的制备及表征论文
2025-02-26 17:22:30 来源: 作者:xuling
摘要:应用新剂型制备技术可更深入地研究穿心莲内酯的药用价值。文章采用熔融乳化-超声-低温固化法制备穿心莲内酯纳米脂质载体,并优化工艺参数。
摘要:应用新剂型制备技术可更深入地研究穿心莲内酯的药用价值。文章采用熔融乳化-超声-低温固化法制备穿心莲内酯纳米脂质载体,并优化工艺参数。结果表明,最佳条件为:单硬脂酸甘油酯和肉豆蔻酸异丙酯按1∶1比例复配,将吐温-80作为活性剂,药脂比值为1∶20,在75℃水浴下乳化60 min。该研究为开发穿心莲内酯提供了理论依据。
关键词:穿心莲内酯;纳米脂质载体;表征;工艺优化
穿心莲(Andrographis paniculata(Burm.f.)Nees)属爵床科植物[1-2],主要成分为穿心莲内酯(Andrographolide,AG)。AG具有广泛的药理作用,包括抗炎、抗菌、抗病毒等[3-4]。因此,深入开发AG,成为提升穿心莲药用价值的关键手段。目前上市的AG衍生物,大多通过成盐提高其溶解性,包括琥珀酸脱氢穿心莲内酯钠、琥珀酸脱氢穿心莲内酯钾和穿心莲内酯亚硫酸氢钠[5-6]。该类方法工艺复杂且周期较长,因此有必要开发新的AG制剂,如纳米脂质体(Nanostructured Lipid Carriers,NLCs)等。脂质体可将药物包裹在类脂双分子夹层中,达到良好的药物递送效果[7-9]。根据已有研究[10],本文对AG与纳米脂质体进行了组装及优化,对固液脂质种类、表面活性剂种类、固液脂质比值、药脂比值、乳化时间、水浴温度等影响因素进行了调整,并对其不同制备工艺下的包封率、粒径等进行了测量,以得到制备AG纳米结构脂质体(AG-NLCs)的最佳制剂处方及工艺,同时还对其进行了外形、晶型、红外和热吸收等表征分析。
1实验内容
1.1实验仪器及试剂
主要实验仪器:高效液相色谱仪(Agilent1260,安捷伦);马尔文粒度仪(Zetasizer Nano ZS,马尔文);冷冻离心机(Eppendorf5810R,赛默飞);透射电子显微镜(H-7650,HTACHI);差式扫描量热仪(梅特勒托利多);X-射线粉末衍射仪(SmartLab-9 kW,理学株式会社);傅立叶红外光谱仪(Nicolet 20,赛默飞)。
主要实验材料:单硬脂酸甘油酯(L51111,西亚化学);吐温-80(20200309,国药集团化学试剂);肉豆蔻酸异丙酯(C10005751,上海麦克林);油酸(k1929018,阿拉丁医药);穿心莲内酯(JZ21101107,南京景竹生物);硬脂酸(L28N10S104297,源叶生物)。
1.2 AG-NLCs的制备
将10 mg AG、100 mg肉豆蔻酸异丙酯、100 mg单硬脂酸甘油酯、2 mL无水乙醇于75℃水浴熔融作为油相;在30 mL蒸馏水中加0.5%吐温-80,75℃恒温水浴搅拌作为水相。将油相滴入水相中,保持75℃并搅拌乳化35 min,并将制得的初乳转移至300 W超声10 min,低温固化20 min后,即得AG-NLCs。NLCs同样用上述方法制备,但不加入AG。
1.3 HPLC法测定AG含量
精密称取AG对照品2.50 mg,置于5 mL容量瓶中,加甲醇定容至刻度,超声15 min,过0.22μm微孔滤膜,即得500μg/mL对照品储备液。色谱柱为安捷伦分析柱(Agilent5 TC-C18(2)250×4.6 mm),流动相为乙腈-水溶液(V:V=30∶70),流速为1.0 mL/min,检测波长为224 nm,柱温为25℃。
1.4包封率的检测
取所制AG-NLCs混悬液400μL至离心管中,3 000 r/min离心10 min,取上清液置于10 mL容量瓶内,乙腈定容至刻度,过0.22μm微孔滤膜后检测。记录峰面积,计算游离AG的含量,记为W1。另取400μL混悬液至5 mL容量瓶内,使用乙腈破乳后定容。同法检测,计算总AG含量,记为W2。按下述公式计算包封率:EE%=(W2-W1)/W2×100%。
1.5粒径的检测
取适量AG-NLCs加入马尔文粒度仪,测定其粒径和聚合度指数(Polydispersity Index,PDI)。
1.6 AG-NLCs的处方工艺优化
利用单因素试验对处方制备工艺的相关因素进行考察,包括固液脂质种类、表面活性剂种类、固液脂质比、药脂比、乳化时间和水浴温度,以筛选最佳水平,完成制备工艺优化。
1.7 AG-NLCs的表征
透射电镜法:将固化后的AG-NLCs样品用冷冻冻干机制备为干粉,分散在乙醇溶液中。同时,选择普通碳支持膜作为载网,使用滴管吸取分散液滴加至载网正面,待溶解挥干检测。
傅立叶红外光谱测试(FT-IR):分别将AG、NLCs、AG-NLCs、AG+NLCs混合物使用冷冻冻干机除尽水分并干燥,各称量12 mg,并各自与200 mg的KBr研磨,置于磨具中,以适当压力在油压机上压成透明薄片后上样检测。
X射线衍射分析(XRD)包封情况:将待测样品研磨至粒径为48μm左右的粉末,其间不断过筛分离达标样品。研磨完毕后,将样品装载在显微镜载玻片上,滴加2滴乙醇,使粉末成薄浆状后均匀涂抹在载玻片上,待溶剂挥干后检查。
差示扫描量热分析(DSC):参比物为铝空坩埚,氮气吹扫,扫描范围为30~300℃,分别对AG、NLCs、AG-NLCs、AG+NLCs物理混合物进行扫描。
2结果分析
2.1 AG-NLCs含量测定方法学的建立结果
2.1.1专属性试验
取配制好的AG-NLCs、NLCs和AG对照品溶液,根据前述条件进行测定,并记录色谱图(见图1)。AG的保留时间为13 min,而NLCs的HPLC图谱在4 min处有最高峰,表明在该方法下,NLCs与AG均有自己的特征峰且互不干扰。
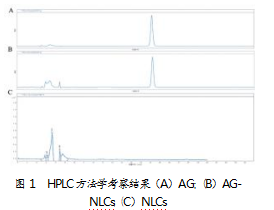
2.1.2线性关系考察
取配制好的500μg/mL AG对照品溶液储备液,分别配制成5、10、25、50、100、200μg/mL的AG对照品溶液,进样测定并记录峰面积。以峰面积为纵坐标,以溶液质量浓度为横坐标,绘制标准曲线,并得到回归方程Y=26.345X+34.553,R2=0.999 1。该结果表明,在5~200μg/mL的质量浓度范围内,峰面积与质量浓度呈线性正相关。
2.1.3检测限和定量限考察
按照2020版《中国药典》检测限(LOD)和定量限(LOQ)的测定方法,采用基于响应值标准偏差和标准曲线斜率法计算。按该公式计算得到:LOQ=10δ/S;LOD=3.3δ/S(注:δ为响应值的偏差,S为标准曲线的斜率)。δ为11.105,S为26.345,计算得到LOD为1.391μg/mL,LOQ为4.215μg/mL,符合药典要求。
2.1.4精密度考察
取同份AG对照品溶液,连续进样测定6次,记录峰面积。结果表明,AG峰面积的RSD值为0.24%,表明仪器精密度良好。
2.1.5加样回收率
取已知含量的AG-NLCs 9份,并精密加入已知含量的对照品溶液,按前述条件进行样品处理并进样测定,计算加样回收率。结果显示,AG的平均加样回收率为100.48%(n=9),表明该方法的准确度较高。
综上所述,所建立的AG-NLCs含量测定方法在一定质量浓度范围内测定精密度和准确度良好,可用于AG-NLCs中的AG测定。
2.2 AG-NLCs处方工艺优化结果
固-液脂质考察结果:选择单硬脂酸甘油酯、硬脂酸作为固体脂质;肉豆蔻酸异丙酯、油酸作为液体脂质。将上述四者进行两两搭配后制备AG-NLCs,并测试相关数据。结果显示,4种搭配方案下的包封率较好,均在80%以上。其中,以单硬脂酸甘油酯+肉豆蔻酸异丙酯进行搭配时较为理想,包封率为83.01%,粒径为140.5±1.747 nm,PDI为0.179±0.006。
表面活性剂考察结果:选择泊洛沙姆188、吐温-80和十二烷基磺酸钠为表面活性剂制备AG-NLCs,并测试相关数据。结果表明,吐温-80具有粒径小、分布均一,以及包封率高的优点。
固液脂质比值考察结果:固定其他因素,考察固液脂质比值分别为1:1、1:4、1:8、4:1、8:1时,对结果的影响。结果表明,在固液脂质比值为1:1时,粒径、PDI、包封率最佳。
药脂比值考察结果:考察药脂比值分别为1:5、1:10、1:15、1:20、1:25时,对结果的影响。结果显示,药脂比值对包封率的影响较大,且没有显著正、负相关趋势,但各比例下纳米脂质载体的粒径均为200 nm左右,粒径均一程度较高,维持在0.2左右,且在药脂比值为1:20时,包封率最高。
搅拌时间考察结果:在一定时间范围内,乳化时间越短,所形成的脂质颗粒粒径越大,分布越不均一。结果显示,包封率与乳化搅拌时间存在较大关联性,且两者不呈线性相关。当时间为60 min时,包封率最大。
水浴温度考察结果:结果显示,温度的影响较为明显,粒径大小极值差异为316.1 nm,包封率差值为50.63%。在75℃下,粒径和PDI有最小值,且包封率达最高值。
综上,最佳制备工艺条件为:使用单硬脂酸甘油酯+肉豆蔻酸异丙酯作为固液搭配,将吐温-80作为活性剂,固液脂质比值为1:1、药脂比值为1:20,水浴75℃下搅拌60 min。
2.3 AG-NLCs结构表征结果
外形特征:通过透射电镜观察到,AG-NLCs外观圆整、颗粒分明,整体分布较为均一;其大小分布范围为150~200 nm。
粒径测定结果:测试结果发现,AG-NLCs平均粒径为164.7 nm,在电镜测试范围内;PDI平均值为0.169,表明其粒径分布范围较为均匀。
FT-IR表征结果:FT-IR测试结果显示(见图2A),在原料药AG的FTIR谱图中,1 647 cm-1出现羰基的特征吸收峰,2 700~3 100 cm-1范围内出现甲基、亚甲基及次甲基的伸缩振动;在AG-NLCs谱图中,原本代表AG的以上特征峰消失,猜想可能是由于AG的部分基团与脂质中的有关基团发生了相互作用,使得原本基团发生了偏移或消失,形成了AG-NLCs。
XRD表征结果:XRD测试结果显示(见图2B),在AG和物理混合物的XRD图谱中,衍射峰众多且相近,说明物理混合并未改变AG晶型状态,而制备成AG-NLCs后,晶体衍射效应消失,表明生成了无定型的AG+NLCs。
DSC表征结果:DSC测试结果显示(见图2C),AG原料药在235℃左右出现强吸热峰,而AG-NLCs在此处的吸收峰消失,且在160℃左右出现吸热峰,证明了AG-NLCs是一种不同于AG的新物相。
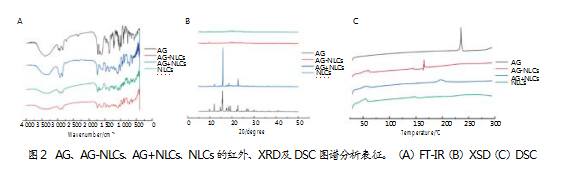
3讨论
本文采用熔融乳化-超声-低温固化法成功制备了AG-NLCs,并通过单因素法优化得到了最佳制备工艺:固液脂质分别为单硬脂酸甘油酯+肉豆蔻酸异丙酯,两者按1∶1比例搭配,将吐温-80作为活性剂,药脂比值为1∶20,乳化时间60 min,搅拌温度75℃。最终得到包封率较高的纳米脂质载体,制得的药物载体圆整均匀、类球形,粒径为160 nm左右,晶型和物相发生了改变。该方法为AG新剂型的制备和开发应用提供了参考,为提升AG的药用价值提供了实验基础。
参考文献
[1]张晓,唐力英,吴宏伟,等.穿心莲现代研究进展[J].中国实验方剂学杂志,2018,24(18):222-234.
[2]邵艳华.穿心莲种质资源及其质量评价研究[D].广州:广州中医药大学,2015.
[3]秦慧真,林思,邓玲玉,等.穿心莲内酯药理作用及机制研究进展[J].中国实验方剂学杂志,2022,28(6):272-282.
[4]母育成,邢相宜,晏子俊,等.穿心莲内酯的抗菌作用研究进展[J].贵州中医药大学学报,2021,43(1):85-89.
[5]SOO L H,QUAH Y S,SULAIMAN I,et al.Advances and challenges in developing andrographolide and its analogues as cancer therapeutic agents[J].Drug Discovery Today,2019,24(9):1890-1898.
[6]LIU W,FAN T,LI M,et al.Andrographolide potentiates PD-1blockadeimmunotherapyby inhibiting COX2-mediated PGE2 release[J].International Immunopharmacology,2020,81:106206.
[7]许杜娟,刘萌芽,刘改枝,等.穿心莲内酯新剂型研究进展[J].中国新药杂志,2021,30(13):1207-1212.
[8]王兴芝,代英辉,王东凯.脂质体的制备方法及应用的研究进展[J].中国药剂学杂志(网络版),2024,22(1):14-24.
[9]顾华芳,徐歌,朱柯武,等.脂质体主动载药技术研究进展[J].中国药剂学杂志,2021,19(6):173-185.
[10]苏晓丹,麦琬婷,钟华帅,等.Box-Behnken设计-效应面法优化岩黄连碱纳米结构脂质载体处方工艺及体外药效评价[J].中草药,2022,53(22):7019-7028.










