不同生长阶段白条双锯鱼肠道微生物菌群结构多样性研究论文
2025-02-26 16:57:59 来源: 作者:xuling
摘要:文章通过收集人工养殖的3月龄、6月龄、12月龄、18月龄的白条双锯鱼(amphiprion frenatus)肠道样品,分别提取其肠道DNA,经PCR扩增后对16S rDNA的V3~V4区进行高通量测序,分析其肠道微生物菌群结构的组成差异。
摘要:文章通过收集人工养殖的3月龄、6月龄、12月龄、18月龄的白条双锯鱼(amphiprion frenatus)肠道样品,分别提取其肠道DNA,经PCR扩增后对16S rDNA的V3~V4区进行高通量测序,分析其肠道微生物菌群结构的组成差异。结果表明,3月龄和18月龄的白条双锯鱼的肠道内OTU数量、Chao1指数、Shannon指数和Simpson指数较其他阶段更高,显示出更加丰富的物种多样性。在门水平上,白条双锯鱼肠道微生物的主要优势菌门为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和梭杆菌门(Fusobacteria);在属水平上,其主要优势菌属包括发光菌属(Photobacterium)、假单胞属(Pseuomonas)、无色杆菌属(Achromobacter)。文章的研究结果给观赏鱼养殖饵料筛选和益生菌试剂研发提供了一定理论支撑。
关键词:白条双锯鱼;肠道微生物;高通量测序;观赏鱼
白条双锯鱼(A mphiprion frenatus)隶属鲈形目(Perciformes)双锯鱼属(A mphiprion),其肠道内部存在种类繁多、数量庞大的微生物菌落[1]。鱼类肠道中的微生物群落主要分为原籍菌群(autochthonous flora)和外籍菌群(allochthonous flora)[2]。原籍菌群存在于消化道黏膜表面,且不会轻易随外界环境变化而变化;外籍菌群指短暂存在、自由生活于消化道内部的相关微生物群。Christos等[3]研究指出,微生物群落的稳定性很大程度上取决于肠道环境和养殖环境,可保持肠道环境的相对平衡与稳定,加之宿主提供的稳定环境,这两种因素对鱼类的生长与免疫具有重要作用。现有研究已揭示[4-5],不同发育程度与不同生长阶段的大口黑鲈、齐口裂腹鱼等鱼类肠道微生物菌群的多样性及丰度存在动态差异,同时其多种代谢功能也存在明显差异。然而,学界目前对处于不同生长阶段的观赏性海水鱼类肠道微生物菌群结构多样性的关注较少,仍有很大的研究空间。
本文基于高通量测序技术,以处于不同生长阶段的白条双锯鱼为实验对象,在门和属的水平上,分析不同生长阶段白条双锯鱼的肠道优势菌群,旨在为养殖过程中筛选、添加和研发具有针对性的饲料及微生物益生菌试剂等提供参考。同时,研究结果对优化小丑鱼养殖过程、调控水质、监测鱼病等方面也具有重要意义。
1实验材料与方法
1.1实验用鱼及其养殖方式
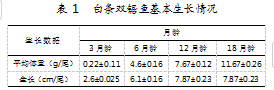
实验用鱼取自中国水产科学研究院南海水产所深圳试验基地5号车间同一循环海水养殖的白条双锯鱼(见表1)。分别选取3月龄小丑鱼10尾(2022年5月采集)、6月龄小丑鱼3尾(2022年8月采集)、12月龄小丑鱼3尾(2023年2月采集),以及18月龄小丑鱼3尾(2023年8月采集)。
养殖系统中养殖水体基本水质指标为:温度保持在27±1℃、盐度为28咖~32咖、pH为7.5~8.5、溶解氧含量大于5 mg/L、氨氮含量小于0.1 mg/L、亚硝酸盐含量小于0.01 mg/L。每日定时定点投喂3次(8∶00,12∶00,17∶00),且每5 d换水1次,换水量为养殖水体的10%~20%。
1.2样品分组与采集
1.2.1样品分组
实验共采得12管样品:4个不同生长阶段的小丑鱼样本各3管。将第一次采集的3月龄小丑鱼样本(2022年5月)命名为实验组A,依次为A1、A2、A3样管(下同);将6月龄样本命名为实验组B;将12月龄小丑鱼样本为实验组C;将18月龄样本为实验组D。
1.2.2采样操作
对取样操作台和实验操作器材作消毒灭菌处理,取样前用70%酒精擦拭鱼体表面进行消毒,注射MS—222麻醉剂麻醉小丑鱼,且采样时需保证实验操作的无菌性。用无菌解剖剪将小丑鱼从肛门处剪至头部,取出其内脏团,挑出肠道,并将肠道内含有内容物的一截剪下取出,放置在含有DNA样本保存液的2 mL离心管中。待取样完成,立即将样品盒置于-80℃冷冻箱冷冻保存。
1.3 DNA提取及16sDNA高通量测序
采样完成后,将样本送至广州美格基因科技有限公司进行检测,同时按照MagaBio基因组DNA纯化试剂盒(BSC48L1E-G)说明书进行DNA提取,在515F和806R引物对V3~V4区的引物序列进行测序,并使用带barcode的特异引物及TaKaRa Premix Taq®Version 2.0(TaKaRa Biotechnology Co.,Dalian,China)进行PCR扩增。之后按照NEBNext®UltraTMⅡDNA Library Prep Kit for Illumina®(NewEnglandBiolabs,USA)标准流程进行建库操作,并使用Illumina Nova 6000平台对构建的扩增子文库进行PE250测序。
1.4测序分析方法
将样品PCR扩增产物测序后拼接成Tag,并根据Tag进行物种分类、OTU分析、多样性分析、多样品比较分析等。使用R软件进行α多样性指数组间差异分析,计算97%相似度下的OTU数量、Chao1指数、Shannon指数和Simpson指数。
2实验结果与分析
2.1不同生长阶段白条双锯鱼肠道微生物α多样性差异结果分析
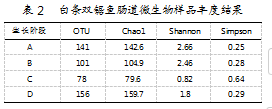
实验样品测序结果经过处理后发现,各样品中的Tag数量在91 271~118 679条的范围内波动,测序长度范围为290~310 bp。利用Mothur计算OTU数量,再基于OTU计算样品α的多样性,其结果如表2所示。各生长阶段的平均OTU数量依次为D阶段(156)>A阶段(141)>B阶段(101)>C阶段(78);Chao1指数趋势与此相似,且D阶段(159.7)指数最高,说明D生长阶段白条双锯鱼肠道内部的物种多样性最强;Shannon指数表现为A、B阶段较大,C阶段指数最小;Simpson指数结果与Shannon指数相反,呈现为C阶段最大,A阶段最小。综合比较Chao1指数、Shannon指数与Simpson指数可知,白条双锯鱼肠道微生物的多样性在D阶段最丰富,其次是A阶段、B阶段,而C阶段的物种多样性及丰富度最低。
2.2不同生长阶段白条双锯鱼肠道微生物在门水平物种组成差异结果分析
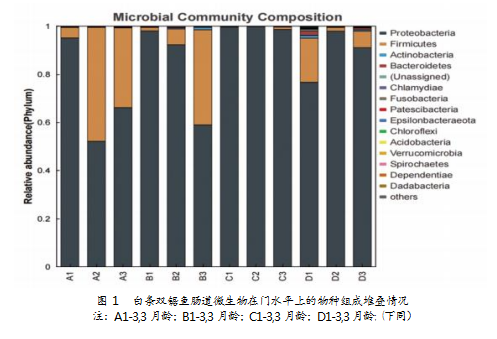
不同生长阶段白条双锯鱼肠道微生物的主要门类分析如下(见图1):变形菌门(Proteobacteria)在A、B、C、D生长阶段均为优势菌门,且在C生长阶段的优势最为突出,表现为C期(99.41%)>D期(84.18%)>B期(82.18%)>A期(70.13%);厚壁菌门(Firmicutes)在A生长阶段为优势菌门,随生长阶段推进,呈现先减后增的趋势;放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)在D生长阶段为优势菌门。白条双锯鱼肠道微生物在门水平上的物种组成堆分析结果显示(见图1),衣原体门(Chlamydiae)、梭杆菌门(Fusobacteria)、超级变形门(Patescibacteria)、绿弯菌门(Chloroflexi)和酸杆菌门(Acidobacteria)随着生长阶段的推进,大致呈先降后增的变化趋势;埃普西隆杆菌门(Epsilonbacteraeota)、疣微菌门(Verrucomicrobia)则随着生长阶段推移呈增长趋势。
2.3不同生长阶段白条双锯鱼肠道微生物在属水平物种组成差异结果分析
不同生长阶段白条双锯鱼肠道微生物的主要种属分析显示(见图2),在已知的分配菌属中,A阶段优势菌属为弧菌属(Vibrio),平均占比为11.26%,其次是发光菌属(Photobacterium)、希瓦氏菌属(Shewanella),平均占比分别为9.30%和7.06%;B阶段优势菌属为假单胞菌属(Pseudomonas),平均占比为30.88%,其次是发光菌属(Photobacterium)、无色杆菌属(Achromobacter),平均占比分别为15.60%和20.13%;C阶段优势菌属为发光菌属(Photobacterium),平均占比为44.32%,其次分别是假单胞菌属(Pseudomonas)、希瓦氏菌属(Shewanella),占比分别为2.28%和2.96%;D阶段优势菌属为假单胞菌属(Pseudomonas),平均占比为33.77%,其次是无色杆菌属(Achromobacter)、罗尔斯通菌属(Ralstonia),分别占比33.48%和8.10%。
从白条双锯鱼肠道微生物在属水平上的物种组成堆叠情况(见图2)来看,随着生长周期的推进,发光菌属呈先增加后减少的变化趋势;希瓦氏菌属呈先减少后增加再减少的变化趋势;假单胞菌属、无色杆菌属、罗尔斯通菌属、普拉梭菌属(Faecalibaculum)、卡氏伯克霍尔德菌(Burkholderia-Caballeronia-Paraburkholderia)、根瘤菌属(Bradyrhizobium)和嗜冷菌属(Psychrobacter),其变化趋势大致呈现先增加后减少再增加的趋势;弧菌属、肠弧菌属(Enterovibrio)、罗姆布茨菌属(Romboutsia)总体呈下降趋势。

3讨论
3.1不同生长阶段白条双锯鱼肠道菌群多样性分析
对测序结果进行α多样性分析可得:D生长阶段的OTU数量和Chao1指数的高于均其他三阶段,说明D阶段白条双锯鱼肠道微生物的群落丰度最大,丰度大小的排列次序为D阶段>A阶段>B阶段>C阶段。随着养殖周期的推进,肠道内微生物的种群丰度呈现先降后升的趋势,结合Shannon多样性指数与Simpson指数来看,A阶段白条双锯鱼的肠道微生物的多样性最高,总体表现为A阶段>B阶段>D阶段>C阶段,同时研究还发现肠道内微生物菌群的多样性大致呈降低趋势。Navarrete等[6]表明,鱼类会根据食物饵料的消化需求,逐渐形成与其饮食习性相匹配的肠道微生物群落,同样也揭示了不同生长阶段的白条双锯鱼肠道微生物群落展现出明显多样性和差异的原因。
3.2门和属水平上不同生长阶段白条双锯鱼肠道菌群结构分析
门水平上的测序结果分析显示,4个不同生长阶段的白条双锯鱼肠道内的变形菌门、厚壁菌门为优势菌门,所占比例之和均达到95%以上,此外还存在梭杆菌门等。已有研究人员发现[4],虽然不同鱼类的肠道微生物组成存在差异,但变形菌门、厚壁菌门和梭杆菌门多处于优势菌门的地位。Feng等[7]也证实了变形菌门在鱼类肠道内的优势地位。由此可见,本研究中白条双锯鱼肠道内的优势菌门与前人研究是基本相符的。Semova等[8]发现,鱼类肠道内的厚壁菌门在促进脂肪吸收和促进脂滴形成方面起关键作用,有助于机体吸收并应用碳水化合物。本研究中,4个不同生长阶段的白条双锯鱼肠道内厚壁菌门的占比皆呈现先降后升趋势,表现为生长中期鱼类脂肪囤积较少,能量主要用于生长;生长后期鱼体脂肪增多,生长速率则相对放缓,这可能与鱼在不同生长过程中接受的混合饲料有关。梭杆菌门[4]能够发酵多糖和蛋白质产生乙醇、短链脂肪酸,为肠道消化过程提供必需的代谢能量。
在属水平上的测序结果分析显示,4个不同生长阶段白条双锯鱼肠道内主要优势菌属为发光菌属和假单胞属,其次是希瓦氏菌属。Elizabeth等[9]研究指出,假单胞菌属为海水鱼类消化道内部的常见菌属;发光菌属和希瓦氏菌属包含发光细菌,主要作用表现为无须拨动水体即可看到养殖水体均匀发光,被广泛用于海水养殖业。这种艳丽的体色特征也使白条双锯鱼成为热门海水观赏鱼。
以上在门与属水平上的研究表明,虽然不同生长阶段的白条双锯鱼肠道微生物的菌群组成基本一致,但不同阶段微生物菌群相对比例的呈现却存在一定差异,且这些差异能大概反映出不同生长阶段鱼类肠道微生物群落结构和动态变化及其对内、外环境变化的适应性。
4结论
不同生长阶段白条双锯鱼肠道微生物菌群的组成整体一致,但比例差异显著,这可能与鱼自身的生长特性、饮食习性及其对水质环境变化的适应性有关。研究揭示,鱼类肠道微生物菌群除了吸收养殖过程饲喂的饵料营养,还在能量平衡、行为、肠道运动、水的再吸收、大脑发育和大脑功能等方面发挥着重要作用[2]。因此,明确白条双锯鱼肠道内部菌群结构的变化趋势,了解不同生长阶段肠道内部的菌群特征,对养殖饲料筛选和养殖益生添加制剂的生产实践具有重要意义,有助于推动鱼体健康快速生长,提升养殖效率与经济效益。
参考文献
[1]李改娟,赵全东,高娜,等.鱼类健康与肠道微生物关系研究进展[J].河北渔业,2020(8):56-58.
[2]BANERJEE G,RAY A K.Bacterial symbiosis in the fish gut and its role in health and metabolism[J].Symbiosis,2017,72(1):1-11.
[3]GIATSIS C,SIPKEMA D,SMIDT H,et al.The impact of rearing environment on the development of gut microbiota in tilapia larvae[J].Scientific Reports,2015,5(1):18206.
[4]但言,余凤琴,李双,等.不同生长阶段大口黑鲈肠道微生物多样性研究[J].西南农业学报,2021,34(12):2798-2803.
[5]XU H X,REN J D,XU X J,et al.The composition and diversity of intestinal microbes at different growth stages of giant freshwater prawns(Macrobrachium rosenbergii)[J].Fishes,2023,8(9):473.
[6]NAVARRETE P,MARDONES P,OPAZO R,et al.Oxytetracycline treatment reduces bacterial diversity of intestinal microbiota of atlantic salmon[J].Journal of Aquatic Animal Health,2008,20(3):177-183.
[7]FENG J B,HU C Q,LUO P,et al.Microbiota of yellowgrouper(Epinephelus awoora Temminck&Schlegel,1842)fed two different diets[J].Aquaculture Research,2010,41(12):1778-1790.
[8]SEMOVA I,CARTEN J D,STOMBAUGH J,et al.Microbiota regulate intestinal absorption and metabolism of fatty acids in the zebrafish[J].Cell Host Microbe,2012,12(3):277-288.
[9]GRICE E A,KONG H H,CONLAN S,et al.Topographical and temporal diversity of the human skin microbiome[J].Science,2009,324(5931):1190-1192.










