不同方法制备绿豆抗性淀粉的理化性质与结构特征研究论文
2025-02-26 15:45:38 来源: 作者:xuling
摘要:文章采用压热冷却循环(MRS-A)、酶解(MRS-B)和超声联合酶解法(MRS-C)制备绿豆抗性淀粉,并对其理化性质和结构特征差异展开详细分析。
摘要:文章采用压热冷却循环(MRS-A)、酶解(MRS-B)和超声联合酶解法(MRS-C)制备绿豆抗性淀粉,并对其理化性质和结构特征差异展开详细分析。粒径分布、XRD、DSC、FTIR及SEM结果显示,MRS-C为B+C晶体,与MRS-A和MRS-B相比,具有更多的抗性淀粉含量、更大的粒径、更高的结晶度、更有序和稳定的双螺旋结构、更高的热稳定性以及更粗糙的表面形状。相关性分析结果表明,MRS-C的抗性淀粉含量与直链淀粉含量、结晶度、糊化焓和R1047/1022呈显著正相关,与平均粒径呈正相关,而与支链淀粉含量呈显著负相关。这一发现,为绿豆抗性淀粉在功能性食品中的开发和应用奠定了理论基础。
关键词:绿豆抗性淀粉;压热冷却循环;酶解;超声联合酶解
现有研究发现,抗性淀粉(RS)无法被健康人体小肠所消化吸收[1],一般在食用2 h后到达结肠,并经肠道菌群发酵产生短链脂肪酸等有益代谢产物[2]。RS作为一种新型膳食纤维,具有预防结肠癌、降血糖、降低胆固醇和抑制脂肪堆积等功能[3-5]。研究表明,日常饮食中全谷物比例的增加与肥胖和糖尿病风险的降低密切相关,主要是因为全谷物中含有大量非淀粉多糖和抗性淀粉。此外,RS的特殊结构赋予了其高透明度、持水性、膨胀力和热稳定性等理化性质[6],使得RS在功能性食品加工行业中具有良好的应用发展前景。
目前主要利用玉米淀粉和马铃薯淀粉来制备抗性淀粉,而较少使用豆类淀粉。绿豆是我国的主要食用豆类之一,富含淀粉、蛋白质和矿物元素。其淀粉含量约占60%,且直链淀粉含量较高,目前主要用于生产制作粉丝、粉条和糕点等传统食品,加工水平不高,附加值较低。因此,将绿豆淀粉作为原料,通过不同方法改变绿豆淀粉的结构特征,可改善其理化性质,提高抗性淀粉含量,这对于提高绿豆淀粉及其抗性淀粉的产品附加值以及深化其在功能性食品加工行业的应用具有重要意义。
然而,当前关于利用不同方法制备的绿豆抗性淀粉理化性质和结构特征间联系的研究较少。制备抗性淀粉的常用方法有压热冷却循环法、超声法、酶水解法等[7]。压热冷却循环法属于物理加工方法,原理是在压热糊化过程中破坏淀粉颗粒结构,使淀粉分子重排,并在冷却回生过程中促进RS生成,所得产品安全性较高。超声波技术属于绿色加工技术,具有独特的机械效应和空化效应,可提高传质和反应效率。超声联合酶解可增加底物与酶的接触面积,提高酶解反应效率,促进RS形成。文章旨在通过压热冷却循环、酶解和超声联合酶解法制备绿豆抗性淀粉,增加其抗性淀粉含量,测定其理化性质和结构特征,并开展相关性分析。研究结果为提高绿豆抗性淀粉的产品附加值以及深化其在抗消化性食品中的应用提供了理论支持。
1材料与方法
1.1材料与试剂
绿豆粉,购自市场;普鲁兰酶,购自Sigma公司;总淀粉、抗性淀粉和直链淀粉/支链淀粉检测试剂盒,购自Megazyme公司。所有其他化学品和试剂均为分析纯。
1.2绿豆淀粉的制备及基本成分测定
根据Shah等[8]描述的方法制备绿豆淀粉(MS),将绿豆粉与蒸馏水1:8(W/V)混合,再用NaOH调节pH至10,40℃水浴并持续搅拌3 h。随后过孔径150μm目筛,将滤液以4 000 rpm的速度离心10 min,收集沉淀。刮掉棕色的上层,用蒸馏水冲洗下方白色部分3次,并在40℃烘箱中干燥,得到MS。MS蛋白质、脂肪和水分含量的检测均按照国标方法进行。
1.3绿豆抗性淀粉的制备
1.3.1压热冷却循环法制备绿豆抗性淀粉MRS-A
参考Xia等[9]的方法,将绿豆淀粉和蒸馏水以1:5(W/V)混合,并在121℃高压灭菌30 min。冷却至室温,在4℃环境中放置24 h。重复一次上述操作。最后,干燥样品,磨粉并过筛,得到MRS-A。
1.3.2普鲁兰酶酶解法制备绿豆抗性淀粉MRS-B
将绿豆淀粉和蒸馏水1:20(W/V)混合,沸水浴搅拌20 min,冷却至50℃,并用HCl调节pH至5,加入普鲁兰酶(27.5 npun/g淀粉),在50℃酶解12 h。在沸水浴中加热10 min,冷却至室温,并在4℃环境中放置24 h。最后,干燥样品,磨粉并过筛,得到MRS-B。
1.3.3超声联合普鲁兰酶酶解法制备绿豆抗性淀粉MRS-C
基于1.3.2中的操作,将普鲁兰酶加入绿豆淀粉溶液,并将其240 W超声处理10 min,后50℃酶解12 h。在沸水浴中加热10 min,冷却至室温,并在4℃环境中放置24 h。最后,干燥样品,磨粉并过筛,获得MRS-C。
1.4总淀粉、抗性淀粉及直链淀粉含量的测定
总淀粉、抗性淀粉及直链淀粉含量的检测均使用试剂盒,按照说明书进行。
1.5溶解度与膨胀力
根据Liu等[10]的方法,将M1淀粉样品质量(g)加入蒸馏水,得到2%(W/V)淀粉溶液。将淀粉溶液分别在30、50和90℃下连续加热搅拌30 min。冷却至室温后,4 000 g离心10 min。收集上清液,105℃干燥并称取,记录为M2质量(g),沉积物质量(g)记录为M3。
溶解度(%)=100×M2/M1(1)
膨胀力(g/g)=M3/(M1-M2)(2)
1.6透明度与持水能力
将淀粉溶液(1%,W/V)在沸水浴中搅拌30 min,并冷却至室温。以蒸馏水为空白对照,检测淀粉溶液在620 nm波长处的透射率。
将淀粉样品(0.4 g,W1)与15 mL蒸馏水混合,37℃放置1 h,并3 000 g离心10 min。弃去上清液,称量沉积物质量W2。
持水力(%)=100×W2/W1。(3)
1.7颗粒形态
使用日立Gemini 300扫描电子显微镜(SEM)在200×和2 000×的放大倍率,并在1.0 kV的加速器电位下测定淀粉样品的颗粒形态。
1.8粒径分布
淀粉样品的粒径分布采用Mastersizer 2000进行测量。将250 mg样品加入50 mL蒸馏水中,混合后测定粒径分布。淀粉样品和蒸馏水的折射率分别设定为1.52和1.33。计算并记录样品的粒径参数:D[4,3]体积平均粒径、D[3,2]表面积平均粒径,以及Dv[10]、Dv[50]、Dv[90](淀粉体系中占百分比为10%、50%和90%淀粉颗粒的粒径)。
1.9热特性
使用差示扫描量热仪(DSC)研究淀粉样品的热特性。称量3.0 mg干燥的淀粉样品放置到坩锅中,并加入6 mL蒸馏水。将坩锅以10℃/min的速度从20℃加热到200℃。
1.10 X射线衍射
使用X射线衍射仪(XRD)记录样品的X射线图谱。衍射仪的工作电压和电流分别为40 kV和40 mA。衍射角(2q)的扫描范围为5~40 o,扫描速率为6 o/min。结晶度是结晶区域面积与结晶区域和非结晶区域面积之和的百分比。
1.11傅里叶变换红外(FTIR)光谱
将淀粉样品的FTIR光谱在光谱仪上进行分析。将2 mg干燥的淀粉样品与150 mg KBr混合并压成薄片。光谱仪的扫描波长为4 000~400 cm-1,分辨率为每4 cm-1扫描16次。
1.12统计分析
数据表示为平均值±标准偏差,采用Tukey检验(P<0.05)的方差分析来进行实验数据分析。采用SPSS 22.0进行统计分析,且不同的小写字母表示差异显著。
2结果与讨论
2.1各组样品的总淀粉、抗性淀粉和直链/支链淀粉的含量变化
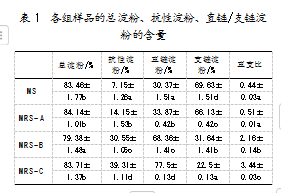
利用稀碱法制备得到的MS的蛋白质、脂肪、水分和灰分含量分别是0.17%、0.15%、10.84%和0.34%。研究发现,除MRS-B,各组样品的总淀粉含量均高于83%;MRS-A、MRS-B和MRS-C的抗性淀粉含量分别为14.15%、30.55%和39.31%,远高于MS的7.15%。这一结果表明,采用3种方法处理绿豆淀粉,均能显著提高其抗性淀粉的含量,且其中超声联合酶解法效果最好。同时,本研究中MRS-C的抗性淀粉含量显著高于Liang等[11]采用超声辅助酶解法制备的慈姑抗性淀粉含量(26.78%)以及董幸[12]采用微波-酶法制备的绿豆抗性淀粉含量(35%)。此外,直链淀粉含量及直支比的变化趋势与抗性淀粉含量的变化趋势相同,与支链淀粉含量的变化趋势相反,意味着普鲁兰酶对支链淀粉的水解效果较好,较高水平的直链淀粉和直支比有助于抗性淀粉形成。普鲁兰酶作为一种脱支淀粉酶,可以切割支链淀粉中的α-1,6糖苷键,从而产生大量直链淀粉。直链淀粉可聚集并排列形成紧密堆积的聚集体,进而产生具有抗消化特性的抗性淀粉[13]。同时,MRS-C中抗性淀粉的含量高于MRS-B,表明超声有助于促进淀粉分子裂解,增强普鲁兰酶的活性。研究表明,对酶反应体系进行适当时间的超声处理,可以提高传质效率。经过超声处理后,游离淀粉片段上暴露了更多与酶反应的位点,提高了酶促反应的效率,促进了抗性淀粉的形成[14-15]。具体数据如表1所示。
2.2各组样品的溶解度和膨胀力
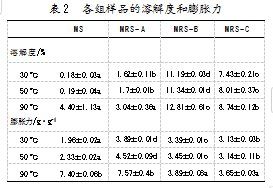
溶解度和膨胀力与淀粉颗粒结晶区和无定形区淀粉链之间的相互作用密切相关[16]。研究发现,各组样品的溶解度和膨胀力会随温度升高而增加。其原因可能是随着温度升高,淀粉分子间的相互作用逐渐减弱,淀粉颗粒结构被破坏,短链分子溢出,导致其水溶性提高。这与Li等[17]制备的山药抗性淀粉的研究结果一致。数据显示,不同温度下,MRS-B和MRS-C的溶解度均高于MS和MRS-A,表明酶解有效增加了短链淀粉分子的数量,减少了分子链中的氢键,提高了抗性淀粉的水溶性。归纳可得,所有样品在90℃时的溶解度和膨胀力均是最高的,说明高温处理可能会将淀粉分子从结晶状态转化成无定形形式,促进水分子进入淀粉颗粒的无定形区域,进而影响其溶解度和膨胀力。此外,MRS-A的膨胀力最高,表明压热冷却循环过程有助于破坏淀粉分子的晶体结构,从而增加抗性淀粉的膨胀力。由此可见,不同方法制备所得的绿豆抗性淀粉的溶解度和膨胀力存在显著差异。具体如表2所示。
2.3各组样品的透明度和持水性
透明度对淀粉制品的外观和用途影响较大。如图1A所示,MRS-B的透明度最高,其次是MRS-C,表明酶解可能会破坏淀粉的结晶区和表面结构,使得分子结合减少,淀粉溶解度增加,最终提高淀粉颗粒的透明度。该结果可与各组淀粉样品的溶解度测定结果相互印证。
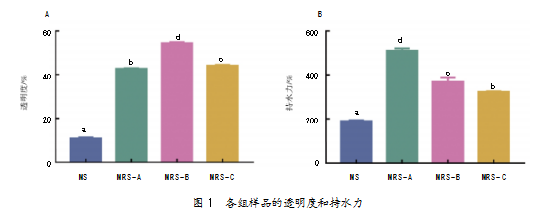
持水能力反映了淀粉分子与水分子的结合能力,与淀粉颗粒的表面形状、分子结构有关,会直接影响淀粉加工过程。如图1B所示,MRS-A的持水力最高,其次是MRS-B、MRS-C和MS。这一排序与各组样品在30℃下的膨胀力排序一致,说明压热冷却循环过程对淀粉颗粒结构的破坏,可有效提高淀粉的持水能力。
2.4各组样品的表面形态
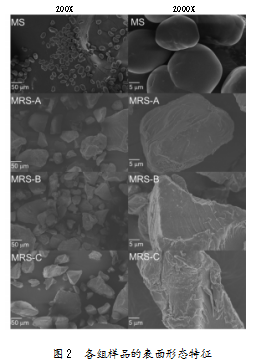
利用扫描电镜观察各组淀粉样品的表面形态,所得结果如图2所示。研究发现,MS具有不同大小的球形或椭圆形颗粒,表面光滑;MS和MRS-A的表面形状存在显著差异,MRS-A的表面为不规则碎片,且具有一定的表面粗糙度。经过超高压处理后,抗性淀粉颗粒的间距缩小,表面破碎,容易形成致密结构,有利于增强其抗消化性。本研究中的MRS-A,可能是在压热冷却循环的过程中淀粉颗粒破裂,形成了不规则的颗粒聚集体,而这种特殊形状的不规则聚集体具有一定的抗消化性[18]。MRS-B和MRS-C形状相似,均为粗糙的不规则形状,但MSR-C表面的凹槽状条带更多,这可能是由MRS-C酶解过程中施加超声处理所致。当气泡因超声波而破裂时,会形成空化效应,在气泡附近产生高压梯度和局部速度,形成剪切力,切割长链并破坏淀粉颗粒。超声波的空化效应作用于酶解体系,可破坏淀粉颗粒的表面形状,产生裂纹,促进酶解[19]。可见,抗性淀粉的形成方式存在差异,并对抗性淀粉含量产生了显著影响,这也是超声联合酶解法制备MRS-C的抗性淀粉含量高于MRS-B的原因之一。此外,还有研究表明,利用酶法制备抗性淀粉,在酶的剪切作用下,其表面会形成蜂窝网络状结构。MRS-C的特殊结构可能是其在大肠中作为肠道微生物发酵底物产生短链脂肪酸的因素之一[20]。
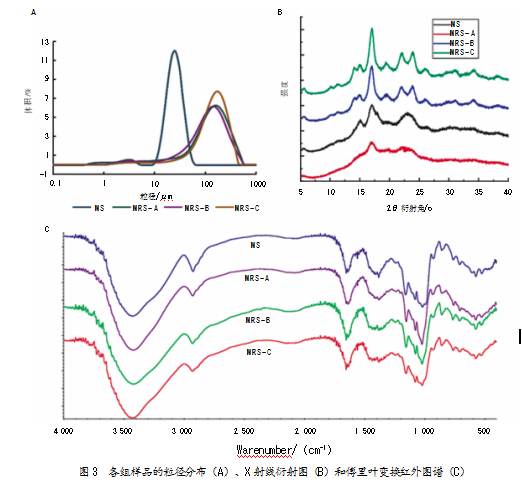
2.5各组样品的粒径分布
绿豆淀粉及抗性淀粉的粒径分布如图3A和表3所示。各组绿豆抗性淀粉的体积平均粒径D[4,3]、表面积平均粒径D[3,2]以及Dv(10)、Dv(50)、Dv(90)、Span跨度均显著高于绿豆淀粉。该数据结果与Li等[21]采用高压灭菌和高压灭菌-微波法制备的玉米抗性淀粉相似。其中,MRS-C的D[4,3](173.17 mm)、D[3,2](50.74 mm)、Dv(10)(46.9 mm)、Dv(50)(156.91 mm)和Dv(90)(328.17 mm)在所有样品组中均是最大的,而其Span跨度为1.76,在3种抗性淀粉样品中是最小的。这一结果表明,在超声联合酶解过程中,产生的大量直链淀粉分子,重排组合形成的聚集体显著增加了MRS-C的粒径,而MRS-C的跨度小于MRS-B,说明超声处理可促进淀粉颗粒均匀分布,提高其尺寸一致性。这与Ding等[22]研究结果相似,证实超声处理对淀粉粒径具有一定的影响。此外,有研究表明,不同粒径的抗性淀粉具有不同的理化性质和功能特性,淀粉颗粒的表面积大小关系着酶作用的表面积,进而影响着酶的消化性能[10]。
2.6各组样品的热特性
淀粉样品的糊化起始温度(To)、峰值温度(Tp)、终止温度(Tc)、糊化温度范围(Tc-To)和糊化焓(△H)如表4所示。MS的糊化起始温度为58.38℃,显著高于其他抗性淀粉组,表明MS需要较高的糊化温度来破坏其晶体结构。相较于MS,MRS-A的糊化温度较低,但糊化焓增加,可能是因为回生过程中淀粉链重排,在低温下形成了新的双螺旋结构,从而增加了MRS-A的糊化焓。MRS-B和MRS-C的糊化温度不存在显著差异,但除糊化起始温度,其他糊化温度均高于MS。淀粉的糊化温度、结晶度与直链淀粉含量和双螺旋结构密切相关。MRS-B和MRS-C通过酶解反应产生大量直链淀粉,组合成新的双螺旋结构。新聚合物结构更紧密,结晶度和晶体数量更多。淀粉的Tc-To反映了淀粉中微晶的稳定性和均匀性,且其糊化温度范围大,表明结晶区微晶较多[23]。糊化焓△H反映了双螺旋结构的熔融情况,焓值越高,表示双螺旋数量越多,堆积越紧密,热稳定性越强。MRS-B和MRS-C中微晶较多,双螺旋结构数量增加,而双螺旋结构熔融需要更多能量。因此,其焓值也相应地增加,热稳定性更强,且高于李素玲[24]通过压热-重结晶以及压热-酶法-重结晶制备的绿豆抗性淀粉的焓值。

2.7各组样品的结晶性质
淀粉样品的结晶类型和结晶度可通过X射线衍射仪进行分析。结晶类型可分为A型(单斜晶胞)、B型(六方晶胞)、C型(A型和B型的混合物)和V型(多存在于淀粉脂质复合物和糊化淀粉中)。抗性淀粉的结晶结构与其来源和加工方式存在较大关联。A型结构经过不同的加工方式可变成B型或B+V型结构。如图3B和表5所示,MS在5.6、15、17和23o的2q衍射角处有单峰,为A+C型结构,结晶度为40.61%。经过压热冷却循环处理的MRS-A在17o处有单峰,为B型结构,结晶度增加到了50.69%。
经酶解和超声联合酶解后,MRS-B和MRS-C分别在5.6、15.2、17.1、22和24o的2q角处出现衍射峰,结晶类型变为B+C型。MRS-B的结晶度为66.37%,且MRS-C的结晶度提高到了68.52%,显著高于李素玲[24]通过压热-脱支-重结晶制备所得的绿豆抗性淀粉42.8%的结晶度,以及Liang等[11]制备所得慈姑抗性淀粉55.6%的结晶度。MRS-C的结晶度最高,表明超声联合酶解过程促进了直链淀粉在结晶区和非结晶区的重排,使其形成了更稳定的结晶结构,相对结晶度有所提高[25]。此外,超声空化效应产生的剪切力增加了淀粉聚集体中的游离片段和酶接触位点,促进了酶解反应,同时增加的直链淀粉重新组装成双螺旋结构,形成紧密的晶体,具有较强的抗消化性[26]。
2.8各组样品的分子结构
傅里叶变换红外光谱可通过检测与主要官能团特征相对应的拉伸、弯曲和变形来研究抗性淀粉的分子结构和短程有序性。如图3C所示,各组样品光谱相似,且没有出现新的吸收光谱,说明采用不同方法制备的绿豆抗性淀粉均未产生新的化学基团。MS在3 432 cm-1处光谱吸收强度最低,说明采用不同的处理方法能促进绿豆抗性淀粉中游离羟基的拉伸振动,并能使直链淀粉产生的氢键数有所增加。MRS-A在1 645 cm-1处峰值强度最大,说明其淀粉中无定形部分的吸水能力最强,与之前MRS-A持水力最强的检测结果一致;其在1 022 cm-1处的峰值强度与淀粉分子无序或无定形部分的振动模式有关,峰值强度与结晶度成反比;其在1 047 cm-1处的峰值强度与淀粉分子的高结晶度和有序结构有关。峰值强度比为1 047/1 022 cm-1(R1 047/1 022),用于表示淀粉分子结晶度和有序结构的变化[27]。MS、MRS-A、MRS-B和MRS-C的R1 047/1 022比值分别是0.875、0.923、1和1.143。其中,MRS-C的峰值强度比值最大,说明其分子结构最有序,结晶度最高,这也与之前XRD的检测结果一致。推测原因可能是超声联合酶解处理增强了直链淀粉链间的结合,促进了淀粉分子相对有序结构的形成,展现出了较强的抗消化性。综上所述,淀粉分子的结构和理化性质在淀粉加工过程中会发生显著变化,且这些性质也会受加工方法影响。
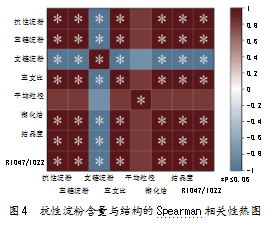
2.9抗性淀粉含量与结构的相关性分析
淀粉经过不同的加工处理方式,所产生的抗性淀粉在含量、结构以及理化性质方面存在较大差异。对本研究中绿豆抗性淀粉的含量和其他指标进行Spearman相关性分析,所得结果如图4所示。数据显示,抗性淀粉含量与直链淀粉含量、直支比、糊化焓、结晶度和R1 047/1 022呈显著正相关,与平均粒径呈正相关,但与支链淀粉含量呈显著负相关。这说明,当通过超声联合酶解制备的MRS-C具有较高的抗性淀粉含量时,其直链淀粉含量、直支比、平均粒径、糊化焓、结晶度和R1 047/1 022比值较大,支链淀粉含量较低。同时,抗性淀粉含量通常与抗消化性能密切相关,表明具有以上特征的MRS-C,很适合用于制成抗消化性能强的功能性食品。
3结论
文章采用压热冷却循环、酶解和超声联合酶解法制备了绿豆抗性淀粉,并对其理化性质和结构特征进行了研究。其中,利用超声联合酶解法制备的MRS-C具有B+C型晶体结构,抗性淀粉含量最高、粒径最大、结晶度最高、双螺旋结构最稳定有序、表面不规则形状最粗糙,且这些结构特征均与绿豆抗性淀粉的制备方法密切相关。同时,MRS-C的溶解性、膨胀力、透明度、持水性和热稳定性也得到了显著提高,表明理化性质与抗性淀粉的结构特征密切相关。由此可见,由超声联合酶解法制得的MRS-C具有较高的抗性淀粉含量,可被广泛应用于开发具有抗消化性能或改善加工性能的功能性食品。
参考文献
[1]ENGLYST H N,KINGMAN S M,CUMMINGS J H.Classification and measurement of nutritionally important starch fractions[J].European Journal of Clinical Nutrition,1992,46(2):33-50.
[2]JIANG F,DU C,JIANG W,et al.The preparation,formation,fermentability,and applications of resistant starch[J].International Journal of Biological Macromolecules,2020,(150):1155-1161.
[3]ASHWAR,BILAL,AHMAD,et al.Preparation,health benefits and applications of resistant starch-a review[J].Starch,2016,(67):1-15.
[4]SUHARTONO P M T.Fermentation RS3 derived from sago and rice starch with Clostridium butyricum BCC B2571 or Eubacterium rectale DSM 17629[J].Anaerobe,2012,(18):55-61.
[5]DONA A C,PAGES G,GILBERT R G,et al.Digestion of starch:In vivo and in vitro kinetic models used to characterise oligosaccharide orglucose release[J].Carbohydrate Polymers,2010,80(3):599-617.
[6]CHAKRAVARTY A,TANDON M,ATTRI S,et al.Structural characteristics and prebiotic activities of resistant starch from Solanum tuberosum:Kufri Bahar,a popular Indian tuber variety[J].LWT-Food Science and Technology,2021,145(1):1-8.
[7]YASHINI M,KHUSHBU S,MADHURIMA N,et al.Thermal properties of different types of starch:A review[J].Critical Reviews in Food Science and Nutrition,2022,15(3):1-24.
[8]SHAH A,MASOODI F A,GANI A,et al.Dual enzyme modified oat starch:Structural characterisation,rheological properties,and digestibility in simulated GI tract[J].International Journal of Biological Macromolecules,2018,106:140-147.
[9]XIA J A,ZHANG Y,HUANG K,et al.Different multi-scale structural features of oat resistant starch prepared by ultrasound combined enzymatic hydrolysis affect its digestive properties[J].Ultrasonics Sonochemistry,2023,96:1-10.
[10]LIU G D,HONG Y,et al.Pullulanase hydrolysis behaviors and hydrogel properties of debranched starches from different sources[J].Food Hydrocolloids,2015,45(3):351-360.
[11]LIANG Q,CHEN X,REN X,et al.Effects of ultrasound-assisted enzymolysis on the physicochemical properties and structure of arrowhead-derived resistant starch[J].LWT-Food Science and Technology,2021,147(3):1-9.
[12]董幸.绿豆抗性淀粉的制备及其对小鼠肠道代谢的影响[D].长春:吉林农业大学,2020.
[13]OZTURK S,KOKSEL H,KAHRAMAN K,et al.Effect of debranching and heat treatments on formation and functional properties of resistant starch from high-amylose corn starches[J].European Food Research&Technology,2009,229(1):115-125.
[14]MENG H M,LI D,ZHU C H.The effect of ultrasound on the properties and conformation of glucoamylase[J].International Journal of Biological Macromolecules,2018,113(1):411-417.
[15]ZOU J,XU M J,WEN L R,et al.Structure and physicochemical properties of native starch and resistant starch in Chinese yam(Dioscorea opposita Thunb.)[J].Carbohydrate Polymers,2020,237(1):1-9.
[16]GUO Z B,ZENG S X,LU X,et al.Structural and physicochemical properties of lotus seed starch treated with ultra-high pressure[J].Food Chemistry,2015,186(1):223-230.
[17]LI T,AN F P,TENG H,et al.Comparison of structuralfeatures and in vitro digestibility of purple yam(Dioscorea alataL.)resistant starches by autoclaving and multi-enzyme hydrolysis[J].Food Science and Biotechnology,2017,27:27-36.
[18]DUNDAR A N,GOCMEN D.Effect of autoclaving temperature and storing time on resistant starch formation and its functional and physicochemical properties[J]. Carbohydr Polym,2013,97(2):764-771.
[19]SEID,REZA,FALSAFI,et al.Physicochemical and morphological properties of resistant starch type 4 prepared under ultrasound and conventional conditions and their in-vitro and in-vivo digestibilities[J].Ultrasonics Sonochemistry,2019,53:110-119.
[20]ZHANG Y,ZENG H L,WANG Y,et al.Structural characteristics and crystalline properties of lotus seed resistant starch and its prebiotic effects[J].Food Chemistry,2014,155:311-318.
[21]LI J T,HAN W F,ZHANG B J,et al.Structure and physicochemical properties of resistant starch prepared by autoclaving microwave[J].Starch St覿rke,2018,70(9):1-7.
[22]DING Y B,LUO F J,LIN Q L.Insights into the relations between the molecular structures and digestion properties of retrograded starch after ultrasonic treatment[J].Food Chem,2019,294:248-259.
[23]MA M T,WANG Y J,WANG M X,et al.Physicochemical properties and invitro digestibility of legume starches[J].Food Hydrocolloids,2017,63(3):249-255.
[24]李素玲.绿豆抗性淀粉的制备及性质研究[D].广州:华南理工大学,2011.
[25]WANG D L,HOU F R,MA X B,et al.Study on themechanism of ultrasound-accelerated enzymatic hydrolysis of starch:Analysis of ultrasound effect on different objects[J].International Journal of Biological Macromolecules,2020,148:493-500.
[26]WANG X Y,HU A J,ZHENG J,et al.Physicochemical Properties and Structure of Annealed Sweet Potato Starch:Effects of Enzyme and Ultrasound[J].Starch-St覿rke,2020,72:1-9.
[27]LI M,LI J X,ZHU C H.Effect of ultrasound pretreatment on enzymolysis and physicochemical properties of corn starch[J].International Journal of Biological Macromolecules,2018,111:848-856.










