焦化脱硫废盐资源化利用技术分析论文
2024-11-15 11:06:05 来源: 作者:dingchenxi
摘要:焦化脱硫废盐的资源化利用是目前炼焦厂关注的重点方向,焦化脱硫废盐中含有硫代硫酸盐、氢硫酸盐和硫酸盐等废物,需要采取有效的方法进行处理。
摘要:焦化脱硫废盐的资源化利用是目前炼焦厂关注的重点方向,焦化脱硫废盐中含有硫代硫酸盐、氢硫酸盐和硫酸盐等废物,需要采取有效的方法进行处理。实验研究了微纳米气泡技术、硫酸铜沉淀技术以及石灰表面强制更新技术在处理焦化脱硫废盐中的应用,分析了以上技术应用的影响因素和最佳控制条件。结果表明,合理选择废盐处理技术,能够降低处理成本,减少环境污染。
关键词:焦化脱硫废盐;资源化利用;微纳米气泡
0引言
炼焦过程中需要使用煤炭资源,煤炭焦化过程会产生煤气,煤气中含有许多有害物质,需要经过冷却、脱硫、脱氨和脱苯等净化[1]。焦化煤气脱硫过程中产生的废水被称为“脱硫废液”,含有焦油、无机盐、氨、硫磺和催化剂等有害物质,废液不仅有害物质浓度高,而且降解难度大,不仅增加了企业处理成本,而且还带来了环境污染隐患。脱硫废液中含有许多废盐,如氢硫酸盐、硫代硫酸盐以及硫酸盐等,这些废盐的处理与资源化利用是焦化行业一直研究的重点,也是其面临的核心技术难题。
1材料与试剂
实验室模拟脱硫废杂盐废液,实验所用材料与试剂见表1。

2实验方法与原理
2.1微纳米气泡氧化实验
硫代硫酸根具有很好的还原性,经过氧化反应后,生产二氧化硫、水,因此,主要利用其化学性质设计处理方法[2]。在120 mm×800 mm的自制反应容器中放入质量浓度为50 g/L的模拟脱硫废液5 L,向其中通入微纳米气泡,测量废盐物质浓度。纳米气泡通过管道进入到反应液中,由于发生器能够生产的微纳米气泡数量一定,因此,反应会受到微纳米气泡浓度的影响。
2.2硫酸铜沉淀实验
在废盐液体中加入硫酸铜能,将废盐液体中的硫氰酸根沉淀[3]。该方法主要是在50 mL含硫氰酸铵、
硫代硫酸铵及硫酸铵的模拟废杂盐废液中加入硫酸铜,利用Cu2+与SCN-的沉淀反应去除SCN-。在原液中加入硫酸铜后,原液会形成黑色沉淀物质,随着反应的进行,黑色沉淀物质变为白色沉淀。黑色沉淀物质为Cu(SCN)2,白色沉淀物质为CuSCN。得到反应产物后,在焦化炉中进行加热,经过反应后得到氧化铜、二氧化硫、二氧化碳和氮气等,Cu2+与SCN-的反应如式(1):
Cu2++SCN-Cu(SCN)2↓(1)
2.3石灰表面强制更新实验
在250 mL锥形瓶内的模拟废液中进行实验,添加PP球,规格为5 g/个,直径为5 mm,实验时加入生石灰。利用石灰表面强制更新方法能去除硫酸根,反应方程式为式(2):
SO42-+Ca2+CaSO4↓(2)
OH-与Cu2+沉淀反应方程式为式(3):
Cu2++2OH-Cu(OH)2↓(3)
3实验结果分析
3.1微纳米气泡氧化结果
1)温度。微纳米气泡的稳定性是影响处理效果的重要因素,处理温度高于50℃,反应液中的微纳米气泡的稳定性将会逐渐降低,大量的气泡发生解离。反应液中的气泡浓度降低,氧化能力减弱,硫代硫酸根的反应速率变慢。
2)pH值。反应液的pH值变化也会引起反应进程变化,反应时间相同的条件下,pH值减小,导致硫代硫酸根的浓度降低,即处理效果变强。也就是说,在pH值不变的情况下,氧化时间越长,硫代硫酸根浓度越低。出现这种情况的主要原因是pH值会影响反应液中·OH自由基的浓度,·OH自由基浓度提高,微纳米气泡的氧化能力增强,去除效果变好。此外,酸性环境下的硫代硫酸根稳定性弱于碱性环境。
3)S2O32-浓度。废液中的S2O32-浓度是影响微纳米气泡氧化能力的因素,当原液中的S2O32-浓度增加时,由于微纳米气泡的数量一定,无法及时将多余的S2O32-氧化,因此,反应时间将会延长。
4)离子。Cu2+具有氧化催化的作用,反应液中的Cu2+可以加速硫代硫酸根反应。S2O42-浓度对硫代硫酸根氧化反应具有抑制作用,当溶液中的S2O42-饱和时,硫酸根氧化反应速率降至最低。表2为不同pH值下硫代硫酸根去除率。

为了使反应效果最佳,需要满足以下条件:
1)温度。反应最佳温度为50℃,升高或降低温度都会减缓氧化反应速率。温度是影响为纳米气泡数量和浓度的重要因素,温度越高,导致原液中的微纳米气泡稳定性变得越差。
2)pH值。酸性条件最佳,反应环境中的pH值越低,硫代硫酸根的稳定性越差,可以被氧化成二氧化硫。pH值在9~10时,硫代硫酸根难以被氧化,其稳定性最强。
3)时间。反应时间控制在420 min以上。研究发现,如果反应时间较短,将会导致反应不够充分,残液中的废盐酸根无法被有效清除,而增加反应时间,则会使反应变得更加彻底。
4)S2O32-浓度。尽可能地降低原液中的S2O32-浓度,如通过浓缩液体的方法将原液中的水分蒸发,使S2O32-的浓度提高,进而促进反应有序进行。
5)其他。随着反应时间增加,反应液中的Cu2+和S2O42-浓度增加,Cu2+可以促进反应,S2O42-可以抑制反应。因此,可以通过改变原液中Cu2+和S2O42-的量控制反应速度,尽可能地减少S2O42-浓度。
3.2硫酸铜沉淀结果
1)物质的量比。Cu2+与SCN-的物质量的比值改变,会引起反应速率发生改变,摩尔比对反应速率的具体影响为先升高后降低。
2)温度。稳定影响硫酸铜与硫氰酸铵的反应速度,温度升高,反应速率加快。但是,当温度升至40℃后,反应液中的Cu2+水解能力变强,导致与硫氰酸根结合的Cu2+数量减少,因此,沉淀效果变差。
3)SCN-质量浓度。初始反应液中的SCN-浓度越高,与Cu2+的反应速率越快。但随着反应进行,SCN-被消耗,其浓度降低,导致反应速率变慢。图1为反应温度对SCN-去除率的影响。
最佳控制条件如下:
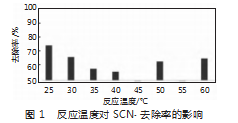
1)物质的量比。Cu2+与SCN-反应过程中,Cu2+与SCN-的含量是影响SCN-的去除率的关键性因素,当反应中的Cu2+增加到一定量时,SCN-去除率达到最高。再次增加Cu2+,将会影响反应的进行。研究表明,控制Cu2+与SCN-的物质的量比为1.2,可以获得最理想的反应结果,此时SCN-的去除率最高。
2)温度。以40℃为界限,温度降低和升高,都会引起反应变慢,效果变差。研究发现,温度升高,会影响SCN-的氧化过程。当温度升至40℃以上时,Cu2+发生水解,导致Cu2+量减少,引起SCN-反应变慢。
3)SCN-质量浓度。反应时间在80 min以上,SCN-质量浓度大于300 g/L,SCN-质量浓度为最佳。
3.3石灰表面强制更新结果
1)n(Ca2+):n(SO42-)。Ca2+浓度高于SO42-浓度,可以加快反应速率,从而提高SO42-的去除率。但当n(Ca2+):n(SO42-)>1.5时,反应速率也会降低。随着加入生石灰总量增加,生石灰与水的反应速率降低,原液无法溶解过多的生石灰,导致反应不够完全。
2)温度。温度改变会影响Ca(OH)2的溶解度,温度升高,Ca(OH)2的溶解度变低。如果溶液达到了饱和状态,那么Ca(OH)2就会析出,参与反应的Ca(OH)2减少,会影响Ca2+与SO42-的结合。
3)SO42-质量浓度。SO42-质量浓度高,表示其中SO42-数量多,与Ca(OH)2接触的机会大,当SO42-质量浓度达到500 g/L时,接近饱和。
4)研磨介质。SO42-与Ca(OH)2的反应过程中,生产的CaSO4会在Ca(OH)2表面形成一层保护膜,导致二者的接触面积减少。随着反应进行,Ca(OH)2被完全包裹。加入研磨介质,能够避免CaSO4附着在Ca(OH)2表面,从而促进反应进行。
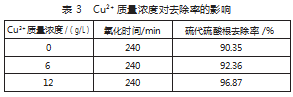
5)其他。随着反应进行,溶液中的Cu2+质量浓度增加,将会发生CuSO4与Ca(OH)2的反应,生成新的固体废物[4]。硫氰酸根浓度增加,导致硫酸根反应速率减慢。原因是硫氰酸根与氢氧化钙先发生反应,导致溶液中的一部分Ca(OH)2被消耗。因此,硫酸根去除率变低。表3为Cu2+质量浓度对去除率的影响。
结果分析:
1)n(Ca2+):n(SO42-)。合理控制Ca2+与SO42-的比值,能够减少资源投入,实现降本增效的目的。n(Ca2+):n(SO42-)为1.5时,反应速率最高,二者的互相影响较低。
2)温度。理想状态下,升高温度能够促进反应进行,从而提高处理效率。但是,随着温度升高,一部分反应物质的物理性质发生变化,导致反应无法顺利开展。研究发现,在20℃条件下反应240 min,可以大大提高去除率。此时,Ca(OH)2的溶解度曲线开始呈现降低态势。
3)SO42-质量浓度。初始液中SO42-质量浓度的提高,对于反应进行十分有利。在处理原液时,可以将原液进行适当浓缩。
4)研磨剂。添加适量的研磨剂,可以促进反应进行。研磨剂的作用是防止CaSO4在Ca(OH)2表面形成固体附着物,这样能够为CaSO4与Ca(OH)2提供更多接触与反应的空间,从而有效清除SO42-。
4结论
焦化脱硫废盐中含有硫代硫酸盐、氢硫酸盐和硫酸盐等废物,微纳米气泡技术、硫酸铜沉淀技术以及石灰表面强制更新技术对于废盐具有很好的处理效果。在处理过程中,应该根据原液各废弃物成分的含量选择处理技术。同时,应合理调整温度、pH值以及研磨介质等条件,确保原液反应处于最佳的反应条件下,进而降低处理成本和减少污染。
参考文献
[1]梁转转,杨艳青,高远,等.焦化脱硫废盐在水—乙醇体系下溶析提纯[J].环境工程,2022,40(11):92-97.
[2]梁转转.焦化脱硫高盐废水资源化利用研究[D].太原:太原理工大学,2022.
[3]李红耀,杨瑞平.焦炉烟气脱硫灰资源化利用试验研究[J].山西焦煤科技,2021,45(4):9-12.
[4]崔峰.废盐泥用于电厂烟气脱硫山东海化循环经济体系建设初具规模[J].纯碱工业,2009(4):22.










