UPLC-MS/MS法分析β淀粉样蛋白中Asp残基的外消旋化论文
2024-11-06 13:53:47 来源: 作者:liziwei
摘要:目的:建立β淀粉样蛋白中Asp外消旋化的LC-MS/MS分析方法。方法:采用胰蛋白酶和Glu-C酶两步酶解β淀粉样蛋白,酶解产物LC-MS/MS分析的色谱条件:分离柱为InfinityLab Poroshell 120 EC-C18色谱柱(2.7μm,3.0×150 mm Agilent),流动相A为5%乙腈-0.1%甲酸水,流动相B为75%乙腈-水,梯度洗脱(0~30 min,0~28%B;30~30.01 min,28%~100%B;30.01~35 min,100%~100%B;35.0~35.01
摘要:目的:建立β淀粉样蛋白中Asp外消旋化的LC-MS/MS分析方法。方法:采用胰蛋白酶和Glu-C酶两步酶解β淀粉样蛋白,酶解产物LC-MS/MS分析的色谱条件:分离柱为InfinityLab Poroshell 120 EC-C18色谱柱(2.7μm,3.0×150 mm Agilent),流动相A为5%乙腈-0.1%甲酸水,流动相B为75%乙腈-水,梯度洗脱(0~30 min,0~28%B;30~30.01 min,28%~100%B;30.01~35 min,100%~100%B;35.0~35.01 min,100%~0%B;35.01~40 min,0%B),流速为0.3 mL/min。质谱条件:采用电喷雾离子源及正离子多反应监测模式(SRM)定量。结果:在L型多肽存在下,D型多肽的质量浓度在1~250 ng/mL内,其峰面积与多肽的质量浓度之间线性良好(r>0.999),最低定量限(LLOQ)为1 ng/mL;LLOQ、低(LQC)、中(MQC)、高浓度(HQC)日内和日间精密度RSD值均小于15%,加样回收率为85.3%~107.3%。建立的方法对D/(D+L)型淀粉样蛋白为2%~50%的混合样本中Asp1,Asp23外消旋化测定结果准确,准确度在95.35%~117%之间。联合胰蛋白酶与Glu-C成功鉴定了淀粉样蛋白中Asp7残基的外消旋化。结论:所建立的方法可用于淀粉样蛋白中Asp残基外消旋化的分析,该方法操作简便,结果准确,灵敏度高。
关键词:β淀粉样蛋白;外消旋化;液质联用;天冬氨酸
蛋白质和多肽中氨基酸转化为D-型的立体异构修饰,称为外消旋化(racemization),是蛋白质翻译后修饰(Post-translational modification,PTM)的一种,其中以天冬氨酸外消旋化(aspartic acid racemization,AAR)最为常见。外消旋化修饰会导致蛋白质溶解度、受体亲和力、稳定性等理化性质的改变,从而引起蛋白质在人体内的异常积累,并引起相关疾病,如白内障和阿尔茨海默病。此外,氨基酸的外消旋化修饰也降低了多肽及蛋白类药物的疗效,如抗体类药物。
β淀粉样蛋白(amyloid-β,Aβ)中Asp残基的异构化与外消旋化与阿尔茨海默病(AD)的病理直接相关。事实上,从AD患者的神经斑块中提取的Aβ的Asp1、Asp7和Asp23残基均发生了明显的异构化和外消旋化。许多研究已经表明,Aβ中不同Asp残基的外消旋化和异构化与淀粉样蛋白聚集纤维化和细胞毒性相关。然而,对于淀粉样蛋白中氨基酸外消旋化修饰的研究,仍然缺乏准确、高效的分析方法,限制了对外消旋化修饰的生理功能的进一步研究。
液相色谱(LC)-质谱(MS)联用是分离和鉴定异构化和外消旋化修饰多肽最常用的方法。外消旋化修饰会导致多肽的结构和疏水性改变,使其可以在常规的反相色谱上实现分离。然而,这种方法也面临挑战,异构体多肽之间的分离情况取决于肽段的长短和外消旋残基的位置。因此,通过选择蛋白酶将外消旋化修饰的蛋白质和多肽切割成合适大小的肽段,能极大地提高该方法的适用性。
本文开发了一种分离和鉴定β淀粉样蛋白(Aβ)中Asp外消旋残基的LC-MS/MS方法。该方法基于胰蛋白酶和Glu-C酶联合酶解产生多肽异构体,能够在常规C18柱上分离与鉴定,覆盖了β淀粉样蛋白中全部Asp残基的分析,相对于传统的酸水解与衍生化法,该方法操作简单,灵敏度高,可重复性高。为进一步研究淀粉样蛋白中外消旋化与疾病之间关联提供了技术支持。
1仪器与试剂
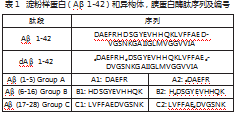
乙腈,HPLC级,德国Merck公司;甲酸、冰醋酸碳酸氢铵,分析纯,南京化学试剂有限公司;BCA蛋白定量试剂盒,碧云天生物技术研究所;测序级胰蛋白酶,测序级,Promega,美国;Glu-C酶,测序级,Promega,美国;蛋白质和多肽对照品(表1),纯度均>95%,上海吉尔生化。
岛津LCMS-8050超快速液相质谱联用仪,电喷雾离子源ESI;岛津LCMS-9030超快速液相质谱联用仪,电喷雾离子源ESI;Labsolution数据工作站;BSA124S万分之一分析天平,德国Sartorius公司;十万分之一天平,BS 21S,德国Sartorius公司;PURELAB Classic超纯水制备系统,美国PALL公司;酶标仪,SpectraMaxix3;PHS-25型pH计,上海精密仪器设备有限公司;数显恒温水浴锅,HH-4A,常州国华电器有限公司;TGL-16M台式高速离心机,湖南湘仪离心机仪器有限公司;密理博Amicon Ultra-15 10K离心过滤器,美国默克公司。
2实验方法
2.1液相色谱-串联质谱条件
2.1.1色谱条件
色谱柱:C18柱(InfinityLab Poroshell 120 EC-C18 2.7μm,3.0×150mm Agilent);流动相由含0.1%甲酸
的5%乙腈水溶液(A)和75%乙腈溶液(B)组成,梯度洗脱,洗脱程序:0~30 min,0~28%B;30~30.01 min,28%~100%B;30.01~35 min,100%;35.01~40 min,0%;流速:0.3 mL/min;柱温:40℃;进样量:10μL。
2.1.2质谱条件
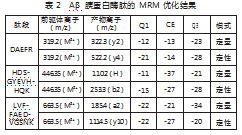
电喷雾正离子MRM扫描:各肽段优化后的质谱参数见表2。HDSGYE与VHHQK肽段鉴定在QTOF上进一步确定。电喷雾离子源参数设置:接口电压4 kV;雾化气流量3 L/min;加热气流量10 L/min;接口温度300℃;DL温度250℃;加热块温度400℃;干燥气流量3 L/min。
2.2溶液配制
Aβ胰蛋白酶肽储备液:精密称取表1中各Aβ胰蛋白酶肽2.0 mg,其中HDSGYEVHHQK肽段用0.5%甲酸水溶解至质量浓度为2.0 mg/mL的多肽储备液。DAEFR与LVFFAEDVGSNK采用30%乙腈水(含0.5%甲酸)溶解至质量浓度为2.0 mg/mL的多肽储备液。
Aβ1-42蛋白及异构体储备液:精密称取淀粉样蛋白Aβ1-42及异构体5.0 mg,用乙腈:水(体积比50:50)溶解至质量浓度为5 mg/mL的蛋白储备液,超声30s使其溶解。
2.3蛋白质酶解
胰蛋白酶酶解:用50 mmol/L NH4HCO3缓冲液将Aβ及异构体蛋白储备液稀释至100μmol/L,根据m(酶):m(蛋白)=1:50比例加入胰蛋白酶,在37℃条件下酶解12 h,加入0.1%甲酸终止反应。
胰蛋白酶与Glu-C酶联合酶解:用50 mmol/L NH4HCO3缓冲液将Aβ蛋白及异构体储备液稀释至100μmol/L,按m(酶):m(蛋白)=1:50比例加入胰蛋白酶,在37℃条件下酶解12 h,所得酶解液置于离心过滤器中,12 000 r/min离心15 min,收集下层滤液,根据m(酶):m(蛋白)=1:50比例加入Glu-C酶,置于37℃水浴反应12h,加入甲酸溶液至终质量分数0.5%终止酶解反应,12 000 r/min离心5 min(4℃)。
3结果
3.1 DAEFR和LVFFAEDVGSNK肽的方法学考察
方法学验证参考了中国药典2020版四部通则中“9012生物样品定量分析方法验证指导原则”。验证内容有选择性、线性和范围、回收率及精密度。
3.1.1选择性
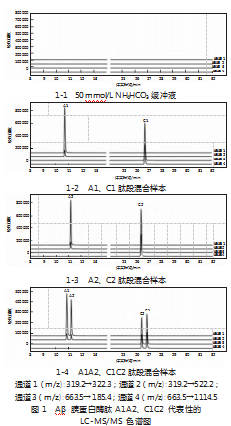
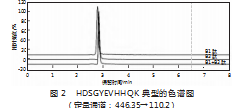
将Aβ胰蛋白酶肽储备液用50 mmol/L碳酸氢铵溶液(pH=7.8)稀释,配制L型多肽组(仅添加A1,B1,C1肽)、D型多肽组(仅添加A2、B2、C2肽)、L/D型混合多肽组(添加A1A2、B1B2、C1C2肽)。采用“2.1”项下的液相色谱-串联质谱条件对其进行测定。A1、A2的保留时间分别为10.84、11.15 min,C1、C2肽段的保留时间分别为26.45、26.86 min(见图1),分离度良好,能实现基线分离。对于B1、B2肽,无法实现异构体之间的分离,如图2所示,因此需要采取进一步方法使其分离。
3.1.2线性与范围
为了检测在L-型多肽的存在下,D-型多肽的线性。精密移取“2.2.1”项下的Aβ胰蛋白酶肽A、C储备液,用50 mmol/L碳酸氢铵溶液(pH=7.8)稀释配制成D/(L+D)质量分数为0.2%,0.5%、1%、5%、10%、20%、50%的系列溶液,分别对应D-多肽的质量浓度为1、2.5、5、25、50、100、250 ng/mL。按照“2.1”项下的液相色谱-串联质谱条件进样,以D-多肽的质量浓度(ng/mL)为横坐标,峰面积为纵坐标,在不同天绘制至少两条标准曲线。dDAEFR标准曲线方程为y=6 345.945x+2 933.419,相关系数R>0.999,标准曲线各浓度点的准确度(计算值/理论值×100%)在85.3%~107.3%内,结果表明线性良好。LVFFAEd DVGSNK标准曲线方程为y=5 644.712x-2 437.208,相关系数R>0.999,标准曲线各浓度点的准确度(计算值/理论值×100%)在86.3%~108.4%内,结果表明在1~250 ng/mL质量浓度范围内线性良好。
3.1.3回收率和精密度
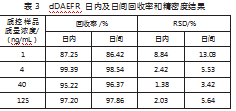
按“3.1.2”项下方法配制D/(L+D)质量分数为0.2%(1 ng/mL,LLOC)、0.8%(4 ng/mL,LOC)、8%(40 ng/mL,MOC0、25%(125 ng/mL,HOC)4个质控样本。每个浓度样品平行制备5份,取10μL进样分析,测定日内及日间回收率与精密度,dDAEFR的日内回收率在87.25%~99.39%之间,日间回收率在86.42%~98.54%之间。日内精密度的RSD值为1.38%~8.84%,日间精密度的RSD值为3.42%~13.03%之间,均在可接受范围(见表3);
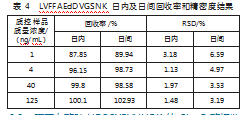
LVFFAEdDVGSNK的日内回收率在87.85%~100.1%之间,日间回收率在89.42%-102.93%之间。日内精密度的RSD值为1.14%~3.18%,日间精密度的RSD值为3.19%~6.59%之间,均在可接受范围(见表4)。
3.2胰蛋白酶肽HDSGYEVHHQK的Glu-C酶切鉴定结果
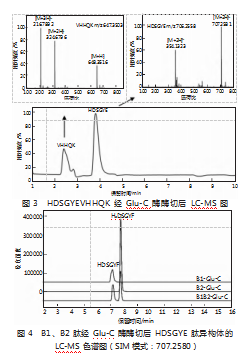
为了鉴定HDSGYEVHHQK中Asp残基的外消旋化,使用Glu-C酶进一步将其切割成更短的肽段。HDSGYEVHHQK肽经Glu-C酶酶切后,通过质谱检测到了HDSGYE和VHHQK肽段,HDSGYE、VHHQK的保留时间分别为2.42、3.85 min(见图3)。将含有L-Asp与D-Asp的HDSGYEVHHQK肽单独和混合经Glu-C酶酶切后,HDSGYE、HdDSGYE的保留时间分别为7.21、7.78 min(见图4),分离度良好,能实现基线分离。
3.3 Aβ1-42样本的检测
3.3.1 Aβ1-42及异构体的检测
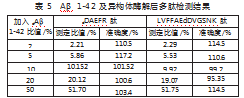
精密量取Aβ及异构体蛋白储备液,用50 mmol/L碳酸氢铵溶液(pH=7.8)配制成dAβ1-42/(Aβ1-42+dAβ1-42)为质量分数为2%、5%、10%、20%、50%的混合Aβ1-42溶液,蛋白的总质量浓度为200μg/mL,以模拟实际中含有不同比例的异构体的蛋白样本。按照“2.3”项下方法进行胰蛋白酶酶切处理,按“2.1”项下的液相色谱-串联质谱条件进样,不同比列的dAβ1-42经胰蛋白酶消化后能准确测出D-型多肽的比值(见表5),准确度在95%~117.2%之间。
3.3.2胰蛋白酶与Glu-C联合使用鉴定Aβ1-42中Asp7外消旋化
用50 mmol/L碳酸氢铵溶液(pH=7.8)配制了dAβ1-42/(Aβ1-42+dAβ1-42)为8%的混合样本,100%的dAβ1-42蛋白溶液,按“2.3”项下方法进行胰蛋白酶与Glu-C酶联合酶切处理后进样,其典型色谱图如图5所示。Aβ1-42蛋白溶液经酶切只产生HdDSGYE单一峰,保留时间为8.77 min。含有8%的异构体的Aβ1-42蛋白经酶切后,产生了HDSGYE与HdDSGYE峰,HDSGYE的保留时间为8.53 min,根据峰面积比值,HdDSGYE占总面积的约8%。该结果证明了利用胰蛋白酶和Glu-C联合可以准确的鉴定Aβ1-42中Asp7的外消旋化水平。
4结果讨论
4.1液质条件的选择与优化
多肽异构体是一种非对映异构体,可以在反相色谱柱上实现分离。然而,在常规的HPLC柱上实现异构体的分离是十分困难的,并且耗时较长。许多研究者已经在反相色谱柱上实现多肽异构体之间的分离,采用柱效更高的纳米毛细管的色谱系统可以进一步提高异构体之间的分离。另一方面,通过手性色谱柱和多肽衍生化方法增强了多肽异构体之间的分离,如Du等采用改良的手性固定相(QShell和NicoShell),实现了对淀粉样蛋白每个胰蛋白酶片段的异构体进行色谱分离。本研究前期采用常规HPLC柱,Eclipse XDB-C18(4.6×250 mm,5μm)对Aβ胰蛋白酶肽异构体之间的分离,结果显示至少需要90 min才能实现异构体之间的分离(如图6所示)。因此,采用更高柱效的色谱可以缩短分析时间,本研究中选用了UPLC柱来实现异构体之间的分离,通过优化流动相的配比,提高多肽异构体之间的分离,分析时间为40 min左右。
4.2两步酶法的选择
本研究中,β淀粉样蛋白首先经胰蛋白酶消化,产生的DAEFR与LVFFAEDVGSNK肽异构体能直接在UPLC柱上实现分离,而HDSGYEVHHQK肽异构体在UPLC柱上无法实现分离,与该肽段含有3个碱性氨基酸残基His和氨基酸残基数目有关。通过优化流动相,如改变流动相为甲酸铵水-乙腈体系,虽然极大地提高了该肽段的保留时间,但仍然无法实现肽异构体之间的分离。因此需要采取进一步酶切成更短的肽段。由于HDSGYEVHHQK中含有一个Glu残基,因此选择Glu-C将其切割成HDSGYE和VHHQK肽。HDSGYE异构体可以在UPLC柱上实现分离。要联合胰蛋白酶和Glu-C酶共同酶切,则需要使得胰蛋白酶不干扰Glu-C酶的效果。一种方法是通过超滤法去除胰蛋白酶,随后加入Glu-C进行进一步酶切。实现证明胰蛋白酶经超滤法去除后不干扰Glu-C酶酶切。另一种方法是,Glu-C酶切的pH范围在4.0~9.0之间,胰蛋白酶消化的pH范围在7~8左右。因此可以通过调整pH值至4.0~6.0之间来抑制胰蛋白酶活性,而Glu-C可以正常酶切。在本研究中,该方法不能完全抑制胰蛋白酶活性,Glu-C酶解片段产率没有超滤法高,因此,本研究采用超滤法来去除胰蛋白酶。此外,我们将β淀粉样蛋白及异构体直接经Glu-C酶消化后,产生FRHDSGYE异构体肽,通过优化LC-MS方法,典型图谱如图7所示,FRHDSGYE异构体肽之间不能完全分离。
5结论
本研究通过Aβ的胰蛋白酶肽建立了一种快速,全面地鉴定与定量β淀粉样蛋白中三个Asp残基外消旋化的分析方法。该方法灵敏度高,在D型肽段浓度为1~250 ng/mL内,线性良好,LLOQ为1 ng/mL。经验证,该方法回收率和精密度均符合要求。在体外模拟了不同浓度的含异构体的β淀粉样蛋白,经该方法检测其酶解后片段外消旋化水平,其结果准确,准确度在95%~117.2%之间。因此,该方法可以用于临床中淀粉样蛋白中异构体的含量的测定。而β淀粉样蛋白是AD的核心,准确测定出其异构体水平在临床上将有助于阐明脑组织淀粉样病变的机制。
参考文献:
[1]Takata T,Fujii N.Isomerization of Asp residues plays an important role in A-crystallin dissociation[J].Febs Journal,2016,283(5):850-859.
[2]Aki K,Okamura E.D-β-aspartyl residue exhibiting uncommon high resistance to spontaneous peptide bond cleavage[J].Scientific Reports,2016(6):21594.
[3]Checco J W,Zhang G,Yuan W D,et al.Molecular and physiological characterization of a receptor for d-amino acid-containing neuropep-tides[J].Acs Chemical Biology,2018,13(5):1343-1352.
[4]M iller M M.Post-translational modifications of protein backbones:unique functions,mechanisms,and challenges[J].Biochemistry,2018,57(2):177-185.
[5]Fujii N,Ishibashi Y,Satoh K,et al.Simultaneous racemization and i-somerization at specific aspartic-acid residues in alpha-b-crystallin from the aged human lens[J].Biochimica Et Biophysica Acta-Protein Structure and Molecular Enzymology,1994,1204(2):157-163.
[6]Fujii N,Sakaue H,Sasaki H,et al.A Rapid,Comprehensive liquid chromatography-mass spectrometry(LC-MS)-based survey of the asp isomers in crystallins from human cataract lenses[J].Journal of Bio-logical Chemistry,2012,287(47):39992-40002.
[7]Sugiki T,Utsunomiya-Tate N.Site-specific aspartic acid isomerization regulatesself-assembly andneurotoxicity ofamyloid-β[J].Biochemical and Biophysical Research Communications,2013,441(2):493-498.
[8]Tochio N,Murata T,Utsunomiya-Tate N.Effect of site-specific amino acid D-isomerization onβ-sheet transition and fibril formation pro-files of Tau microtubule-binding repeat peptides[J].Biochemical and Biophysical Research Communications,2019,508(1):184-190.
[9]Yan Y T,Wei H,Fu Y,et al.Isomerization and oxidation in the com-plementarity-determining regions of a monoclonal antibody:A study of the modification-structure-function correlations by hydrogen-deuteri-um exchange mass spectrometry[J].Analytical Chemistry,2016,88(4):2041-2050.
[10]Inoue K,Hosaka D,Mochizuki N,et al.Simultaneous determination of post-translational racemization and isomerization of n-terminal amyloid-βin alzheimer's brain tissues by covalent chiral derivatized ultraperformance liquid chromatography tandem mass spectrometry[J].Analytical Chemistry,2014,86(1):797-804.
[11]Moro M L,Phillips A S,Gaimster K,et al.Pyroglutamate and Isoas-partate modified amyloid-Beta in ageing and Alzheimer's disease[J].Acta Neuropathologica Communications,2018,6(1):3.
[12]Zheng X Y,Deng L L,Baker E S,et al.Distinguishing D-and L-as-partic and isoaspartic acids in amyloidβpeptides with ultrahigh resolution ion mobility spectrometry[J].Chemical Communications,2017,53(56):7913-7916.
[13]Dutta S,Foley A R,Warner C J A,et al.Suppression of oligomer for- mation and formation of non-toxic fibrils upon addition of mir-ror-image aβ42 to the natural l-enantiomer[J].Angewandte Chemie-International Edition,2017,56(38):11506-11510.
[14]Foley A R,Lee H W,RaskatovJ A.A focused chiral mutant library of the amyloidβ42 central electrostatic cluster as a tool to stabilize aggregation intermediates[J].Journal of Organic Chemistry,2020,85(3):1385-1391.
[15]Zatsepina O G,Kechko O I,Mitkevich V A,et al.Amyloid-βwith isomerized Asp7 cytotoxicity is coupled to protein phosphorylation[J].Scientific Reports,2018(8):3518.
[16]Sakai-Kato K,Naito M,Utsunomiya-Tate N.Racemization of the amyloidalβAsp residue blocks the acceleration of fibril formation caused by racemization of the Asp residue[J].Biochemical and Biophysical Research Communications,2007,364(3):464-469.
[17]Fujii N,Takata T,KimI,et al.Simultaneous and Rapid Detection of Multiple Epimers and Isomers of Aspartyl Residues in Lens Proteins Using an LC-MS-MRM Method[J].Acs Omega,2020,5(42):27626-27632.
[18]Readel E R,Wey M,Armstrong D W.Rapid and selective separation of amyloid beta from its stereoisomeric point mutations implicated in neurodegenerative Alzheimer's disease[J].Analytica Chimica Acta,2021,1163:338506.
[19]Tao Y Q,Julian R R.Identification of amino acid epimerization and isomerization in crystal lin proteins by tandem LC-MS[J].Analyti-cal Chemistry,2014,86(19):9733-9741.
[20]Ozaki M,Kuwayama T,Hirose T,et al.Separation and identification of the DL-forms of short-chain peptides using a new chiral resolution labeling reagent[J].Analytical and Bioanalytical Chemistry,2022,414(14):4039-4046.
[21]Ozaki M,Shimotsuma M,Kuranaga T,et al.Separation of amyloidβ fragment peptides with racemised and isomerised aspartic acid residues using an original chiral resolution labeling reagent[J].An-alyst,2023,148(6):1209-1213.
[22]Lambeth T R,Riggs D L,Talbert L E,et al.Spontaneous isomerization of long-lived proteins provides a molecular mechanism for the lysosomal failure observed in alzheimer's disease[J].Acs Central Science,2019,5(8):1387-1395.
[23]Maeda H,Takata T,Fujii N,et al.Rapid survey of four asp isomers in disease-related proteins by LC-MS combined with Commercial En-zymes[J].Analytical Chemistry,2015,87(1):561-568.
[24]Du S Q,Readel E R,Wey M,et al.Complete identification of all 20 relevant epimeric peptides inβ-amyloid:a new HPLC-MS based analytical strategy for Alzheimer's research[J].Chemical Communi-cations,2020,56(10):1537-1540.










