微生物合成唾液酸及唾液酸乳糖的研究进展论文
2024-09-26 13:58:36 来源: 作者:dingchenxi
摘要:唾液酸与唾液酸乳糖在生物体内能够发挥多种生物学功能,在食品、保健品、医药和化妆品等产品生产中的应用也十分广泛。
摘要:唾液酸与唾液酸乳糖在生物体内能够发挥多种生物学功能,在食品、保健品、医药和化妆品等产品生产中的应用也十分广泛。然而,传统合成方法效率低下,无法满足日益增长的市场需求,因此研发可持续的生物技术以高效、安全地合成唾液酸和唾液酸乳糖受到了社会各界的强烈关注。文章对生物合成唾液酸与唾液酸乳糖的技术路线,包括基于蛋白质工程的体外酶催化与全细胞催化,以及基于合成生物学的细胞工厂,进行了系统的总结和比较,分析了后续进一步提高产量的策略,并展望了菌株改造未来的发展方向。
关键词:唾液酸;唾液酸寡糖;合成生物学;HMO
唾液酸是一类重要的功能性糖,是母乳寡糖(HMOs)中唾液酸寡糖的单体,唾液酸的主要形式是N-乙酰神经氨酸(NeuAc),而唾液酸乳糖的主要形式是3'-唾液酸乳糖(3'-SL)和6'-唾液酸乳糖(6'-SL)。唾液酸和唾液酸乳糖因具有突出的生理活性,在国内外市场备受青睐,市场发展空间巨大。但是,就目前的情况来看,唾液酸和唾液酸乳糖的产量远远无法满足人们日益增长的需求。因此,利用合成生物学技术开发更高效、更经济的产品生物合成路线,以扩大生产规模、提高生产效率、满足食品工业的发展需求,是食品行业需要思考的问题。
1唾液酸与唾液酸乳糖概况
唾液酸,又名神经氨酸,是一种天然存在的9-碳氨基糖。目前已发现的唾液酸有50多种,其常见的形式为N-乙酰神经氨酸(NeuAc)。唾液酸也被称为燕窝酸,是燕窝中的主要活性成分,具有调节IgG的抗炎活性,可增强机体的免疫力,影响神经细胞的完整性、渗透性及活性,且作为药物在癌症、炎症及流感等疾病的治疗中发挥着重要作用。2016年,美国FDA批准唾液酸用于婴儿奶粉和普通食品(通过GRAS认证);2017年,欧洲食品安全局批准唾液酸作为新食品原料[1]。在国内,N-乙酰神经氨酸作为一种天然存在的“新食品原料”,已通过国家卫生健康委员会的审批,并通过了国家药监局的“化妆品原料”备案,是“妆食同源”的市场热门产品。
唾液酸是母乳寡糖(HMOs)中唾液酸化寡糖的单体,其NeuAc可通过α-2,3或α-2,6糖苷键连接到乳糖分子的半乳糖上,形成3'-唾液酸乳糖(3'-SL)和6'-唾液酸乳糖(6'-SL)。3'-SL和6'-SL是结构最简单的唾液酸寡糖,分别占母乳中总母乳寡糖含量的3%和6%[2]。唾液酸乳糖有助于促进肠道益生菌在肠道上皮增殖、定植,维持婴儿肠道菌群平衡,同时还能够显著抑制病原菌黏附及促进婴儿脑部发育等。3'-SL和6'-SL分别于2018年和2020年获得了美国FDA的批准,被广泛应用于婴幼儿配方奶粉的生产中。在国内,目前HMOs中的2’-岩藻糖基乳糖(2’-FL)作为食品添加剂的新品种,已有3家获得添加批准,而3'-SL和6'-SL也有多家公司正在注册申报中。相信HMOs在国内获批,将打开中国的高端奶粉市场,显著提升国产奶粉的竞争力。
2酶催化合成唾液酸与唾液酸乳糖
2.1体外酶催化合成唾液酸
体外酶法合成Neu5Ac的路线有2条,分别以UDP-N-乙酰葡萄糖胺(UDP-GlcNAc)和N-乙酰葡萄糖胺(GlcNAc)为前提。由于UDP-GlcNAc不稳定且价格高,且UDP再生困难,因此关于通过该路线合成唾液酸的研究相对较少。体外酶催化主要以GlcNAc为底物,先在AGE异构酶的作用下生成N-乙酰甘露糖胺(ManNAc),再经醛缩酶(nanA)作用与丙酮酸缩合生成NeuAc。然而,醛缩酶nanA是一种可逆酶,在反应过程中需添加高浓度丙酮酸以推动反应正向进行,增加Neu5Ac的生产成本。目前,酶活性较高的AGE主要来源于藻类,如Synechocystis sp.,Anabaena sp.等,而nanA主要来源于E.coli。南工大应汉杰课题组采用酶法合成NeuAc的产量为102 g/L,采用双酶固定化工艺,37℃条件下反应24 h,通过GlcNAc计算得出转化率为82%,酶连续套用5批次后残余酶活为75%[3]。双酶催化工艺路线简单,可显著提高nanA正反应活性,降低其逆反应活性,从而有效减少反应中丙酮酸的添加量,达到控制成本的目的。该路线的第2步也可以以PEP为辅底物,在唾液酸合成酶(neuB)的催化作用下合成唾液酸,虽然此酶不可逆,但PEP价格高且不易积累。因此,NeuB路线主要以全细胞催化为主。
2.2全细胞催化合成NeuAc
全细胞催化以唾液酸的中间体为底物,通过活性细胞或静息细胞的胞内酶催化中间体合成目标产物,具体机理如图1所示。与体外酶催化相比,全细胞催化无须对细胞进行预处理便可制备粗酶液,同时也无须添加昂贵的辅因子,便可有效降低生产成本。
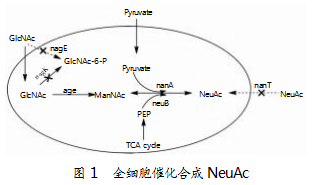
台湾Yen-Chung Lee课题组在大肠杆菌BL21(DE3)中进行了AGE和NanA的共表达,并将2个酶的表达量调整至最佳比例1∶2,以GlcNAc和丙酮酸为底物进行全细胞催化,最终合成了412.6 mM(127.6 g/L)的唾液酸,GlcNAc转化率为47%,生产强度可达到15.9 g/L/h[4]。江南大学陈献忠老师的课题组,首先对E.coli BL21(DE3)底盘加以改良,并敲除与中间产物GlcNAc降解途径相关的酶基因nagE,同时敲除唾液酸的胞内转运蛋白nanT,实现唾液酸在胞外的高浓度积累。随后,其对N-乙酰神经氨酸裂解酶(NAL)进行筛选和改造,并采用启动子策略对AGE和NAL酶的表达量进行优化与调整,最终使唾液酸的产量达到102.7 g/L(332.3 mM),GlcNAc转化率达到58.6%,生产强度达到9.12 g/L/h[5]。上海交通大学生命科学与技术研究院许平团队开发了一种新策略,利用快速生长的纳特里根弧菌(Vibrio natriegens)、嗜热酶和高温全细胞催化实现了细胞的高性能生产,并将燕窝酸(N-乙酰基-d-神经氨酸(NeuAc)、唾液酸)作为目标产物对其进行验证。结果表明,该策略的应用可将燕窝酸的滴度提升至126.1 g/L,生产率提高至71.6 g/(L·h),比大肠杆菌的生产率高出了7.2倍[6]。由于高温减少了复杂的副反应,所以其主要副产物醋酸也能够被消除。
总体来说,全细胞催化合成的NeuAc的产量和生产强度都比较高,后处理较为简单,且不需要添加额外辅因子ATP。但是,GlcNAc的转化率均<60%,而且需要添加高浓度丙酮酸来推动反应,导致其生产成本较高。
2.3酶催化合成唾液酸乳糖
唾液酸乳糖是以唾液酸为糖基供体,通过酶将α-2,3或α-2,6糖苷键与乳糖相连接而形成的。酶催化合成唾液酸乳糖的第一种策略是糖苷酶路线,即利用糖苷酶水解的逆反应合成糖苷键。丹麦Mikkelsen采用来自Trypanosoma rangeli的可逆唾液酸水解酶Tr6,对该酶进行理性改造,以乳制品中的酪蛋白糖巨肽cGMP-NeuAc为底物通过一步法合成3’-SL。最终,3’-SL的产量可达到3.6 g/L,cGMP-NeuAc的转化率为50%,且形成的3’-SL不会被Tr6进一步水解[7]。该课题组还采用来源于Pasteurella multocida的唾液酸水解酶,同时合成3’-SL和6’-SL,但产量和转化率都相对较低。采用唾液酸水解酶逆反应合成的唾液酸乳糖,其糖基供体无须活化,一步酶催化即可,工艺非常简单。但由于水解和转糖基存在反应平衡,转化率通常不高,且转糖基的位点选择性较差,故不利于产物后续的分离纯化。
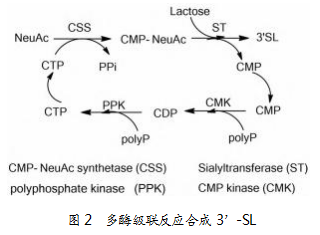
酶催化合成唾液酸乳糖的第二种策略是糖基转移酶路线,即先对唾液酸加以活化,再在糖基转移酶的作用下与受体乳糖结合形成唾液酸乳糖,具体机理如图2所示。中国科学技大学姚建明课题组,采用体外多酶级联催化,利用CMP-唾液酸合酶(CSS)进行唾液酸活化,然后通过α-2,3唾液酸转移酶合成了3’-SL,辅因子三磷酸胞苷(CTP)用CMP-唾液酸合成酶(CMK)和多聚磷酸激酶(PPK)进行循环利用。同时,针对敲除宿主E.coli的乳糖降解基因lacZ,利用酶催化工艺对其进行系统优化,最终发现在32℃的条件下反应6 h,3’-SL产量能达到24 g/L,NeuAc的转化率可达到97%[8]。该路线中,所有酶均在BL21中单独表达,因此粗酶的制备相对繁琐,工艺较为复杂。随后,该课题组又采用四个酶构建了2个质粒,在BL21(DE3)中共表达了全细胞催化路线,同时不仅敲除了lacZ,还敲除了唾液酸降解途径的相关基因nanETKA,最终经过工艺优化,使3’-SL产量达到了33 g/L,NeuAc的转化率达到了98%[9]。
与粗酶液相比,全细胞催化合成唾液酸乳糖的工艺更为简单,但其转化过程仍需以昂贵的唾液酸为底物,同时还需要添加辅因子CTP,生产成本相对较高。因此,建立高效的细胞工厂,采用de novo从头合成的发酵路线优势凸显。
3微生物发酵法合成唾液酸与唾液酸乳糖
3.1微生物发酵法合成唾液酸
采用先进的合成生物学技术,在细胞工厂中定向植入产物的生物合成路径,并对其生长代谢过程进行系统平衡与优化,以葡萄糖、甘油、纤维素等廉价物质为碳源,通过精细发酵一步合成目标产物,是目前利用生物法合成精细化学品的重要趋势。
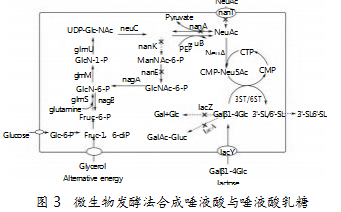
随着合成生物学技术的兴起和飞速发展,近年来涌现了大量关于生物发酵法合成唾液酸的研究。其中,以大肠杆菌E.coli和枯草芽孢杆菌B.subtilis为主,包括UDP-GlcNAc和GlcNAc路线,具体机理如图3所示。江南大学沐万孟老师课题组[10],以BL21(DE3)为底盘,采用UDP-GlcNAc路线,对唾液酸合成路线的关键酶基因neuC、neuB、glmM、glmU和glmS*进行过表达,同时敲除了中间产物降解基因nanA、nanT、nanK和nagB,以甘油为碳源,在5 L罐中发酵57 h后产量可达到46.92 g/L,生产强度可达到0.82 g/L/h。江南大学刘延峰老师课题组[11],以B.subtilis为底盘,同时在细胞内强化UDP-GlcNAc和GlcNAc路线,对neuC、neuB、GNA1、age和nanE基因进行过表达,并且对中间产物的降解途径进行阻断,在5 L罐中发酵154 h后,产量达到了30.1 g/L,生产强度为0.19 g/L/h。
B.subtilis属于通过Gras认证的菌株,以其为底盘,在产物安全性及后续法规获批方面可能会更具优势,但相比于E.coli底盘,其产量和生产强度较低,生产成本偏高。同时,国内对转基因微生物的政策正在逐步放宽,利用E.coli发酵合成的营养强化剂2’-岩藻糖基乳糖(2’-FL)等产品已陆续获批,相信后续利用转基因技术及E.coli合成食品原料的途径也将逐步打开。
3.2微生物发酵法合成唾液酸乳糖
唾液酸乳糖的生物合成途径与唾液酸类似,仅需要CMP-唾液酸合成酶NeuA,以及糖基转移酶3'-SL和6'-SL,具体机理如图4所示。
日本Ozaki用4个菌进行混菌发酵,在外源添加乳清酸、乳糖和NeuAc的条件下,反应11 h后3’-SL的产量可达到33 g/L,NeuAc转化率可达到85%[12]。发酵过程中CTP的合成与糖基转移酶活性是限速因素,同时由于跨细胞催化,改善细胞膜通透性以减少传质阻力也是限速因素之一。另外,构建高产UTP的底盘细胞需要耗费大量精力。后续也有将4个菌融合构建成一个菌进行的催化反应,但3’-SL产量非常低。法国Samain课题组以E.coli K12为底盘细胞,通过质粒过表达基因Campylobacter jejuni的neuABC,对源于Neisseria meningitidis的α-2,3唾液酸转移酶(ST)进行过表达,敲除中间产物降解基因nanAK和乳糖降解基因lacZ,通过流加甘油和乳糖进行高密度发酵,发酵总周期为70 h,发酵结束后3’-SL的胞内产量为10 g/L,胞外产量为15.5 g/L,总产量可达25.5 g/L[13]。其中,neuA会受到产物CMP-NeuAc的反馈抑制。该课题组以同样的路线又合成了6’-SL,仅仅是将糖基转移酶替换成6’-SL,发酵48 h后产量就可达到34 g/L,胞内产量为11 g/L,胞外产量为23 g/L[14]。中国科学院合肥物质科学研究院,以BL21为底盘,采用1个质粒过表达NeuABC和3’-SL基因,另1个质粒过表达CTP循环所需的CMK和PPK,发酵90 h后,3’-SL的产量可达到45 g/L。江南大学沐万孟课题组,同样采用质粒引入3’-SL来合成相关外源蛋白,同时利用Crispr-cas9基因编辑技术强化前体UDP-GlcNAc供给,并对糖基转移酶3’-SL进行筛选,最终发酵产量达到了31.4 g/L,胞外3’-SL的含量占比为73.6%[15]。
微生物发酵合成3’-SL是当前的主流技术,大部分研究都是以E.coli为底盘进行的,通过质粒表达引入3’-SL的外源基因,并利用“推-拉-阻”的策略优化系统代谢。为进一步提高发酵产量,一方面,可以加强对糖基转移酶的筛选和改造,以获得专一性高、酶活性强的糖基转移酶,并将碳流不断拉向产物合成方面;另一方面,目前文献显示仍有大量3’-SL在胞内积累,因此转运蛋白的筛选和活性测试是关键。将产物不断运输至胞外,不仅能实现其在发酵过程中的高浓度积累,还能避免产物在胞内进一步降解,以及相关杂质的生成。
4结语
近些年来,随着代谢工程、蛋白质工程,以及合成生物学工具和策略的发展,唾液酸与唾液酸乳糖已取得重大进展。后续为进一步激发微生物合成唾液酸与唾液酸乳糖的生产潜力,可以从以下几方面入手。第一,代谢途径的优化。主要利用“推-拉-阻”的策略,并结合合成生物学的DBTL循环、动态调控策略进行系统优化,以取得菌体生长与代谢产物的平衡。第二,糖基转移酶的筛选与改造。主要针对糖基转移酶的选择性、专一性与活性进行,并通过增强糖基转移酶的性能来进一步提高产物转化率。第三,辅因子循环。在唾液酸与唾液酸乳糖的合成过程中,需要利用UDP、CTP,因此构建辅因子循环路线有助于进一步提高产品的合成效率与产量。第四,泵蛋白筛选。唾液酸与唾液酸乳糖在细胞内都存在特异的转运系统,因此采用Crispr-cas9技术强化相关运出泵蛋白的表达,并将运至胞内的泵蛋白予以弱化和敲除,不仅可以进一步提高产物在发酵液中的积累浓度,还可以降低产物在胞内进一步生成其他杂质的风险。另外,考虑到唾液酸与唾液酸乳糖主要是作为食品原料与食品添加剂得以应用的,后续研究可以考虑采用无质粒和无抗生素的路线,在不引入抗性基因的基础上,将相关基因整合到基因组中。一方面,可以保持菌种传代的稳定性;另一方面,也可以避免在食品安全生产中使用抗生素,这可能是唾液酸与唾液酸乳糖更具应用前景的生产方法。
参考文献
[1]ZHANG X,LIU Y,LIU L,et al.Microbial production of sialic acid and sialylated human milk oligosaccharides:Advances and perspectives[J].Biotechnology Advances,2019,37(5):787-800.
[2]BYCH K,MIKŠH M,JOHANSON T,et al.Production of HMOs using microbial hosts—from cell engineering to large scale production[J].Current Opinion in Biotechnology,2019,56:130-137.
[3]JIAN C,WEI Z,CHENGLUN T,et al.Efficient immobilization of AGE and NAL enzymes onto functional amino resin as recyclable and high-performance biocatalyst.[J].Bioprocess and Biosystems Engineering,2017,40(3):331-340.
[4]CHAOHUNG K,YIHYUAN C,LIANREN W,et al.Production ofN-acetyl-D-neuraminic Acid by Recombinant Single Whole Cells Co-expressing N-acetyl-D-glucosamine-2-epimerase and N-acetyl-D-neuraminic Acid Aldolase.[J].Molecular Biotechnology,2018,60(6):427-434.
[5]CHEN X,ZHOU J,ZHANG L,et al.Development of an Escherichia coli-based biocatalytic system for the efficient synthesis of N-acetyl-D-neuraminic acid[J].Metabolic Engineering,2018,47:374-382.
[6]YUAN P,LINA M,PING X,et al.High-Performance Production of N-Acetyl-d-Neuraminic Acid with Whole Cells of Fast-Growing Vibrio natriegens via a Thermal Strategy.[J].Journal of Agricultural and Food Chemistry,2023,2023(50):20198-20209.
[7]MICHALAK M,LARSEN M D,JERS C,et al.Biocatalytic production of 3′-sialyllactose by use of a modified sialidase with superior trans-sialidase activity[J].Process Biochemistry,2014,49(2):265-270.
[8]LI Z,NI Z,CHEN X,et al.Multi-Enzymatic Cascade One-Pot Biosynthesis of 3′-Sialyllactose Using Engineered Escherichia coli[J].Molecules,2020,25(16):3567.
[9]ZHONGKUI L,XIANGSONG C,ZHIJIAN N,et al.Efficient Production of 3′-Sialyllactose by Single Whole-Cell in One-Pot Biosynthesis[J].Processes,2021,9(6):932.
[10]MINGLI Z,YINGYING Z,HAO W,et al.Efficient Production of N-Acetylneuraminic Acid in Escherichia coli Based on the UDP-N-Acetylglucosamine Biosynthetic Pathway.[J].Journal of Agricultural and Food Chemistry,2023,71(28):10701-10709.
[11]XIAOLONG Z,CHENYUN W,XUEQIN L,et al.Engineering of Synthetic Multiplexed Pathways for High-Level N-Acetylneuraminic Acid Bioproduction.[J].Journal of Agricultural and Food chemistry,2021,69(49):14868-14877.
[12]T E,S K,K T,et al.Large-scale production of CMP-NeuAc and sialylatedoligosaccharides through bacterial coupling[J].Applied Microbiology and Biotechnology,2000,53(3):257-261.
[13]FIERFORT N,SAMAIN E.Genetic engineering of Escherichia coli for the economical production of sialylated oligosaccharides[J].Journal of Biotechnology,2008,134(3):261-265.
[14]DROUILLARD S,MINE T,KAJIWARA H,et al.Efficient synthesis of 6′-sialyllactose,6,6′-disialyllactose,and 6′-KDO-lactose by metabolically engineered E.coli expressing a multifunctional sialyltransferase from the Photobacterium sp.JT-ISH-224[J].Carbohydrate Research,2010,345(10):1394-1399.
[15]JIAMENG Z,YINGYING Z,WENLI Z,et al.EfficientProduction of a Functional Human Milk Oligosaccharide 3'-Sialyllactose in Genetically Engineered Escherichia coli[J].ACS Synthetic Biology,2022,11(8):2837-2845.










