贝类细胞自噬与凋亡的研究进展论文
2024-09-20 11:15:34 来源: 作者:dingchenxi
摘要:自噬和凋亡是细胞命运调控的两种基本病理生理机制。现有通过对哺乳动物进行研究发现,参与反应的信号通路通过各种串扰机制相互连接。然而,关于双壳贝类等无脊椎动物中的自噬和凋亡串扰的研究仍相对较少。
摘要:自噬和凋亡是细胞命运调控的两种基本病理生理机制。现有通过对哺乳动物进行研究发现,参与反应的信号通路通过各种串扰机制相互连接。然而,关于双壳贝类等无脊椎动物中的自噬和凋亡串扰的研究仍相对较少。基于此,文章主要介绍细胞自噬和凋亡的分子机制及两者之间的联系,并对双壳贝类的自噬和凋亡的研究进展进行论述,从而探讨自噬与凋亡在水生生物发育和进化过程中的关键作用,以期为进一步探索无脊椎动物自噬与凋亡的分子机制奠定理论基础。
关键词:自噬;凋亡;贝类
死亡和新生在生物体进化和发育过程中不断循环,细胞衰老、受损,以及大分子物质的错误装配不断给细胞生存施加着压力。因此,为了维持细胞内的稳态平衡,机体会通过自噬来及时分解掉折叠异常的蛋白质和受损细胞器等,从而获得可供细胞循环利用的大分子物质及能量。普遍情况下,低水平的自噬是机体促进细胞应激,使细胞得以存活的一种适应途径。例如,细胞受到外源环境变化刺激而做出应激反应时,会诱导自身启动自噬作用,从而对机体产生保护作用[1]。然而,如果在发育过程中持续施加负面刺激,导致过度的自噬反应,就会使细胞稳态失衡,走向死亡,这也被称为“Ⅱ型”细胞死亡。“I”型细胞死亡——程序性细胞死亡(PCD)之一,受到细胞的严格程序调控,能够诱导细胞进行自我销毁。其对于通过控制细胞的生长、发育和更新来维持体内平衡的多细胞生物至关重要。作为程序性细胞死亡的两种不同形式,区分“I”型和“Ⅱ”型细胞死亡的调控方式非常困难。某些自噬相关基因在不断调控着细胞凋亡。同时,细胞凋亡机制中处于中心地位的Caspase半胱氨酸蛋白酶家族和Bcl-2蛋白家族也在调节“I”型细胞死亡的过程中发挥着举足轻重的作用。对于哺乳动物而言,许多疾病的致病机制都与细胞自噬和凋亡的生物学机制有关。同样的,在双壳贝类等无脊椎动物中,细胞自噬和凋亡作为生物体的先天免疫应答,也是细胞抵抗外源环境刺激、维持内环境稳态的重要机制。
1细胞自噬
自噬(autophagy)是真核细胞在自噬相关基因(autophagy related gene,Atg)的调控下,利用溶酶体降解自身细胞质蛋白和受损细胞器的过程,在哺乳动物和无脊椎动物的分化和发育中至关重要,是对环境刺激的快速反应。
在哺乳动物中,根据被降解物质的特性和到达溶酶体方式的不同,可以将自噬分为巨自噬(macroautophagy)、微自噬(microautophagy)和分子伴侣介导的自噬(chaperonemediated autophagy,CMA)。巨自噬即广义上的自噬,作为经典的自噬途径得到了广泛研究。其典型特征是形成具有双层膜的独特细胞器——自噬体。当细胞内出现需要降解的大分子物质或受损细胞器时,“吞噬细胞”的序列膜就会识别出待降解的物质并形成隔离膜,进而通过不断摄取延长膜结构,逐渐弯曲成球形,形成具有双层膜结构的自噬体,并将自噬底物包裹在自噬体中。自噬体通过与晚期内吞体(late endosome)及溶酶体的融合,形成自噬溶酶体(autolysosome),从而降解内含物,使氨基酸、脂肪酸等生命活动所必需的物质被输送进细胞质中并重新得到利用。
通过对果蝇、秀丽隐杆线虫和其他无脊椎动物等的研究发现,自噬异常会导致发育异常,包括唾液腺发育、蛋白质聚集、清除凋亡细胞异常,以及发育迟缓等现象[2]。许多与哺乳动物同源的自噬相关基因都参与到了调控生物体生长发育的过程中。脾酪氨酸激酶(Syk)是一种免疫受体信号转导的调节因子,大量研究证明,Syk具有激活自噬的重要作用。对于哺乳动物而言,在氧化低密度脂蛋白(oxidized LDL)的作用下,Sky可以通过激活自噬调节巨噬细胞主要组织相容性复合物MHC-Ⅱ的表达。从太平洋牡蛎中鉴定出的Syk同源基因可以通过诱导自噬相关基因的mRNA表达和CgLC3的裂解来调控牡蛎的自噬,从而抵御牡蛎细菌的入侵[3]。自噬相关16样(ATG16L)蛋白也是一种核心自噬蛋白,可通过微管相关蛋白轻链3(LC3)促进自噬体膜的延伸。给太平洋牡蛎弧菌施加刺激后,在血细胞中可以观察到CgATG16L1和CgLC3的共定位。干扰CgATG16L1的表达后,血细胞中可以观察到的自噬体和自体溶酶体的数量会有所减少,表明自噬相关蛋白16L1在太平洋牡蛎的抗菌免疫反应中促进了自噬体和自溶酶体的形成[4]。近年来,越来越多的学者致力于研究生态环境变化对生物的影响。自噬是一种高度保守的进化生存或防御过程,能够支持细胞和生物体在环境压力下生存。然而,自噬也是正常细胞生理学的一部分,在正常条件下可促进细胞成分更新,虽然很容易受到轻微的环境压力而有所增强,但也会因严重的氧化应激而发生功能失调,导致细胞病变。例如,化学污染物会诱导蓝贻贝肝胰腺(消化腺)产生氧化应激,造成溶酶体损伤和功能失调的自噬;波动的环境状态会促进蓝贻贝肝胰腺中自噬体与溶酶体的结合,产生低水平自噬,以抵抗环境诱导的氧化应激对机体的伤害[5]。
2细胞凋亡
凋亡(apoptosis)作为一种细胞程序性调控死亡的途径,主要受Caspase半胱氨酸和Bcl-2两大蛋白家族的调控。Caspase家族蛋白存在于细胞质中,在不同的生物中具有很高的同源性,均含有一个半胱氨酸激活位点的结构特点和天冬氨酸残基后肽键的特异性断裂。目前已经发现的Caspases有14种,广泛作用于多种生物学过程的调节中,与细胞凋亡密切相关。其中,促凋亡Caspases主要包括Caspase-2、Caspase-8、Caspase-9、Caspase-10、Caspase-3、Caspase-6、Caspase-7。它们对胞内蛋白的高效切割主要是通过级联放大的方式进行的,且最终会造成细胞的程序性凋亡。其被分为两派,其中Caspase-2、Caspase-8、Caspase-9、Caspase-10参与细胞凋亡的起始(启动者,initiators),而Caspase-3、Caspase-6、Caspase-7参与细胞凋亡的执行(效应者,effectors)。Bcl-2蛋白家族通过控制线粒体膜的通透性来调控细胞凋亡。Bcl-2和Bcl-xL中的抗凋亡蛋白附着在线粒体外膜上,抑制细胞色素C(cytochrome C)的释放。促凋亡的Bcl-2蛋白Bad、Bid、Bax和Bim在细胞质中待命,在接收到死亡信号后转移到线粒体中促进细胞色素C的释放。虽然线粒体膜通透性和凋亡过程中cytochrome C释放的调节机制尚未完全明确,但已知Bcl-xL、Bcl-2和Bax能够影响电压依赖性阴离子通道(VDAC),这可能对于调节cytochrome C的释放具有一定的作用[6]。海洋毒素刺激会诱导太平洋牡蛎的免疫系统产生包括细胞凋亡在内的多种类型的程序性细胞死亡。有毒的甲藻(Gymnodinium catenatum)能够产生麻痹性贝类毒物(PSP),而这些毒物会被双壳类动物吸收并在其体内积累。研究证明,PSP可以通过半胱天冬酶依赖性凋亡途径来诱导扇贝免疫细胞凋亡[7]。同时,也可以通过增加凋亡相关基因Caspase-3的表达来诱导盘状鲍鱼(Haliotis discus hannai)的细胞凋亡[8]。细胞凋亡诱导因子(AIF)具有诱导半胱天冬酶非依赖性细胞凋亡的经典功能。牡蛎中细胞凋亡诱导因子AIF同系物(命名为CgAIF1)是牡蛎中保守的AIF1成员,可通过诱导细胞凋亡参与免疫反应[9]。ATF6的同源物CgATF6β通过调控CgGRP78、CgCNX和CgBcl-2的表达,可参与到弧菌刺激后牡蛎血细胞凋亡的抑制过程中[10]。
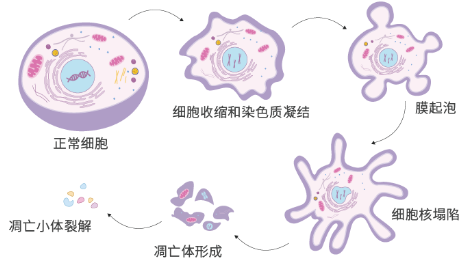
3自噬与凋亡的相互关系
细胞自噬与凋亡之间的联系纷繁多样。在缺氧、毒素侵袭等环境应激条件下,细胞自噬会被诱导做出免疫应答,而在受到持续应激时,细胞受到的压力会超出“阈值”,从而激活细胞凋亡。关于这两个途径的转换方式及其“串扰”的分子机制仍在不断探索中,而自噬和凋亡过程中所涉及的关键调节蛋白在双向调节细胞程序性死亡过程中的作用,成为近年来研究两者之间关系的重点。
3.1自噬调节凋亡
研究表明,自噬和凋亡并不是完全独立的两种免疫途径。例如,硬蛤(Mercenaria mercenaria)对空气暴露应激的抵抗力来源于血细胞中产生的自噬反应,而细胞凋亡的激活滞后于自噬,自噬与细胞凋亡之间的关系会随着应激持续时间的延长从拮抗转变为协同作用[11]。病毒和细菌感染也会诱导自噬发生。例如,弧菌感染牡蛎能够诱导牡蛎细胞中的自噬反应启动,而抑制细胞自噬会导致细胞质出现空泡化,从而进一步引发细胞凋亡,减弱淋巴免疫细胞的杀菌能力。同时,弧菌感染还会诱导机体应对氧化应激和能量过剩带来的生理压力,包括超氧阴离子(O2-)和过氧化氢(H2O2)等活性氧自由基(ROS)的积累以及磷酸腺苷(AMP)的产生。AMP和H2O2不仅能够单独引发自噬,还能通过协同的方式激活自噬关键的信号通路AMPK,通过抑制AMPK磷酸化或清除过量的ROS,阻断感染所诱导的自噬发生[12]。
3.2凋亡调节自噬
调控细胞凋亡机制的蛋白家族成员可以通过与自噬相关蛋白的相互作用直接影响自噬。Beclin-1与Bcl-2相结合会使自噬受到抑制,从而导致细胞凋亡。然而,当BNIP3螯合Bcl-2时,Beclin-1可以自由地诱导自噬,从而导致自噬细胞死亡[13]。Caspase蛋白家族作为调控细胞凋亡的另一个重要家族,被认为是凋亡细胞死亡反应中的主要介质。其在自噬形成过程中的作用不容忽视,在干扰太平洋牡蛎中Caspase-8的同源基因CgCaepase-8-2后,用紫花弧菌施加刺激,会发现CgATG5和CgBeclin1的mRNA表达显著降低,而CgBcl2的mRNA表达显著升高,这一现象表明CgCaspase-8-2不仅参与对细胞凋亡的调控,还参与自噬相关基因的表达[14]。
4结论
综上所述,细胞自噬与细胞凋亡之间的关系错综复杂,当前关于细胞自噬与细胞凋亡机制在各种哺乳动物疾病治疗中的应用的研究愈发广泛。细胞的自噬和凋亡作为两种不同的细胞程序性死亡途径,不可以被独立看待,而应视为一个密切相关且十分复杂的过程。自噬与凋亡“串扰”过程中的关键调节蛋白往往对自噬和凋亡具有双重调节作用,但是两者之间的互相转换机制以及相关调节蛋白对细胞生存的影响仍需进一步明确。同时,自噬和凋亡作为贝类先天免疫应答中不可或缺的一环,在探索水生生物应对生态环境变化、应激环境污染物刺激的分子层面表达等方面发挥着重要作用。目前,关于自噬与凋亡对无脊椎动物,尤其是水生双壳类生物生长发育的影响知之甚少。随着研究的不断深入,哺乳动物体内越来越多的交互因子、同源蛋白及细胞信号转导通路被研究人员所发现,生物进化的规律也使双壳类生物先天免疫应答的神秘面纱被逐渐揭开,越来越多的文献致力于研究两者在拮抗和协同水生生物抵抗环境应激中的作用。这对于探索贝类等无脊椎动物的进化差异,以及进一步维护生态环境的稳定性,具有非常重要的意义。
参考文献
[1]王欣琦,贾颜鸿,周童,等.自噬性细胞死亡与凋亡相互影响作用的研究进展[J].中国实验诊断学,2020,24(12):2058-2061.
[2]HU Y X,HAN X S,JING Q.Autophagy in Development and Differentiation[M].Singapore,2019,12(6):469-487.
[3]HONGSHENG Y,JIEJIE S,TONG Z,et al.Syk regulates the haemocyte autophagy through inducing the mRNA expressions of autophagy-related genes and the cleavage of CgLC3 in oyster antibacterial immunity[J].Fish and Shellfish Immunology Reports,2023(4):100085.
[4]WANG W,YANG W W,SUN J J,et al.A autophagy related-like protein 16-1 promotes the formation of autophagosomes and autolysosomes in antibacterial immune response of Pacific oyster Crassostrea gigas[J].Dev Comp Immuno,2023(147):104748.
[5]MOORE M N.Autophagy as a second level protective process in conferring resistance to environmentally-induced oxidative stress[J].Autophagy,2008,4(2):254-256.
[6]LINDSAY J,ESPOSTI M D,GILMORE A P.Bcl-2 proteins and mitochondria-Specificity in membrane targeting for death[J].Biochim Biophys Acta,2011,1813(4):532-539.
[7]ESTRADA A,ASCENCIO F,CONTRERAS R G,et al.Absorption of paralyzing toxins from the dinoflagellate Gymnodinium catenatum in giant lions-paw scallop Nodipecten subnodosus[J].Journal of Shellfish Research,2007,26(4):130.
[8]KIM M J,K J A,LEE D W,et al.Oxidative Stress and Apoptosis in Disk Abalone(Haliotis discus hannai)Caused by Water Temperature and pH Changes[J].Antioxidants(Basel),2023,12(5):1003.
[9]QIAO X,HOU L L,WANG J H,et al.Identification and characterization of an apoptosis-inducing factor 1 involved in apoptosis and immune defense of oyster,Crassostrea gigas[J].Fish&shellfish immunology,2021,119:173-181.
[10]LIU S,WANG W,GE W,et al.An activating transcription factor 6 beta(ATF6β)regulates apoptosis of hemocyte during immune response in Crassostrea gigas[J].Fish&Shellfish Immunology,2020,99:442-451.
[11]ZHOU C,ZOU Y,HU ZH,et al.ROS-induced moderate autophagy of haemocytes confers resistance of Mercenaria mercenaria to air exposure stress[J].2023,141:109084.
[12]ZHANG J,YANG J,GARSTHA M A,et al.Autophagy Dually Induced by AMP Surplus and Oxidative Stress Enhances Hemocyte Survival and Bactericidal Capacity via AMPK Pathway in Crassostrea hongkongensis[J].Frontiers in Cell and Developmental Biology,2020,8:411.
[13]ZHANG Y N,LIU D W,HU H J,et al.HIF-1α/BNIP3 signaling pathway-induced-autophagy plays protective role during myocardial ischemia-reperfusion injury[J].Biomedicine and Pharmacotherapy,2019,120:109464.
[14]LENG J Y,LI Y N,YANG W W,et al.The involvement of CgCaspase-8-2 in regulating the expressions of cytokines,antibacterial peptide and autophagy-related genes in oysters[J].2021,119:145-153.










