三阶段质量管理在药物研发中的应用论文
2024-09-10 13:57:01 来源: 作者:zhouxiaoyi
摘要:文章对比分析了二阶段质量管理与四阶段质量管理的局限性,研究三阶段质量管理的优越性,并以某微生态活菌制药企业在非临床研究模块实施三阶段质量管理的情况作为实践案例进行分析。该企业实施三阶段质量管理后方案偏离率从60%降至25%。通过问卷调研,结果显示有70.59%的员工认为三阶段质量管理对自身工作有较大的促进作用,实施三阶段质量管理达到了良好的效果。基于此,文章分析三阶段质量管理在制药企业质量管理中的可行性应用,为制药企业提升研发质量管理水平提供参考。
摘要:文章对比分析了二阶段质量管理与四阶段质量管理的局限性,研究三阶段质量管理的优越性,并以某微生态活菌制药企业在非临床研究模块实施三阶段质量管理的情况作为实践案例进行分析。该企业实施三阶段质量管理后方案偏离率从60%降至25%。通过问卷调研,结果显示有70.59%的员工认为三阶段质量管理对自身工作有较大的促进作用,实施三阶段质量管理达到了良好的效果。基于此,文章分析三阶段质量管理在制药企业质量管理中的可行性应用,为制药企业提升研发质量管理水平提供参考。
关键词:制药企业;药品研发;三阶段质量管理;风险管理
0引言
三阶段管理来源于现代建筑行业,是工程管理中最常见且高效的质量保证手段。其将建筑工程施工项目的建设过程按照整体项目进度划分为事前和事中、事后三个阶段,这三个阶段互相承接和推进,共同作用于项目的全面质量管理[1-2]。所谓药品研发三阶段质量管理,是根据药品研发各个阶段的特点进行科学合理的设计,从患者的角度出发,综合评价成本-风险-效益,在符合法规要求的基础上,基于风险管控的方式分成研发早期(非GMP期)、研发中期(GMP过渡期)、研发后期(GMP期)三个阶段进行质量管理。非GMP期,是指在药品研发的早期阶段,一般是以研究为目的地开展一系列不符合GMP的项目活动,并在探索过程中将所有试验过程进行记录,并保证全过程信息真实、准确、完整和可追溯[3]。GMP过渡期(GMP-like),是指在药品研发的中期阶段,需参考GMP并按照GLP、GCP、GMP附录等法规要求开展临床研究等活动。GMP期即研发后期,须严格遵照GMP《药品生产质量管理规范》组织生产,旨在最大限度地降低药品生产过程中污染、交叉污染以及混淆、差错等风险,确保持续稳定地生产出符合预定用途和注册要求的药品[4]。
药品研发是一项长期、复杂、需要创新性且分阶段的系统性工程,其中涉及GLP、GCP和GMP等法规明确要求进行质量管理的研发多个环节,同时还涉及没有明确法规或指导原则要求的研发早期阶段,特别是早期的药物发现阶段[1]。由于不同企业的研究方向及研发侧重点不同,相应的质量管理体系还需要结合企业的实际情况进行。因此,如何在新的监管环境下建立一套行之有效但又不阻碍药品研发创造性和灵活性的、同时与研发各个阶段实际发展状况相结合、根据药品研发的特点分阶段管理的质量体系,是我国药物研发企业所面临的巨大挑战[4-5]。
1药品研发二阶段、三阶段和四阶段质量管理的比较
1.1二阶段质量管理及局限性
所谓的二阶段质量管理,是指采用非GMP期(非药品生产质量管理规范,即不符合GMP)和GMP期(药品生产质量管理规范)的二阶段研发质量管理方式,由于缺少了一个过渡区,企业对各阶段质量管理工作“度”的把握不足,非GMP期的质量管理也难以落实,其最终本质上往往还是按照GMP进行管理,造成了“一刀切”的现象[2]。
药品研发质量管理体系的二阶段管理存在“三个不符合”的特点:不符合药品研发的规律和特点,不符合药品研发质量管理的需求,也不符合基于质量风险管理的原则。此外,过去的行业经验已经证明,药品研发质量体系分成两个阶段有很多缺点,包括会造成某些质量管理工作管理得过于严格从而影响研发效率,或因难以实施等原因造成控制不足而导致缺少研发过程中的质量保证。
1.2四阶段质量管理及局限性
制药企业的研发质量管理体系若采用四阶段质量管理,一般划分为:研发早期(非GMP期)、IND注册申报(GMP-like)、I至II期临床试验(包括临床试验用药品的生产,GMP-like)、III期临床试验和上市后(GMP期)这四个阶段,该方式根据研发的特点设计了2个GMP过渡区,但将IND注册申报阶段与临床试验用药品的生产管理分开,会出现以下问题:
(1)会将事情复杂化,提高了企业药品研发质量管理的难度。对于研发型药品企业,临床前研究中开展安全性评价研究的受试物,在药学研究中一般为临床试验用药品代表批次或IND注册申报批次,该受试物应在GMP车间按照GMP附录或参考GMP进行生产,属于GMP过渡期;而I至II期临床试验研究阶段包括临床试验用药品的生产,也属于GMP过渡期。因此,这会导致IND注册申报阶段与I至II期临床试验阶段界限不清晰,增加管理难度。
(2)不同阶段的体系文件将更加复杂。增加2个GMP过渡区,则增加了不同阶段的质量管理体系文件制定、培训、执行、优化的复杂性,而且企业可能还需要额外增加不必要的成本。因此,四阶段质量管理难以制定统一的标准及标准化实施,且管理流程过于庞杂。
1.3三阶段质量管理及优越性
与药品研发的二阶段和四阶段质量管理方式相比,三阶段质量管理方式不仅基于药品研发特点设计了一个过渡期;而且在符合法规要求的基础上,基于质量风险管理对药品研发过程进行方案设计、实施、回顾分析和持续优化。
三阶段质量管理的优越性主要体现在以下四个特点:
(1)合规性是法规要求,也是三阶段质量管理的基本要求。其优越性体现在药品研发不同阶段的相关法规解读和执行的顶层设计上,即:法规要求实施的,就必须执行;法规明确禁止的,就不能实施;法规没有规定是否必须实施的,可以视情况进行。
(2)科学合理性,打破思维障碍,逆向思考。除了满足合规的基本要求外,三阶段质量管理要求改变传统思维模式,逆向思考,灵活且充分地理解法规及指南等要求,对法规没有明确要求执行的,就可以不需要执行;法规未明确禁止的,同样亦可实施。
(3)合理运用QbD理念(质量源于设计)。在药品的研发阶段采用项目管理等方法,制定项目各阶段的节点目标,从预先设定的节点目标出发,基于QbD理念开展系统性研究,持续优化设计方案并进行试验,以符合预期。
(4)将质量风险管理作为评估原则及标准,以衡量成本-风险-效益。由于药品研发运行周期长,研究成本高且研发成功率低,为了保证药品的安全有效、质量稳定可控等,对法规未明确规定是否必须实施的内容,制药企业可以根据企业实际情况按照风险管理的原则开展,以尽可能地寻求企业成本、研发风险与效益三者的平衡。
2三阶段管理的可行性及挑战性
2.1实施三阶段管理的可行性
从药品全生命周期的角度来说,制药企业药品研发工作一般包括药物发现与筛选、药理毒理学研究、药代动力学研究、药物安全性评价研究、临床研究、生产工艺开发与优化、药学质量研究、中试放大、工艺验证等。其所建立的药品质量管理体系应包含上述各个阶段,同时科学合理地进行项目管理、质量风险管理、生命周期管理、GLP、GCP、GMP和持续改进等[6-9]。
根据最佳三阶段质量管理原则,以及参考ICH Q10(药品质量体系)对药品全生命周期的定义,文章所描述的药品全生命周期三阶段管理如图1所示。从图中可以看出,药品研发质量管理体系的三阶段管理涵盖了上述药品上市前的药品研发工作,以及上市后的IV期临床试验等研究。
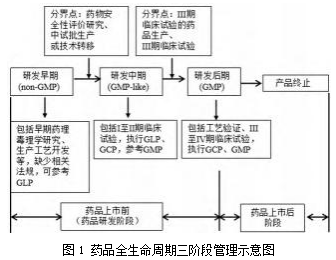
最佳三阶段管理的实施依据及可行性如下所述。
(1)从法规的要求来看,根据ICH通用技术文档(CTD)格式申报资料的要求,药学研究(属于CTD模块2.3和模块3)、非临床研究(属于CTD模块2.4、模块2.6和模块4)、临床研究(属于CTD模块2.5、模块2.7和模块5)是药品研发的三个主要模块;《药品注册核查要点与判定原则(试行)》也包括药学研制和生产现场(属于药学研究)、药理毒理学研究(属于非临床研究)和药物临床试验(属于临床研究)等三大方面的要求,这些能够为建设和优化整个研发过程的质量管理体系提供重要参考。
(2)运用戴明循环(PDCA循环)、全面质量管理(TQM)理论,使企业研发质量管理更具有条理性、科学性和系统性。通过PDCA循环,把药品研发项目的各阶段紧密地联系起来,彼此配合,相互促进。将PDCA循环、TQM等融入药品全生命周期的三阶段质量管理中,用科学的三段式管理理论指导药品研发质量管理体系有效运行,优化企业制度,高效推进研发项目进程,可以最大限度地提高产品质量。
(3)根据药品研发的创新性和周期性特点,在符合法规要求的前提下,以结果(注册申报资料)为导向,参考ICH指导原则中的Q8(药品研发)、Q9(质量风险管理)和Q10(药品质量体系),灵活运用PDCA循环,评估风险与效益,最终制定出与各个制药企业的实际情况相结合的最佳三阶段管理的实施策略。
2.2实施三阶段管理的挑战性
首先,我国微生态活菌制品企业的药品研发质量管理体系建设还不成熟,一些企业人员的质量管理经验不足、质量意识薄弱,研发质量体系的建设难度较大,需要加强人员的沟通与培训。
其次,三阶段质量管理涉及药品研发多个阶段的法规和研发流程等,对研发人员、质量管理人员提出更高的要求。一些企业目前还缺少能熟悉研发各个环节和流程、灵活运用法规指南,将药品研发的实际情况与监管法规相结合并有效实施的复合型人才。
最后,三阶段质量管理的非GMP期尚未有明确的法规进行规范,GMP-like阶段参考GMP实施的“度”也没有统一的标准,企业难以把握,缺乏与监管部门的沟通。
3三阶段质量管理在制药企业的应用
文章以某微生态活菌制药企业药品研发质量管理体系建设为例,该企业前期采用典型的二阶段管理方式,没有一个过渡区,缺少非GMP的体系文件支持,导致各方面质量管理工作落实不到位;对研发中期阶段的中试生产,完全按照GMP执行又太过于严格,灵活性不足,导致研发效率低下。该企业从2021年下半年开始,根据药品的研发特点,基于PDCA循环、TQM、ICH Q10等理论,按照药品研发的各个环节,建立了从“人、机、料、法、环”等方面引入研发早期、研发中期、研发后期的三阶段质量管理的体系优化方案,具体涉及人员、设备、物料、体系文件、环境、研发项目流程等,尤其是在项目流程上,按照从宽松到严格、逐步收紧和管控的方式运行。
以非临床研究的项目运行流程为例,采用访谈法与相关员工进行沟通交流,运用项目管理的工具,参考GLP建立了规范非临床研究专题试验开展的步骤和运行流程,进行了试运行,并在运行过程中不断优化相关体系文件。2022年初,该企业开始正式按照专题承接、撰写研究方案、动物福利与伦理审查、质量审查、专题开展、撰写总结报告和审查归档的流程进行全过程的质量保证。该专题试验运行流程依托于相关体系文件的起草、培训和实施工作,彻底改善了以往专题试验存在方案未生效就实施、试验记录书写不及时、总结报告内容不完整、数据前后不一致等问题。
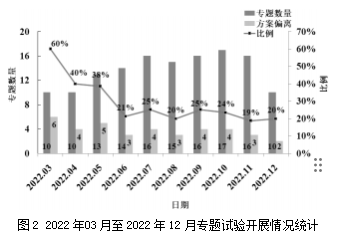
文章统计了2022年3月(开始运行新的非临床研究专题试验流程)至2022年12月专题试验开展情况,如图2所示。从2022年03月开始,专题试验的方案偏离率(与方案数量的占比)为60%,且专题数量从10个(2022年3月)增加至最高达17个(2022年10月),但2022年12月方案偏离率显著降低至不高于25%,因此,该优化后的流程运行初见成效。
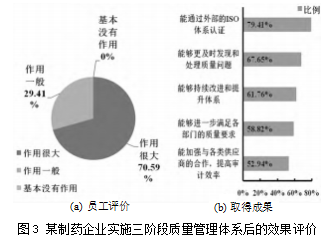
另外,通过问卷调查,收集了该企业68名员工对实施三阶段质量管理体系后的评价。调查结果如图3(a)所示,该企业有70.59%的员工认为本次实施三阶段质量管理的体系优化方案对自身工作有较大的促进作用,仅29.41%的员工认为作用一般。从侧面反映了大部分员工对这次质量管理体系的改进工作有较高的满意度,三阶段质量管理体系的优化策略达到了良好的效果。
研究表明,如图3(b)所示,与2022年相比,分别有79.41%、67.65%和61.76%的员工认为能通过外部的ISO体系认证、更及时发现和处理质量问题、能够持续改进和提升质量体系;其次是能够进一步满足各部门的质量要求,能加强与各类供应商的合作和提高审计效率,分别占比58.82%、52.94%。
4结语
2023年11月,国家药品监督管理局成为药品检查合作计划(PIC/S)正式申请者[10],并以此为契机优化我国药品监管机制,持续提升国内企业质量管理成熟度,这也将对我国制药企业提出更高的要求。但我国制药行业尤其是处在发展阶段的微生态活菌制品行业,还有很大的提升空间。
因此,微生态活菌制药企业、业内专家学者与官方监管机构应进一步加强沟通交流,尽快完善微生态药物相关法规标准和指南等,以期早日实现国内的微生态活菌药物上市零的突破。同时制药企业应当更加重视药品研发阶段的质量管理,提高全员参与的力度,结合自身实际情况,采用基于质量风险管理的最佳三阶段管理原则,建立和持续优化药品研发的三阶段质量管理体系,以保证研发效率并符合监管要求,并进一步推动制药行业的高质量发展。
参考文献:
[1]陈伟.基于三阶段控制的建筑工程施工质量管理研究[J].中国建筑金属结构,2022(9):107-110.
[2]刘玮玥.PDCA循环及三阶段管理在建筑工程质量管理中的应用[J].工程技术研究,2023,8(10):126-128.
[3]张海洲,谢寅,王秀文.新监管环境下药物研发质量管理的思考[C]//中国药物毒理学协会2017年(第七届)药物毒理学年会论文集.太原:中国药物毒理学协会,2017.
[4]卫生部.药品生产质量管理规范(2010年修订):卫生部令第79号[A].北京:卫生部,2011.
[5]杜晓霞,邢花.制药企业药品研发阶段质量管理存在的问题及对策探讨[J].中国药物评价,2018,35(3):230-232.
[6]国家药品监督管理局.国家药监局关于发布药品记录与数据管理要求(试行)的公告:2020年第74号[A].北京:国家药品监督管理局,2020.
[7]张莹,舒璐俊.制药企业药品研发阶段质量管理存在的问题及对策探讨[J].临床医药文献电子杂志,2019,6(78):194.
[8]ICH.Q8(R2):Pharmaceutical Development[S/OL].(2009-08)[2023-11-15].
[9]ICH.Q10:Pharmaceutical Quality System[S/OL].(2008-06-04)[2023-11-05].
[10]国家药品监督管理局.国家药品监督管理局成为药品检查合作计划正式申请者[EB/OL].(2023-11-09)[2023.11.20].










