分子印迹电化学方法优化花生壳中木犀草素提取工艺论文
2024-07-01 10:52:02 来源: 作者:caixiaona
摘要:采用循环伏安(cyclic voltammetry,CV)原位聚合法,以对氨基苯酚(p-aminophenol,p-AP)和3,4-乙烯二氧噻吩(3,4-ethylenedioxythiophene,EDOT)为双功能单体,制备分子印迹聚合物(molecularly imprinted polymer,MIP),用于木犀草素电化学传感器的构建,并进行表征。采用酶解辅助超声波法提取花生壳中木犀草素,结合Box-Behnken响应面法优化提取工艺。结果表明,p-AP和EDOT实现了CV共聚,MIP对木犀草素展
摘要:采用循环伏安(cyclic voltammetry,CV)原位聚合法,以对氨基苯酚(p-aminophenol,p-AP)和3,4-乙烯二氧噻吩(3,4-ethylenedioxythiophene,EDOT)为双功能单体,制备分子印迹聚合物(molecularly imprinted polymer,MIP),用于木犀草素电化学传感器的构建,并进行表征。采用酶解辅助超声波法提取花生壳中木犀草素,结合Box-Behnken响应面法优化提取工艺。结果表明,p-AP和EDOT实现了CV共聚,MIP对木犀草素展示出良好的电催化识别能力;优选最佳提取工艺为酶解时间81 min,酶解温度45℃,超声时间60 min,超声温度45℃,提取率为0.862 0%(RSD=2.287%),与HPLC方法测定结果接近(0.892 2%),说明所建立检测方法准确可靠。
关键词:分子印迹聚合物;电化学传感器;木犀草素;提取工艺;花生壳
0引言
花生作为我国主要的粮油作物之一,其种植面积和产量位居世界前列。而花生壳作为花生的附属产物,年产量约占花生总产量的30%。花生壳富含多种黄酮类化合物,其中以木犀草素为代表,由于其抗氧化、抗菌等多种生理功能[1],在天然食品添加剂及防腐剂方面具有广阔的开发前景[2-3]。然而,目前花生壳绝大部分被用作燃料焚烧处理,不仅污染环境,还导致资源浪费,因此,将花生壳中有效成分木犀草素提取并检测是实现资源合理利用的关键途径之一。
目前,常见的花生壳中木犀草素的提取方法包括溶剂浸取[4]、超声波[5]及酶解[6]等。研究表明,在提取前对花生壳酶解可显著提高黄酮类物质的提取效率。熊清平等[7]采用纤维素酶酶解,60%乙醇溶剂提取法对花生壳中木犀草素进行提取,与传统溶剂提取法相比,提取率提高了2.15倍。超声提取技术是通过增加传质和爆破细胞基质,释放大量的目标化合物,从而提高化合物的提取率。Ali Imran等[5]利用超声提取技术提取花生壳中木犀草素,比传统溶剂提取法的提取率提高了18.7%。故本文选择酶解和超声方法提取花生壳中木犀草素。
近年来,由于低成本、操作简便、响应快,灵敏性好、设备耐用性好且易于携带等优势,电化学传感技术在天然产物有效成分检测[8]方面得到广泛关注。而将分子印迹技术与电化学方法有机融合来提高电化学传感器对响应分子的选择性得到越来越多的关注。MIP膜上印迹空穴(活性位点)的形成有助于增加电极的比表面积和分析物在其表面的积累,从而提高其选择性和灵敏度。故本文拟基于p-AP和EDOT为功能单体制备出MIP,用于新型的分子印迹电化学传感器的构建及木犀草素识别检测,利用酶解辅助超声法提取花生壳中木犀草素,设计响应面实验优化提取工艺,有望为花生壳资源合理利用和质量评价提供一种新检测方法。
1材料与方法
1.1材料与仪器
木犀草素、EDOT、p-AP、冰乙酸、甲醇、乙醇,分析纯,上海麦克林生化科技有限公司;乙腈、甲酸、木犀草素,色谱纯,上海阿拉丁生化科技股份有限公司;半纤维素酶(食品级,5万U/g),科隆特酶制剂有限公司;花生壳,山西省运城市;实验用水均为去离子水。
CHI660E型电化学工作站,上海辰华仪器有限公司;LabRAM HR Evolution型激光共聚焦拉曼光谱仪,日本Horiba;KQ-250DE型数控超声波清洗器,昆山市超声仪器有限公司。
1.2实验方法
1.2.1电极的制备
按照摩尔比为4∶2∶1的比例精密称取p-AP、EDOT和木犀草素,加入LiClO4 0.120 5 g,用一次水超声混合溶解,用去离子水定容至25 mL的容量瓶中,制备得到分子印迹聚合液。将玻碳电极(glassy carbon electrode,GCE)浸入分子印迹聚合液中,采用CV原位聚合法,设置聚合电位范围为0~1.2 V,扫速为0.05 V/s,圈数为4,制得电极。将该电极浸入到0.2 mol/L NaOH-乙醇(体积比为1∶1)溶液中,持续搅拌约30 min,以除去嵌入的模板分子,制备得到MIP/GCE。通过SEM、拉曼、电化学方法对修饰电极材料形貌、结构及电化学行为进行分析。非印迹聚合物(non-molecularly imprinted polymer,NIP)制备过程与MIP/GCE一致,只是聚合液中不加模板分子。
1.2.2检测方法
以pH=4.2醋酸缓冲液为溶剂,制备一系列不同浓度的标准溶液。将所制备的MIP/GCE置于溶液中,富集10 min,采用差示脉冲伏安法(differential pulse voltammetry,DPV)法进行检测。检测条件为电位范围:0~0.8 V,扫速:0.05 V/s,记录DPV峰电流(I),绘制出I与浓度(c)的标准曲线,拟合线性回归方程。结果表明,当浓度范围为0.5~78μmol/L时,I=0.264c+7.651(R2=0.995),检测限为0.15μmol/L。
为了考察该电化学方法的准确性,采用HPLC方法进行验证。色谱条件为:采用C18柱(4.6 mm×250 mm,5μm)为固定相,柱温为35℃,选择V(乙腈):V(0.1%甲酸)=30:70溶液为流动相,以1 mL/min的流速,检测波长为340 nm,进样量为2μL。取木犀草素标准溶液分别进样,记录峰面积(A)。结果表明,当浓度范围为2.5~80μmol/L时,A=0.249c-0.006,R2=0.999 2。检测最佳工艺条件下所制备的花生壳提取液中木犀草素,平行实验3次,计算提取率。
1.2.3花生壳中木犀草素的提取及优化
将花生壳洗净后,在烘箱中于50℃下烘干,研磨后,过30目(0.6 mm)筛;称取2.0 g花生壳粉末,加入半纤维素酶适量,加入16 mL去离子水作为酶解溶剂,在酶解一定时间后向溶液中加入一定比例的无水乙醇至终质量分数为60%,随即进行超声提取,过滤,即得提取液(酶解前后、超声前后需称重,如有损耗补重)。精密吸取一定体积提取液至25 mL容量瓶中,用pH=4.2 ABS定容至刻度,照1.2.2中方法测定,并带入式(1)计算提取率(g):
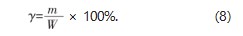
式中:γ为木犀草素提取率,%;m为样品中木犀草素的质量,g;W为花生壳取样量,g。
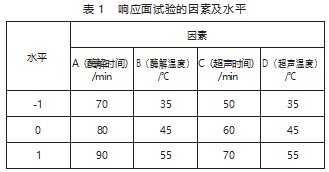
为了探究单一因素对花生壳中木犀草素提取率的影响,在其他条件相同的条件下,分别选择提取料液比[1:15、1:20、1:25,(g:mL)]、酶用量(0.05%、0.1%、0.15%、0.2%、0.25%)、酶解温度(35、45、55、65、75℃)、酶解时间(50、60、70、80、90 min)、超声时间(30、40、50、60、70 min)、超声温度(35、45、55、65、75℃)、超声功率(150、175、200、225、250 W)因素进行研究,并选出对提取率影响较大的因素及水平。
根据单因素实验结果,选出对提取率影响较大的4个因素酶解时间(A)、酶解温度(B),超声时间(C)、超声温度(D),因素及水平见表1。采用软件Design Expert 8.0.6中Box-Behnken中心组合设计实验方案,根据1.2.2项下电化学方法检测,测定DPV峰电流,利用标准曲线,计算提取液的浓度,并换算出提取液中木犀草素的质量,根据式1计算提取率(g)。
2结果与分析
2.1电极材料的表征
2.1.1 SEM表征
由图1可知洗脱后的MIP呈突出泡状和凹陷槽状相间的形貌,分布较为均匀,这可能是洗脱后模板分子的离开所致。这样的结构可有助于增加电极表面积,提高对木犀草素的吸附能力。

2.1.2结构分析
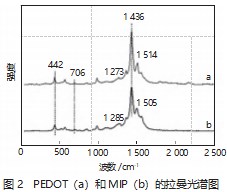
图2为PEDOT(a)和MIP(b)的拉曼光谱图。由图2可以看出,在442、706、1273、1 436、1 514 cm-1处出现了PEDOT的特征吸收峰,分别对应C-O-C键变形,C-S-C键变形,-Cα=Cβ-对称伸缩,-Cα-Cα′内环伸缩,-Cα=Cβ-反对称伸缩[9-10]。在MIP的拉曼光谱中,除了可以观察到PEDOT的大多数特征吸收峰外,在1 285、1 505 cm-1处出现新的明显吸收峰,分别对应PpAP的苯型结构的-C-N-伸缩振动和醌型结构的-C=N-的伸缩振动[11]。故说明p-AP和EDOT单体在GCE表面实现了CV原位共聚,成功制备出MIP。
2.1.3选择性分析
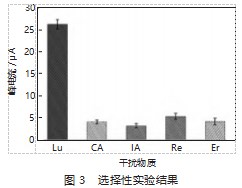
选择花生壳中与木犀草素结构相似的组分:绿原酸(CA)、异绿原酸A(IA)、白藜芦醇(Re)、圣草酚(Er)作为干扰物质,将MIP/GCE分别置于浓度为10μmol/L各组分溶液中,采用DPV法检测,考察电极对木犀草素(Lu)的选择性,结果见图3。如图3所示,MIP/GCE对Lu的峰电流分别为CA、IA、Re、Er的6.4、8.1、4.9、6.2倍,说明MIP/GCE对木犀草素具有良好的选择性和识别能力。
2.2花生壳中木犀草素提取工艺的优化
采用Design Expert 8.0.6中Box-Behnken中心组合设计四因素三水平响应面实验,以酶实验设计方案及响应面结果如表2所示。
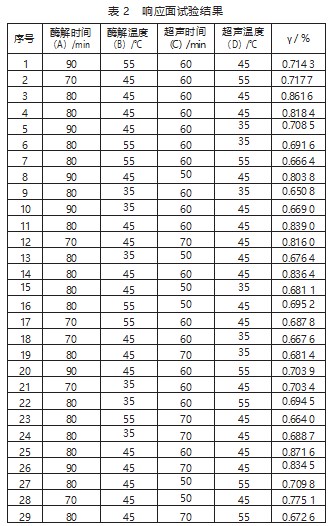
经响应面软件对数据回归拟合,得到以提取率为目标函数方程:g=0.85+5.512×10-3A+3.050×10-3B+1.308×10-3C+6.954×10-3D+0.015AB-2.550×10-3AC-0.014AD-0.011BC-0.017BD-9.400×10-3CD-0.030A2-0.11B2-0.043C2-0.100D2。由AVOVA方差分析(表3)可知,所建立的回归模型P=0.000 6,<0.01,说模型高度显著,预测模型的R2=0.986 6,模型失拟误差P=0.127 3,>0.05,说明模型失拟项不显著,故本文所建立的拟合模型可较好地反映各因素对木犀草素提取率的变化趋势。变异系数[CV(%)]为4.69%,<10%,表明所建模型的重现性好;精密度(Adeq Precision)是有效信号与噪声的比值,为8.889,>4,说明所建立的模型合理[12]。同时,模型变量B2、C2和A2的P值均<0.01,说明该变量高度显著。
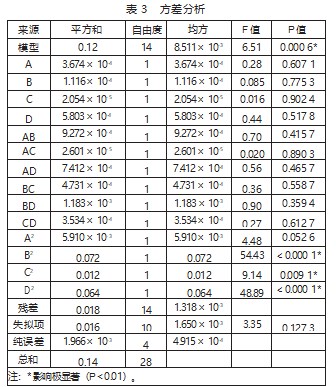
图4为各变量对木犀草素提取率影响的响应面曲线图,随着酶解温度和时间、超声温度和时间的增加,提取率呈增大的趋势,但进一步增加温度和时间,提取率均下降。结合表2中四因素P值可知,可以得出四因素对提取率的影响排序为超声温度>酶解时间>酶解温度>超声时间。
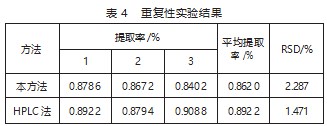
经响应面软件分析可得花生壳木犀草素的最佳提取工艺为酶解时间为80.92 min,酶解温度为45.18℃,超声时间为60.08 min,超声温度为45.27℃,为了便于实验操作,将该提取工艺调整为酶解时间为81 min,酶解温度为45℃,超声时间为60 min,超声温度为45℃,模型预测提取率为0.877 0%。在此提取工艺条件下平行制备3次,计算提取率,平均提取率为0.862 0%(RSD=2.287%),接近模型预测值,说明所建模型合理有效。同时该提取率大于单因素实验的最大提取率(0.712 4%),说明通过响应面软件设计实验优化了提取方案,显著提高了木犀草素的提取率。由表4可知,HPLC法测得最佳提取工艺条件下花生壳中木犀草素平均提取率为0.892 2%(RSD=1.471%),与本论文所建立的电化学方法结果接近,说明本方法是准确可靠的。
3结论
本文采用CV原位共聚法,在电极表面制备出PpAP-PEDOT分子印迹聚合物,实现花生壳提取液中木犀草高效识别与检测。采用半纤维素酶酶解辅助超声法提取花生壳中木犀草素,结合响应面软件,优化出花生壳中木犀草素的最佳提取工艺为酶解时间81 min,酶解温度45℃,超声时间60 min,超声温45℃,提取率为0.862 0%(RSD=2.28 7%),是单因素实验所得最大提取率的1.2倍,说明提取工艺得到进一步优化。该结果与HPLC方法测定结果接近(0.892 2%),说明所建立方法准确可靠。故本文建立了一种简单快速准确的电化学检测方法,可实现花生壳中木犀草素提取工艺优化,为花生壳资源利用提供更有效的检测技术服务。
参考文献:
[1]王伟,何平,江小明.木犀草素及其黄酮苷的抗炎、抗氧化作用[J].食品科学,2020,41(17):208-215.
[2]Neuls M M,Espino M,Fernandez M,et al.NADES for food industry innovation:novel bioadditives based on olive oil byproducts[J].Food and Bioproducts Processing,2022,134:193-201.
[3]Qian W D,Liu M,Fu Y,et al.Antimicrobial mechanism of luteolin a-gainst Staphylococcus aureus and Listeria monocytogenes and its an-tibiofilm properties[J].Microbial Pathogenesis,2020,142:104056-104062.
[4]冯亚莉,曹智威,顾悦馨,等.连续萃取法从花生壳中提取木犀草素的研究[J].食品研究与开发,2021,42(10):93-98.
[5]Imran Ali,Humiyion M,Arshad M U,et al.Extraction,amino acides-timation,and characterization of bioactive constituents from peanut shell through eco-innovative techniques for food application[J].In-ternational Journal of Food Properties,2022,25(1):2055-2065.
[6]曾超珍,刘志祥.响应面优化酶法提取花生壳黄酮类化合物的工艺研究[J].湖北农业科学,2016,55(6):1532-1536.
[7]熊清平,张强华,石莹莹,等.酶法辅助提取花生壳中木犀草素的工艺研究[J].中国酿造,2012,31(1):46-49.
[8]Tang J,Huang R,Zheng S,et al.A sensitive and selective electro-chemical sensor based on graphene quantum dots/gold nanoparticles nanocomposite modified electrode for the determination of luteolin in peanut hulls[J].Microchemical Journal,2019,145:899-907.
[9]Rodriguez-jimenez S,Bennington M,Akbarinejad A,et al.Electroac-tive metal complexes covalently attached to conductive PEDOT Films:A spectroelectrochemical study[J].Applied Materials&Interfaces,2021,13(1):1301-1313.
[10]Kulandaivalu S,Zainal Z,Sulaiman Y.Influence of monomer concen-tration on the morphologies and electrochemical properties of PEDOT,PANI,and PPy prepared from aqueous solution[J].International Journal of Polymer Science,2016,2016:1-12.
[11]Chen C,Wei F,Zhang Q,et al.High performance of supercapacitor based on nitrogen-doped graphene/p-aminophenol electrodes[J].Ionics,2015,21:2639-2645.
[12]Luo X,Bai R,Zhen D,et al.Response surface optimization of the en-zyme-based ultrasound-assisted extraction of acorn tannins and their corrosion inhibition properties[J].Industrial Crops&Products,2019,129:405-413.










