土壤微生物环保修复技术的具体应用论文
2024-06-29 17:27:07 来源: 作者:zhouxiaoyi
摘要:研究了过硫酸盐(PS)氧化和微生物技术的石油烃(TPHs)污染土壤修复技术,以β-环糊精为辅,对Fe2+螯合活化PS,同时加入功能菌(GZ6)进一步提高TPHs降解效果。通过研究TPHs酶活性、降解率变化,对PS氧化微生物修复方案对污染土壤TPHs的修复机制。结果表明,PS氧化功能菌修复方案(CMB)对土壤TPHs降解率可以达到80%以上,GZ6功能菌的加入激活了土壤汇中的TPHs降解菌,进一步增加了土壤中微生物的数量,增强了TPHs的降解效果。
摘要:研究了过硫酸盐(PS)氧化和微生物技术的石油烃(TPHs)污染土壤修复技术,以β-环糊精为辅,对Fe2+螯合活化PS,同时加入功能菌(GZ6)进一步提高TPHs降解效果。通过研究TPHs酶活性、降解率变化,对PS氧化微生物修复方案对污染土壤TPHs的修复机制。结果表明,PS氧化功能菌修复方案(CMB)对土壤TPHs降解率可以达到80%以上,GZ6功能菌的加入激活了土壤汇中的TPHs降解菌,进一步增加了土壤中微生物的数量,增强了TPHs的降解效果。
关键词:土壤;微生物;过硫酸盐
0引言
土壤污染作为一种非常复杂的环境问题,其具有隐蔽性、潜伏性、持续性、广泛性等特点,如果不对其进行有效治理,将会产生严重的环境污染后果。随着我国城市化进程的不断加快,城市垃圾、工业废弃物、农药化肥等各种固体废弃物源源不断地流入农村地区,在不断的积累下,这些固体废弃物已经严重污染了土壤环境[1]。土壤污染已经成为了我国农村地区主要的环境问题之一,也是影响我国农业发展和农村经济发展的主要原因之一。近年来,国家也开始高度重视土壤污染问题,并将其作为农业可持续发展战略的重要组成部分进行全面推进。
1实验部分
1.1实验材料与设备
实验土壤:从某石油化工管线输送公司的工厂场地中采集,经过14 d的陈化后,用30目(0.613 mm)筛筛选后将其冷冻、干燥处理,并置于4℃的避光室中保存,称为CK。该土壤为粉砂质壤土,其石油烃含量为16 622.89 mg/kg,pH值为8.37,含水量为1.57%,电导率为154μS/cm,有机质质量分数为3.7%,氧化还原电位为86 mV,阳离子交换容量为0.088 mol/kg,总碳质量分数为3.8%,总氮含量为937 mg/kg,以及总磷含量为720 mg/kg。
用于TPHs降解的特定细菌:通过内部培养及筛选技术,获得一株能在低温环境(<15℃)下生长的细菌株,归类于霍氏肠杆菌属,本实验中标记为GZ6。该种细菌不仅能够合成生物表面活性物质,而且能够对三氯苯酚进行降解[2]。
实验试剂包括过硫酸钠、铁粉、FeSO4·7H2O、正己烷、丙酮、β-环糊精。
实验仪器包括气相色谱仪、便携式ORP/DO/pH/EC仪、可见光分光光度计、气象色谱-质谱联用仪等。
1.2实验设计
采用过硫酸盐氧化(PS氧化)和过硫酸盐氧化-微生物(PS微生物)修复两种方案,每种实验方案均设置实验组和对照组。其中,PS氧化实验方案对照组将1.5%的PS、0.071%的铁粉和0.876%的FeSO4·7H2O(其中百分数分别为对应物质的质量分数,下同)的溶液混合后加入实验土壤汇总,土壤和实验药剂质量比为10∶(8~10),该对照组记为OX1。实验组在OX1的基础上加入0.357%的β-环糊精螯合剂,该实验组记为OX2;PS微生物实验方案对照组与OX1相同,同时采用土著菌微生物修复土壤,记为CB。实验组与OX2相同,微生物采用GZ6菌,记为CMB。
在PS微生物修复实验流程中,0~12 d设定为PS氧化修复阶段,随后的13~17 d为过渡期,此时土壤完成PS氧化后接受微生物修复的准备,而从18~60 d则为微生物修复阶段。
1.3分析方法
1.3.1土壤理化特性分析
对于土壤中的总石油烃(TPHs)含量,采用HJ 1021—2019标准的气相色谱法进行定量分析;土壤的电导率(EC)依照HJ802—2016标准的电极法进行测量;为评估土壤的氧化还原电位(ORP),执行HJ 746—2015标准的电位法;土壤pH值的测定遵循HJ 962—2018标准的电位法;使用气相色谱-质谱联用技术(GC-MS)检测土壤微生物修复阶段中分解代谢产物的变化[3]。
1.3.2土壤酶活性分析
用改良三苯基四唑氯化物还原方法(按三苯基甲胺1 h内在1 g土壤中的产出率计算)检测土壤中的脱氢酶活力;土壤中脂解酶活性的测定采用分光光度测量技术;同时,数据的统计和基因序列的比对分析则利用SOAP aligner软件平台进行。
2结果与讨论
2.1土壤中TPHs及其组分的修复期变化情况
2.1.1 TPHs的时序变化趋势
图1为不同处理时期污染土壤中石油烃含量变化情况。从图1可以看出,经过PS氧化实验后,PS微生物实验土壤中TPHs含量呈现快速下降趋势;当经过12d的处理后,CB和CMB处理的土壤中TPHs含量从初始的16 521.76 mg/kg降至7 523.61 mg/kg和7 848.80 mg/kg,去除率分别达到了53.9%和52.7%。结果表明,在PS氧化实验的早期阶段,β-环糊精对于TPHs降解的促进作用并不明显。可能是由于螯合剂及土壤中的有机质与污染物之间发生了自由基竞争作用,从而影响了PS的有效利用率。
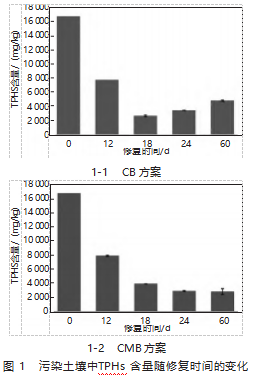
随着修复进程的延续,CB与CMB处理策略下的TPHs水平持续降低。在处理的第60d,CB与CMB方法处理后的土壤TPHs含量分别降至4 632.61 mg/kg和2 715.76 mg/kg,对应的TPHs去除效率达到了72.1%和82.3%。与CB方案相比,CMB方案在去除TPHs方面的效率提升了29.6%,显著优于CB方案。
CB方案中采用了铁离子(Fe2+)激活的氧化微生物修复策略,而CMB方案结合了β-环糊精螯合铁离子激活的氧化微生物。通过两种策略的比较分析,明显可以看出β-环糊精通过螯合Fe2+延长了激活脱氢酶活力;土壤中脂解酶活性的测定采用分光光度测量技术;同时,数据的统计和基因序列的比对分析则利用SOAP aligner软件平台进行。
2结果与讨论
2.1土壤中TPHs及其组分的修复期变化情况
2.1.1 TPHs的时序变化趋势
图1为不同处理时期污染土壤中石油烃含量变化情况。从图1可以看出,经过PS氧化实验后,PS微生物实验土壤中TPHs含量呈现快速下降趋势;当经过12d的处理后,CB和CMB处理的土壤中TPHs含量从初始的16 521.76 mg/kg降至7 523.61 mg/kg和7 848.80 mg/kg,去除率分别达到了53.9%和52.7%。结果表明,在PS氧化实验的早期阶段,β-环糊精对于TPHs降解的促进作用并不明显。可能是由于螯合剂及土壤中的有机质与污染物之间发生了自由基竞争作用,从而影响了PS的有效利用率。
随着修复进程的延续,CB与CMB处理策略下的TPHs水平持续降低。在处理的第60d,CB与CMB方法处理后的土壤TPHs含量分别降至4 632.61 mg/kg和2 715.76 mg/kg,对应的TPHs去除效率达到了72.1%和82.3%。与CB方案相比,CMB方案在去除TPHs方面的效率提升了29.6%,显著优于CB方案。
CB方案中采用了铁离子(Fe2+)激活的氧化微生物修复策略,而CMB方案结合了β-环糊精螯合铁离子激活的氧化微生物。通过两种策略的比较分析,明显可以看出β-环糊精通过螯合Fe2+延长了激活剂的作用时间,并减缓了游离基团对土壤和微生物的负面影响,从而为微生物修复创造了有利条件。此外,引入GZ6功能性微生物不仅为生物修复和化学氧化的间隔期提供了降解石油烃的有效菌种,还能通过降低原油的表面张力来增强石油的溶解性和降低黏度,进而提升对TPHs的降解能力。
2.1.2 TPHs馏分变化
图2为受污染的土壤中,各种TPHs组份的含量随时间变化情况。TPHs各组份的降解性从大到小分别是C31~C40、C18~C30、C10~C17。
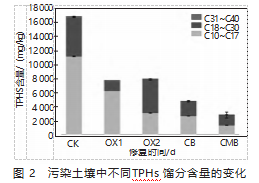
从图2可以看出,CK中,C10~C17馏分的含量为10 986.69 mg/kg,含量最高;C31~C40馏分的含量为169.29 mg/kg,含量最低;C18~C30馏分的含量为5 398.01 mg/kg;PS对OX1和OX2的馏分进行了深度氧化后,OX1中C10~C17的脱除率达到了45.1%,OX2中C10~C17的脱除率达到了71.2%。
在实验期60 d内,CB实验方案中C10~C17馏分的总含量为2 594.05 mg/kg脱除率为76.1%;C18~C30的总含量为2 048.30 mg/kg,脱除率为79.1%;C31~C40的总含量为36.15 mg/kg,脱除率为78.9%;CMB实验方案中C10~C17馏分总含量为1 321.53 mg/kg,脱除率为87.8%;C18~C30馏分总含量为1 426.55 mg/kg,脱除率为74.1%;C31~C40馏分为41.29 mg/kg,脱除率为73.1%。
与CB实验方案相比,CMB实验方案中C10~C17和C18~C30去除率有较大幅度的提升,提升幅度分别为12%、11.5%,由此可见CMB实验方案修复土壤效果优于CB实验方案。
通过气相色谱-质谱联用技术对TPHs的分解产物进行分析。检测到的降解产物类别包括长链烷烃、烯烃、支链烷烃、芳香烃以及环烷烃等类型,具体化合物涵盖环己烷、邻苯二甲酸酯、苯酚、C15~C20的长链烷烃以及其他支链化合物,其中主要以中链烷烃为主要成分。长链烷烃(C25~C40)因其为固态疏水性化合物、溶解度较低而难以被生物作用降解;然而,GZ6菌株能通过分泌生物表面活性剂来增加TPHs的溶解度,从而提升其降解效率。
2.2修复期间土壤化学性质的变化
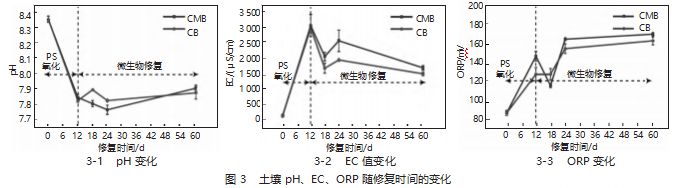
图3为不同处理时期的土壤pH值、EC值和ORP值的变化情况。从图3-1可以看出,在PS氧化期,CB和CMB两种修复方案中土壤的pH值都有较大幅度的下降,在12 d后,pH值从最初的8.25分别下降到7.79和7.80;在修复时间60 d后,两种修复方案下的土壤pH值分别上升到7.86和7.90。
从图3-2可以看出,在PS氧化期,CB和CMB实验方案的土壤中的EC都有较大幅度的增长,在12 d修复期间,EC由152.4μS/cm的最初值分别上升到3 018μS/cm和3 101μS/cm。EC急剧增加由于在修复过程中引入的亚铁活化剂和PS氧化作用生成了额外的离子,这些离子的增多导致EC值的显著提高。
随着修复治疗的持续,硫酸根(SO42-)和钙离子(Ca2+)等可能会以矿物的形式沉淀,同时部分可溶解的矿物质会被微生物吸收并代谢。当修复时间达到60d的时候,CB和CMB土壤的EC逐步下降到1 449μS/cm和1 720μS/cm。
从图3-3可以看出,在PS氧化期,CB和CMB两种实验方案的土壤中的ORP快速升高,在12 d后,ORP从最初的86 mV分别升高到126 mV和145 mV;在60 d后,CB实验方案的ORP值达到162 mV,而CMB实验方案的ORP值则达到169 mV。CMB实验方案的ORP较CB有显著升高,主要是由于GZ6与土壤降解菌群之间存在着相互协作关系,从而增加了TPHs的生物可利用性,并提高了微生物的总呼吸速率,因此CMB实验方案的ORP值高于CB实验方案。
2.3土壤酶活性变化
图4为不同处理时期,不同处理条件下土壤中的脱氢酶、脂酶活性变化情况。从图4-1可以看出,在PS氧化阶段,残留在土壤中的SO42-、Fe3+、Na+会干扰细胞的渗透平衡,导致脱氢酶活性降低。经过24 d的修复,脱氢酶活性观测到显著的峰值,CB实验方案的土壤中脱氢酶活性为2.66μg/g,CMB实验方案的土壤中脱氢酶活性为2.94μg/g。
修复时间延长,土壤中可供微生物利用的碳源逐步消耗,与此同时脱氢酶活性也出现下降趋势。在土壤中,脂肪酶的活力也呈现出类似于脱氢酶的变化趋势(如图4-2所示)。在48d的修复过程中,CB和CMB实验方案中的脂肪酶活性最高,分别为195.4μg/g,218.5μg/g。结果表明,在中等或较低的氧化剂浓度下,酶活性被激活,当其活性达到最大值时,TPHs降解效率提高。
3结论
本实验采用过硫酸盐氧化(PS氧化)和过硫酸盐氧化-微生物(PS微生物)修复两种方案,对土壤理化性质和酶活性的分析。
1)CB和CMB实验方案中,TPHs含量呈现快速下降趋势;在60d后,C10~C17的脱除率达到了45.1%,OX2中C10~C17的脱除率达到了71.2%。另外,GZ6功能菌可以增强其对TPHs的降解效果。
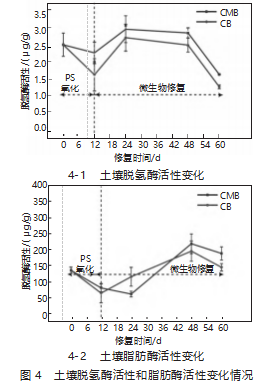
2)CMB处理后24 d及48 d,脱氢酶及脂肪酶的活性达2.94、218.5μg/g,与CB处理后的脱氢酶及脂肪酶的活性2.69、196.5μg/g相比,分别增加了0.25、22.8μg/g。通过预氧化作用,激活菌株中的脂类及脱氢酶,加速THPs胞外酯基团的裂解,可以增强其溶解性,进而加快TPHs的生物降解。
参考文献
[1]林海,陈茜,李强,等.石油污染土壤的生物修复研究进展[J].化学与生物工程,2023,40(5):1-8.
[2]林静宇,张效刚,李耀晃,等.植物耦合微生物燃料电池修复六价铬污染土壤的研究[J].山西化工,2023,43(4):201-203.
[3]阿音嘎,张军,赵玢权,等.探析土壤污染修复技术及土壤生态保护措施[J].清洗世界,2023,39(4):138-140.










